小麦TaBTLs基因家族全基因组鉴定与表达模式分析*
2023-05-18景凡丽苗永平张沛沛杨德龙
车 卓,景凡丽,苗永平,张沛沛,陈 涛,刘 媛,杨德龙,
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.甘肃省种子总站,甘肃 兰州 730020;3.干旱生境作物学国家重点实验室,甘肃 兰州 730070)
小麦(Triticum aestivumL.)作为世界上主要的粮食作物之一,为35%以上的人口提供了约20%的总热量和蛋白质,对全球粮食和营养安全至关重要[1]。然而,由于世界人口的不断增长、极端气候的变化以及耕地面积的减少,小麦的可持续生产将面临巨大的挑战。据估计,小麦产量必须以每年至少2.4%的速率增长,才能满足未来30 年养活94 亿人口的粮食需求[2-3]。因此,改善小麦产量性状,培育出抗逆、稳产、高产和广适的小麦新品种具有重要意义[4]。
泛素/26S 蛋白酶体系统是植物调控生长发育和响应非生物胁迫最重要的机制之一[5-7],它通过26S 蛋白酶体调节蛋白质的降解[8],在植物信号转导、代谢调节、分化和应激反应等过程中均发挥着重要的作用[9]。泛素化途径包括E1 泛素激活酶、E2 泛素结合酶和E3 泛素连接酶3 种关键酶,其中,E1 与E2 相对保守,而E3 具有高度多样性,决定了底物的特异性[7,10]。因此,E3 泛素连接酶是泛素化级联反应中成员最多、研究最多的组分。E3 泛素连接酶主要包含U-box、RING(really interesting new gene)、HECT (homologous to the E6AP carboxyl terminus)和Kelch-type 共4 种类型,此外还有一些成员较少的E3 泛素连接酶家族[11-12]。E3 泛素连接酶通过调控不同底物的泛素化降解,在植物生长发育和非生物胁迫反应中发挥重要的作用[13-14],如参与调控器官发育[15]、昼夜节律[16]、叶片衰老[17]、植物细胞死亡和防御[18]、植物激素以及生物胁迫信号响应等过程[16,19-20]。
ATLs 家族属于一种RING 型E3 泛素连接酶,其包含RING-H2 结构域和位于N 端的疏水结构域。ATLs 在调节植物生命活动中发挥重要的功能[21],如参与植物的防御反应和细胞调控过程,对植物激素的响应、植株育性和植物开花过程也有非常重要的影响。BTLs (BCA2 zinc finger ATLs)是一类与ATLs 家族结构具有共同特征的RING 型E3 泛素连接酶,它包含RING-H2 和BZF保守结构域,其中RING-H2 可能与E3 泛素连接酶活性有关,BZF 可能与泛素相互作用,进而在维持BTL 的稳定性方面起重要的作用[22-23]。BTLs在拟南芥(Arabidopsis thalianaL.)生长发育和逆境响应过程中也具有重要的作用,如:过表达BTLs基因能促使拟南芥株系根尖结构发生改变,可能参与植株根系构型[24];BTLs基因参与早期植物对盐胁迫的响应,与盐胁迫下的光合速率和生长密切相关[25]。同时,BTLs基因在盐胁迫下不仅能通过GID1 的降解抑制幼苗生长和种子萌发,还负调控赤霉素信号通路[26]。部分BTLs基因积极参与ABA 介导的干旱胁迫响应[27],能够提高脯氨酸含量,增强拟南芥抗旱性[28]。尽管BTLs基因在植物中广泛存在,但小麦TaBTLs基因的生物学功能以及相关调控机制鲜有报道,依然有许多潜在的与小麦生长发育和非生物胁迫相关的TaBTLs基因尚待挖掘,其功能需进一步验证。因此,本研究利用小麦参考基因组,对TaBTL基因家族进行系统鉴定和分类,构建系统发育树和基因组共线性分析,并结合小麦RNA-Seq 数据库对TaBTL基因家族成员的表达模式进行研究,旨在为进一步深入研究该基因家族的功能提供理论依据和前期工作基础。
1 材料与方法
1.1 小麦TaBTLs基因家族成员鉴定
在EnsemblePlants 数据库(https://plants.ensembl.org/)下载小麦全基因组数据、CDS 序列、蛋白序列和注释文件,以拟南芥(Arabidopsis thalianaL.)和水稻(Oryza sativaL.)中已报道的BTLs蛋白序列为参考序列,利用TBtools 软件对小麦全基因组进行BLAST 检索(阈值E<1×10-5,序列相似度大于60%),将得到的小麦TaBTLs候选基因去除重复后提交至PFAM (https://pfam.xfam.org/search)、NCBI-CDD (https://plants.ensembl.org/)和SMART数据库(http://smart.embl-heidelberg.de/),进一步确定小麦TaBTLs 所特有的保守结构域;利用ExPASy (https://web.expasy.org/)预测小麦Ta-BTLs 蛋白序列的分子量和等电点等理化性质。
1.2 小麦TaBTLs 系统发育树的构建、基因结构和保守序列分析
利用MEGA 11.0 软件[29]中的Clustal W 法对小麦、拟南芥和水稻BTLs基因进行多重序列比对,采用邻接法构建系统进化树,进一步研究基因在进化过程中的保守性;利用在线软件GSDS(http://gsds.gao-lab.org/)对小麦TaBTLs家族成员的基因结构进行分析;利用MEME 数据库(http://meme.nbcr.net/meme)识别小麦TaBTLs 蛋白保守基序,motif 数量设置为10,使用TBtools 软件进行可视化作图。
1.3 小麦TaBTLs基因的复制事件及同源性分析
使用TBtools 软件[30]的One Step MCScanX 模块进行共线性分析;再使用该软件的SimpleKa/KsCalculator 模块计算重复基因对的同义替换率(Ks)和非同义替换率(Ka),Ka/Ks>1 时为正向选择,Ka/Ks=1 时为中性选择,Ka/Ks<1 时为纯化选择[31]。
1.4 小麦TaBTLs顺式作用元件分析
利用TBtools 软件从小麦全基因组序列中提取小麦TaBTLs基因起始密码子上游2 000 bp 的DNA 序列,提交至在线数据库PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/) 分析顺式作用元件。
1.5 小麦TaBTLs基因的表达分析
利用小麦多组学数据库[32]下载小麦TaBTLs基因在不同组织(根、茎、叶、穗和籽粒)中和非生物胁迫(PEG6000 和NaCl)处理下的RNA-Seq数据,分析小麦TaBTLs基因家族成员的差异表达特征,使用每千个碱基转录每百万映射读取的转录本(transcripts per kilobase of exon model per million mapped reads,TPM)评估TaBTLs基因表达水平,使用TBtools 软件归一化处理后进行可视化作图。
2 结果与分析
2.1 小麦TaBTLs基因家族成员的鉴定和序列分析
共鉴定出35 个TaBTLs基因家族成员,根据它们在染色体上的分布分别命名为TaBTL1~TaBTL35(表1)。该家族成员蛋白长度介于280(TaBTL17、TaBTL21 和TaBTL23)~404 aa (TaBTL-24 和TaBTL26),其编码蛋白的相对分子量介于29.64 (TaBTL21 和TaBTL23)~45.16 ku (TaBTL26),等电点介于4.30 (TaBTL5 和TaBTL8)~9.11 (TaBTL27 和TaBTL29),TaBTLs 家族编码的氨基酸多呈酸性。其中,23 个TaBTLs 蛋白的等电点小于7,偏酸性;12 个TaBTLs 蛋白的等电点大于7,偏碱性。

表1 小麦TaBTLs基因家族成员的特征Tab.1 Characteristics of theTaBTLsgene members in wheat
2.2 小麦TaBTLs 系统进化树
17 个拟南芥、16 个水稻、20 个玉米和35 个小麦BTLs 蛋白序列构建的系统发育树(图1)显示:BTLs 可分为7 大类,除第Ⅳ和Ⅴ不存在小麦TaBTLs基因分布外,第Ⅰ、Ⅱ、Ⅲ、Ⅵ和Ⅶ均包含拟南芥、水稻、玉米和小麦BTLs 家族成员,且小麦TaBTLs基因家族成员与水稻和玉米亲缘关系最近,与拟南芥亲缘关系较远,推测小麦TaBTLs基因与水稻和玉米可能由共同祖先进化而来,且行使相似的生物学功能。

图1 BTLs 系统进化树分析Fig.1 Phylogenetic tree analysis of BTLs
2.3 小麦TaBTLs家族成员的基因结构和蛋白保守基序分析
多数小麦TaBTLs基因家族成员均含有1 个外显子,基因结构相对保守。对TaBTLs同源基因聚类分析发现:小麦TaBTLs基因家族的同源基因都处于同一个分支。MEME 数据库共鉴定出10 个保守基序(motif),分别命名为motif1~10(图2),其中,motif1 为RING-H2 结构域,motif3和motif5 为BZF 结构域(图3),且所有小麦TaBTLs 家族成员均含有motif1、motif3 和motif5,说明各家族成员之间较为保守。
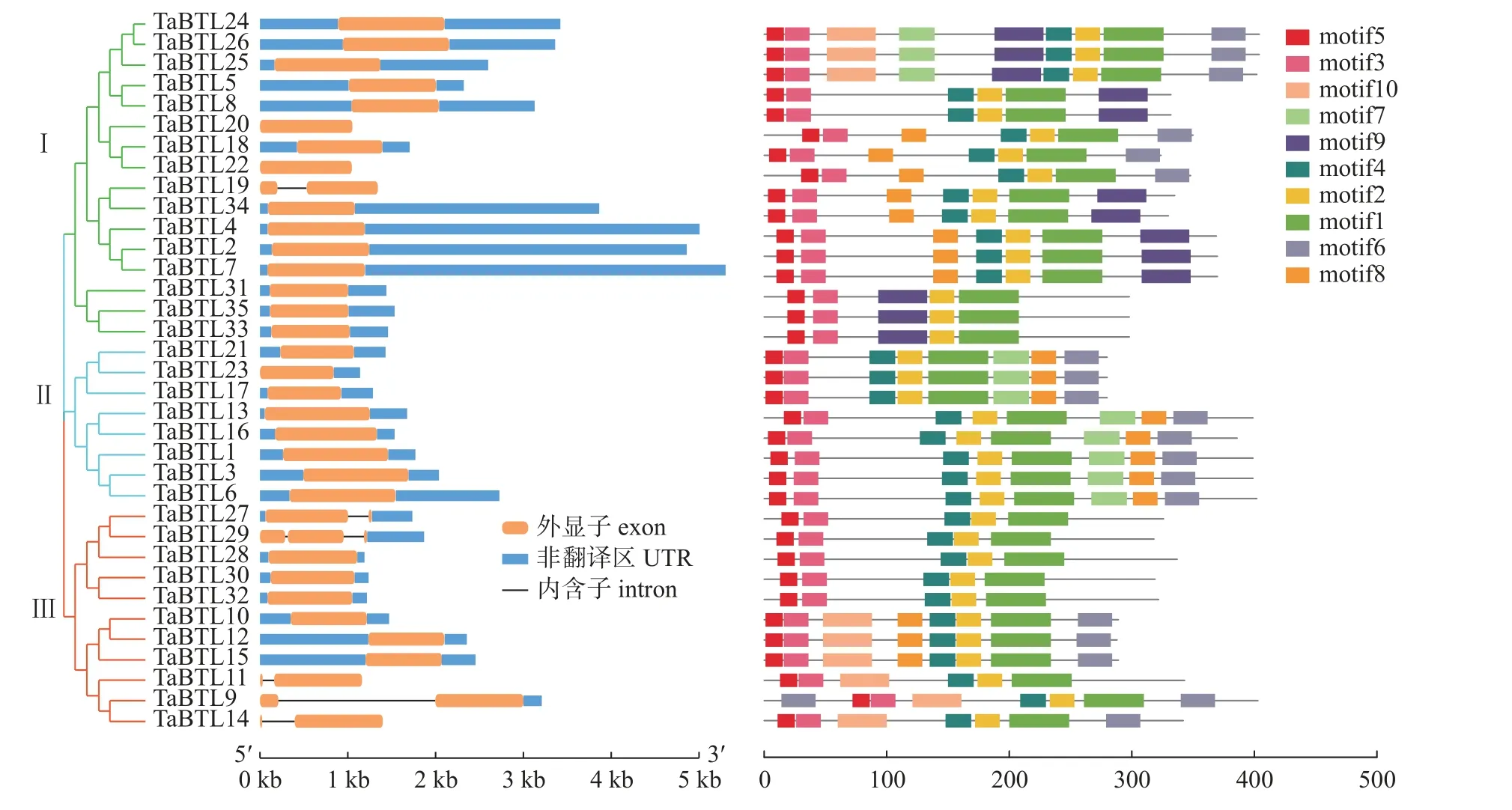
图2 小麦TaBTLs 家族系统进化树、基因结构和蛋白保守基序分析Fig.2 Phylogenetic tree,gene structure and conserved motif analysis of TaBTLs family in wheat

图3 小麦TaBTLs 保守结构域Fig.3 Conserved domains of TaBTLs in wheat
2.4 小麦TaBTLs基因染色体定位和基因复制
染色体定位发现:小麦TaBTLs基因分布在除第2 同源群(2A、2B 和2D)外的所有同源群上,其中,第5 同源群和第6 同源群上的基因分布最少(图4a)。BTLs是一个多基因家族,基因家族的扩张和新功能的获得受重复事件的显著影响,对该基因家族进行物种内和物种间的进化分析发现:在小麦TaBTLs基因家族中,20 对基因发生了片段复制,基因之间未发生串联重复,说明片段复制是TaBTLs基因家族扩张的主要原因。对拟南芥、水稻和小麦BTLs基因进行物种间的共线性分析发现:6 对TaBTLs基因与AtBTLs基因具有共线性,20 对TaBTLs基因与OsBTLs基因具有共线性(图4b),进一步表明小麦和水稻中的BTLs基因具有密切的亲缘关系,可能具有相似的生物学功能。此外,小麦TaBTLs基因对的Ka/Ks值均小于1,表明小麦TaBTL基因的重复事件由纯化选择压力驱动。

图4 BTLs 家族共线性分析Fig.4 Synteny analysis of BTLs family
2.5 小麦TaBTLs的顺式作用元件
共筛选出26 个顺式作用元件,包括逆境胁迫响应调控元件(12 个)、生长发育调控元件(6 个)和植物激素应答调控元件(8 个) (图5)。在激素应答元件中,大多数小麦TaBTLs基因含有脱落酸响应结合元件(ABRE),推测小麦TaBTLs可能参与ABA 信号转导调控;小麦TaBTLs基因含有大量逆境胁迫响应元件,如TC-rich repeats(防御和压力响应元件)、W-box 和MBS (参与干旱诱导)以及LTR (参与低温诱导)等;在小麦TaBTLs基因启动子区预测到与生长发育相关的顺式作用元件,如CAT-box (植物分生组织表达相关元件)等。以上结果表明:小麦TaBTLs基因家族成员可能在小麦生长发育调控和非生物胁迫的响应中发挥重要作用。

图5 小麦TaBTLs基因启动子中顺式作用元件分析Fig.5 Analysis ofcis-elements in the promoter ofTaBTLsgene in wheat
2.6 小麦TaBTLs基因在不同组织和逆境胁迫中的表达
由图6a 可知:不同组织中,同一亚家族的大多数基因具有相似的表达谱,不同的亚家族表达水平存在差异。第Ⅲ亚家族基因(如TaBTL-31、TaBTL33、TaBTL20和TaBTL22等)主要在籽粒(grain Z71 和Z85)和叶(leaf Z71)中高表达;第Ⅱ亚家族基因(如TaBTL25和TaBTL17等)主要在根(root Z13)和穗(spike Z32 和Z39)中高表达;第Ⅲ亚族基因在根、茎、叶、穗和籽粒中广泛表达。由图6b 可知:与对照相比,在NaCl 胁迫处理下,除TaBTL2、TaBTL5、TaBTL8、TaBTL11、TaBTL122、TaBTL25、TaBTL33和TaBTL35外,其余的TaBTLs基因表达量均降低,第Ⅰ亚族表达量升高,而第Ⅱ亚族表达量降低。由图6c 可知:在PEG6000 胁迫处理下,第Ⅰ亚族TaBTLs基因(TaBTL12~TaBTL13)的表达量呈降低的趋势;第Ⅱ亚族基因表达量呈先上升后降低的趋势;除TaBTL19、TaBTL23和TaBTL32外,第Ⅲ亚族的TaBTLs基因表达量升高,且在48 h 的表达量最高。
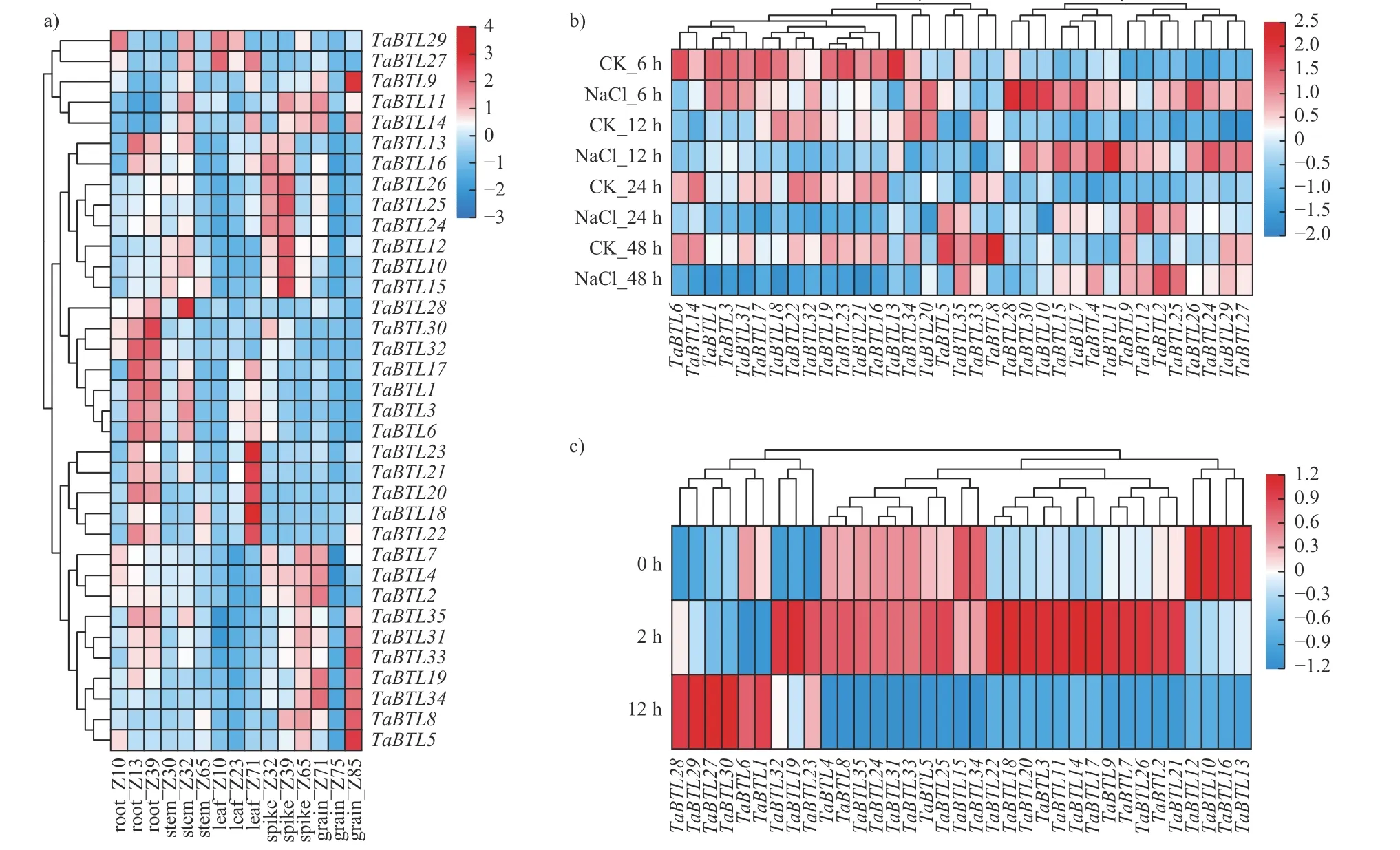
图6 小麦TaBTLs基因在不同组织和胁迫处理下的表达模式Fig.6 Expression patterns of wheatTaBTLsgene in different tissues and stresses
3 讨论
泛素/26S 蛋白酶体系统通过调节蛋白质的降解,在植物信号转导、代谢调控、细胞分化和应激反应等过程中发挥着重要作用[5-7],E3 泛素连接酶是该系统中成员最多和研究最多的组分[33-34]。RING 型E3 泛素连接酶在植物发育和胁迫调控中发挥着重要的作用[35]。目前,研究发现BTLs基因家族成员广泛存在于单子叶植物中[36]。在拟南芥中鉴定出18 个AtBTLs基因家族成员,在水稻中鉴定出17 个,在玉米(Zea mays)中鉴定出20 个,在二穗短柄草(Brachypodium distachyum)中鉴定出15 个,在高粱(Sorghum bicolor)中鉴定出16个[23,37-38]。本研究运用生物信息学方法,从小麦全基因组数据库中鉴定出35 个TaBTLs基因家族成员,分别命名为TaBTL1~TaBTL35。小麦TaBTLs基因远远多于拟南芥和水稻,分析其原因是普通小麦由乌拉尔图小麦和其近缘种山羊草首先杂交形成异源四倍体(AABB),之后又与野生粗山羊草杂交加倍后产生基因组较庞大的异源六倍体小麦(AABBDD)[39],因此小麦基因家族成员或基因簇一般均多于其他物种。
基因复制事件导致基因重组或扩增,进而导致基因家族扩张,是基因家族进化的重要机制之一[36-37,40]。本研究发现:20 对小麦TaBTL基因发生片段复制而无串联重复,表明TaBTLs基因通过片段复制的方式保留在小麦基因组中,促进了小麦TaBTLs基因家族的扩增,在小麦应对环境刺激的适应性反应中起重要作用[41-43]。为了更好地了解小麦TaBTLs基因家族的选择压力,本研究计算了TaBTLs重复基因对的Ka/Ks值,该值小于1,说明TaBTLs家族在进化过程中受到了纯化选择和功能限制[44],小麦TaBTLs基因的表达可能仍保留其祖先特征[45]。植物在进化过程中更倾向于保留较少内含子或短内含子的基因[46],小麦TaBTLs基因家族成员各亚族基因外显子和内含子数量较少,基因保留较为完整。小麦TaBTLs基因在不同组织中有不同的表达模式,说明该基因在植物生长发育过程中可能发挥重要作用,在不同发育阶段可能具有独特的功能。在拟南芥中,BTLs基因影响植物在盐胁迫下的生长和光合速率[25];而本研究中,NaCl 处理下的绝大部分小麦TaBTLs基因表达水平也降低。
启动子中顺式作用元件调控基因表达[47]。本研究中,小麦TaBTLs启动子区存在大量与植物生长发育和逆境胁迫响应的相关元件,不同基因之间含有的元件数量及类型存在差异,暗示TaBTLs基因功能上可能存在分化[48-49],如:TaBTLs含有大量与干旱胁迫响应相关的MBS/MYB/MYC元件,在PEG6000 处理下表现出不同的响应水平;在拟南芥中,部分BTLs基因积极参与ABA介导的干旱胁迫响应[27],提高脯氨酸含量,增强植物抗旱性[28],还负调控赤霉素信号通路[26];本研究中,部分小麦TaBTLs基因含有赤霉素响应元 件(如TATC-box、GARE-motif 和P-box 等),进一步暗示该基因可能与赤霉素信号相关。
4 结论
小麦中鉴定出35 个TaBTLs基因,分布在除2A、2B 和2D 染色体以外的所有染色体上,各成员之间存在大量重复事件,其启动子区域含有大量与植物生长发育和逆境响应相关的顺式作用元件。该基因家族成员在不同的组织和器官中广泛表达,并且受盐和干旱胁迫诱导。本研究结果为阐明TaBTLs基因家族的进化关系和进一步研究其家族成员的功能提供了参考依据。
