鸡白痢沙门氏菌感染对雏鸡脾脏miRNA 表达谱的影响*
2023-05-18陈远红江康峰叶玮琪杨亮宇
白 潜,陈远红,陈 曦,江康峰,叶玮琪,向 斌,杨亮宇,杨 静
(云南农业大学 动物医学院,云南 昆明 650201)
鸡白痢沙门氏菌(SalmonellaPullorum)是禽类重要的病原体,可引起鸡白痢,死亡率高,对家禽业构成严重威胁[1-2]。鸡白痢在世界许多地区(中东、非洲、亚洲和中南美洲)流行,造成巨大的经济损失[3-4]。该病多发于雏鸡,其典型症状是排白色粪便,肛周绒毛粘有粪便。目前,暂无有效疫苗预防鸡白痢沙门氏菌,常用净化手段是淘汰阳性鸡。因此,探究鸡白痢沙门氏菌感染宿主的免疫机制对防治鸡白痢尤为重要。
microRNA (miRNA) 是在动物、植物和一些病毒中发现的一类非编码小RNA (长18~25 nt),可调控基因表达水平[5],在细胞增殖、分化和免疫等生物学过程中发挥控制作用[6]。miR-146a、miR-155 和Let-7 等miRNAs 参与小鼠对沙门氏菌或脂多糖感染的免疫应答调节[7];gga-miR-125b-5p、gga-miR-34a-5p、gga-miR-1416-5p 和gga-miR-1662 可通过调节其靶基因在肠炎沙门氏菌感染中发挥重要作用[8];gga-miR-1306-5p 通过抑制Toll 相互作用蛋白调节肠炎沙门氏菌感染宿主的免疫反应,刺激炎症细胞因子的产生[9]。尽管与细菌感染相关的miRNA 研究已取得不少成果,但关于miRNA 在鸡白痢沙门氏菌感染宿主反应中的作用信息仍然有限。脾脏作为鸡体内最大的外周淋巴器官,对禽类免疫系统的功能比其他脊椎动物更重要[10]。鸡脾脏中有来自法氏囊的B 细胞、来自胸腺的T 细胞以及大量巨噬细胞,是重要的免疫器官;此外,脾脏还是鸡白痢沙门氏菌定植的靶器官。本研究采用Illumina Hiseq-2500 高通量测序技术和生物信息学分析方法,在全基因组范围内筛选鸡白痢沙门氏菌感染后SPF 雏鸡脾脏差异表达miRNA,获取与感染相关的潜在miRNA,并进一步分析其可能参与调控的通路,以期为阐明miRNA 在鸡白痢沙门氏菌感染过程的作用机制提供理论基础。
1 材料与方法
1.1 试验菌株和动物
1.2 试验方法
1.2.1 动物感染和样品采集
随机选取3 日龄SPF 雏鸡,感染组50 只,对照组30 只。以CVCC1792 半数致死量饲喂感染组,即以含3.263×108CFU 的菌液0.2 mL 饲喂感染组,对照组饲喂无菌 PBS 0.2 mL,2 组隔离饲养。攻菌24 h 后处死雏鸡,取感染组和对照组脾脏于-80 ℃保存,用于RNA 提取。
1.2.2 miRNA 文库构建及测序
感染组和对照组各选取9 只雏鸡的脾脏,每3 个脾脏混为1 个样,采用Trizol 提取RNA,并用1%琼脂糖凝胶电泳对RNA 进行质检。按Small RNA 样本制备试剂盒(TruSeq™ Small RNA Sample Preparation Small RNA Sample Prep Kits,illumina 公司生产)说明书构建6 个miRNA 文库,即3 个感染组文库(T1、T2和T3)及3 个对照组文库(C1、C2和C3)。文库质检合格后送至联川生物,利用Illumina Hiseq 2500 进行测序。
1.2.3 miRNA 的鉴定与分析
运用联川生物开发的 ACGT101-miR 软件(LC Sciences,Houston,Texas,USA)去除高通量测序原始数据中带有接头污染、无法确定以及碱基比例大于10%的序列;再进行长度筛选,保留碱基长度为18~26 nt 的序列,获得过滤后序列;将过滤后序列与各RNA 数据库序列进行比对,如mRNA 数据库、RFam 数据库(包含rRNA、tRNA、snRNA 和snoRNA 等)以及Repbase 数据库(重复序列数据库),过滤去除非miRNA 序列,获得有效序列;将有效序列映射到鸡基因组和miRBase (v22.0)鸡前体miRNA 上,获得已知miRNA。对于可以比对到鸡基因组、但比对不到鸡前体miRNA 的序列,采用mfold 软件进行二级结构预测,满足所有发夹结构所需原则,则获得新预测miRNA;最后采用Ensembl 和miRBase数据库对已知和新预测miRNA 进行序列注释。
1.2.4 差异表达miRNA 的筛选及聚类分析
作为天王表品牌挚友,赖艺现场收获了一份特别惊喜,天王表也为他准备了一份特别的礼物:征服者系列腕表。赖艺也现场佩戴并全情展示了这款征服者系列腕表,阳光帅气的赖艺即刻散发型男气质,独属于征服者的魅力在腕间流动,绅士魅力油然而生。从时尚穿搭到从容绅士文化解读,从演艺之旅到热衷公益,他侃侃而谈,让大家对赖艺有了更全面的认识,也让大家看到了一位征服者绅士的独特风采。
将鉴定到的已知miRNA 与新预测的miRNA序列进行TPM (transcript per million)表达量统计,即每百万条序列的转录本,并对其进行表达量归一化处理[11],得到norm 值。由于所测样本具有生物学重复,采用基于正态分布的方法计算P值;感染组和对照组差异表达的miRNA 分析使用t检验,并以P<0.05 为阈值。将各组差异miRNA 集用于层次聚类分析,使用pheatmap 绘制聚类热图。
1.2.5 差异表达miRNA 靶基因的预测以及GO 和KEGG 富集分析
运用TargetScan (v5.0)和miRanda (v3.3a)进行差异表达的miRNA 靶基因预测。筛选阈值为TargetScan score≥50 且miRanda Energy<-10,获得预测靶基因;使用 Gene Ontology 数据库(http://geneontology.org)和KEGG 数据库(http://geneontology.org)进行GO 功能富集分析和KEGG 信号通路分析。
1.2.6 高通量测序结果的RT-qPCR 验证
选取差异表达miRNA 进行荧光定量验证,其引物序列见表1。按照miRNA 1st Strand cDNA Synthesis Kit (by stem-loop) 试剂盒说明书反转录总RNA,按照miRNA Universal SYBR qPCR Master Mix 试剂盒说明书对反转录的cDNA 在Bio-Rad CFX96 上进行荧光定量,定量体系为20 μL,反应程序为:95 ℃ 5 min,1 个循环;95 ℃ 10 s,60 ℃ 60 s,40 个循环,使用仪器默认熔解程序采集熔解曲线。每个样品3 个重复,以5S rRNA为内参,用2-ΔΔCt法计算miRNA 的相对表达量。
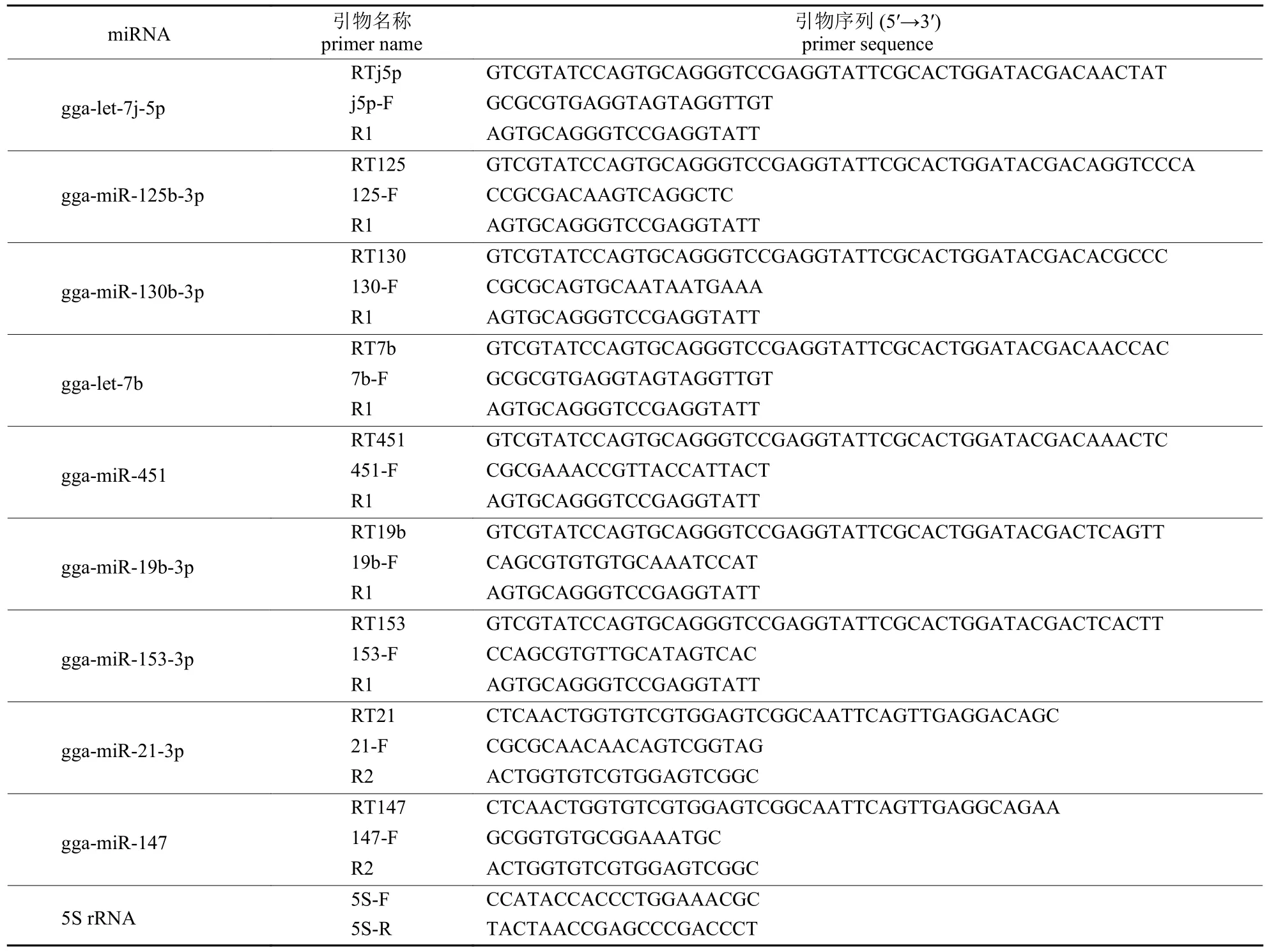
表1 miRNA RT-qPCR 引物Tab.1 Primers of miRNA RT-qPCR
1.2.7 数据统计与分析
数据统计分析采用R (v3.0.1)软件和Graph-Pad Prism 6 进行;采用SPSS 26 进行独立样本t检验,并进行显著性分析。
2 结果与分析
2.1 测序数据质控及有效数据统计
RNA 质检合格后构建感染组和对照组文库并上机测序;为保证数据的质量及可靠性,对原始数据进行质控,得到的有效数据见表2。
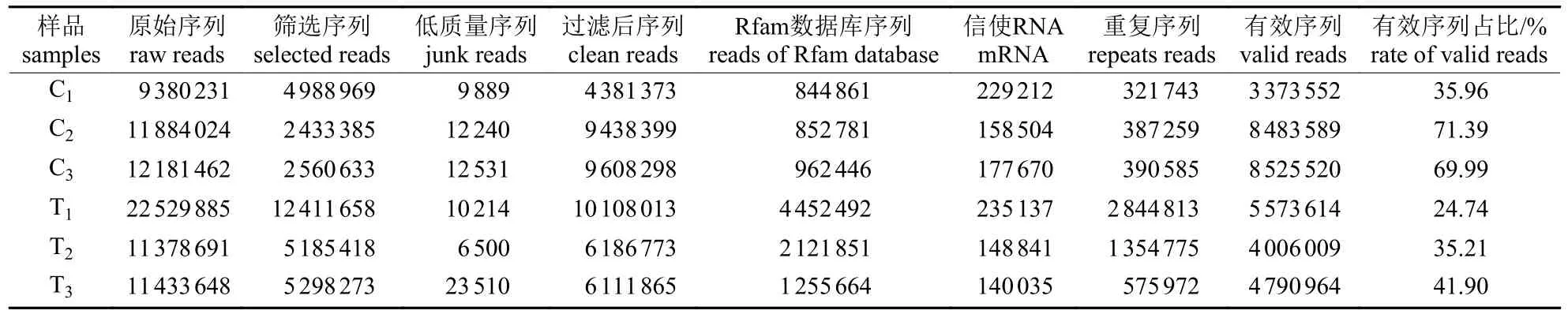
表2 有效数据统计结果Tab.2 Statistical results of valid data
2.2 miRNA 的鉴定和预测结果
鉴定获得817 个miRNAs,包括725 个已知miRNAs 和92 个新miRNAs,且miRNA 在22 nt处的数量最多(图1),与Dicer 酶切产物的长度分布基本一致,表明测序结果可靠。
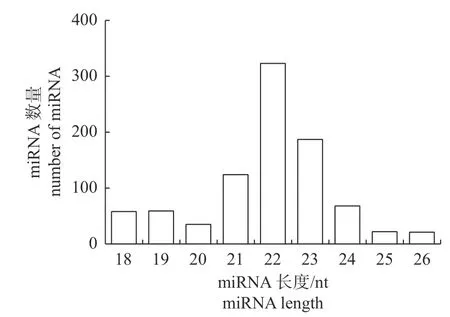
图1 miRNA 长度分布Fig.1 Length distribution of miRNA
2.3 差异表达miRNA 的筛选与聚类
感染组和对照组共筛选到29 个显著差异表达的miRNAs,其中24 个为已知miRNAs。与对照组相比,感染组中有15 个miRNAs 的表达量显著上调,14 个miRNAs 的表达量显著下调。前10 个差异显著的miRNAs 为gga-miR-1a-3p、
gga-miR-214、cgr-miR-27a-3p、gga-let-7j-5p、ggamiR-100-5p、gga-miR-125b-3p、gga-miR-130b-3p、gga-miR-451、gga-let-7d 和gga-miR-147 (图2)。
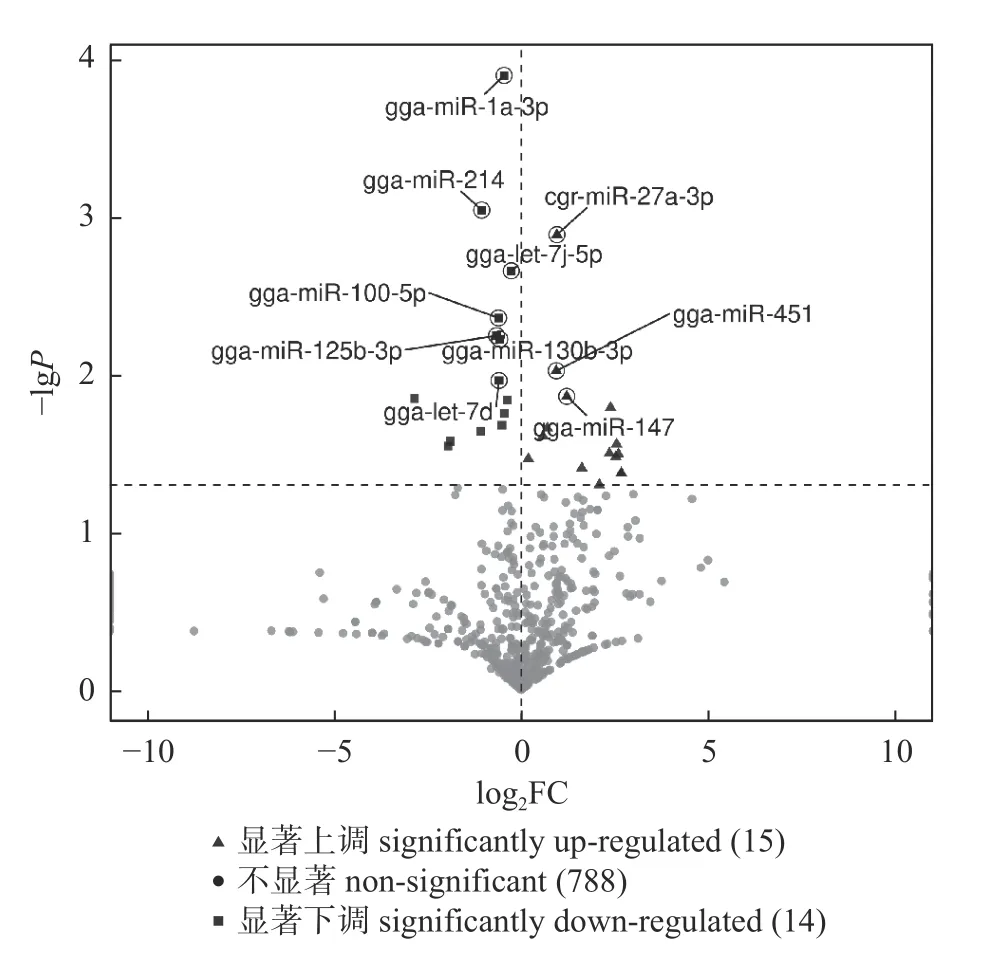
图2 差异表达miRNA 的火山图Fig.2 Volcano map of differentially expressed miRNA
由图3 可知:对照组(C 组)和感染组(T 组)的样品聚成2 簇,说明2 组的miRNA 表达谱不同。C 组中,C2和C3聚为一类,说明两者的mi-RNA 表达模式较相似;T 组中,T2和T3聚为一类,说明两者的miRNA 表达模式较相似。此外,差异表达的miRNA 被分成2 簇,第1 簇miRNA在对照组中表达较高,包括gga-let-7b、gga-miR-18b-3p 和gga-miR-100-5p 等;第2 簇在感染组中表达量较高,包括gga-miR-451、gga-miR-193-3p 和gga-miR-147 等。
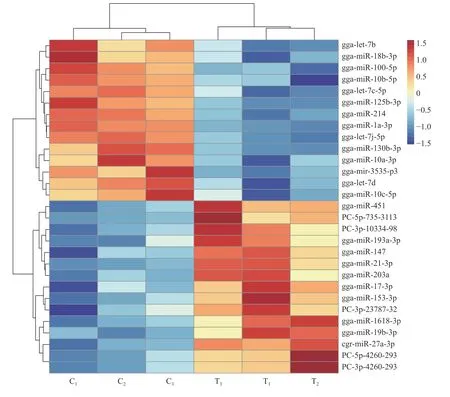
图3 差异表达miRNA 的聚类图Fig.3 Hierarchical clustering of differentially expressed miRNA
2.4 差异表达miRNA 的GO 功能富集和KEGG通路富集分析
差异表达miRNA 的靶基因共预测到10 659个miRNA-mRNA 互作靶点,其中gga-miR-214和gga-miR-21-3p 预测靶基因最多,分别为802和606 个。靶基因GO 功能富集显示(图4):T细胞共刺激、凋亡过程负调控、T 细胞活化、脂多糖介导的信号通路正调控和NIK/NF-κB 信号的负调控等免疫相关生物学过程显著富集;显著富集的细胞组分主要有胞浆、膜的组成成分和内体等;显著富集的分子功能主要有GTP 结合、GTP酶活性和跨膜转运蛋白结合等。
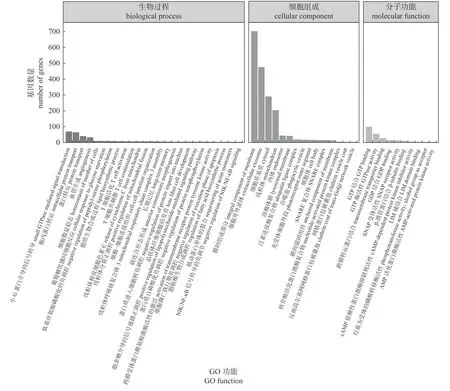
图4 差异表达miRNA 靶基因的GO 功能Fig.4 GO function of differentially expressed miRNA target genes
KEGG 富集显示(图5):显著富集的免疫相关通路有FoxO 信号通路、铁死亡、p53 信号通路、凋亡、溶酶体、内吞作用和自噬—动物等。
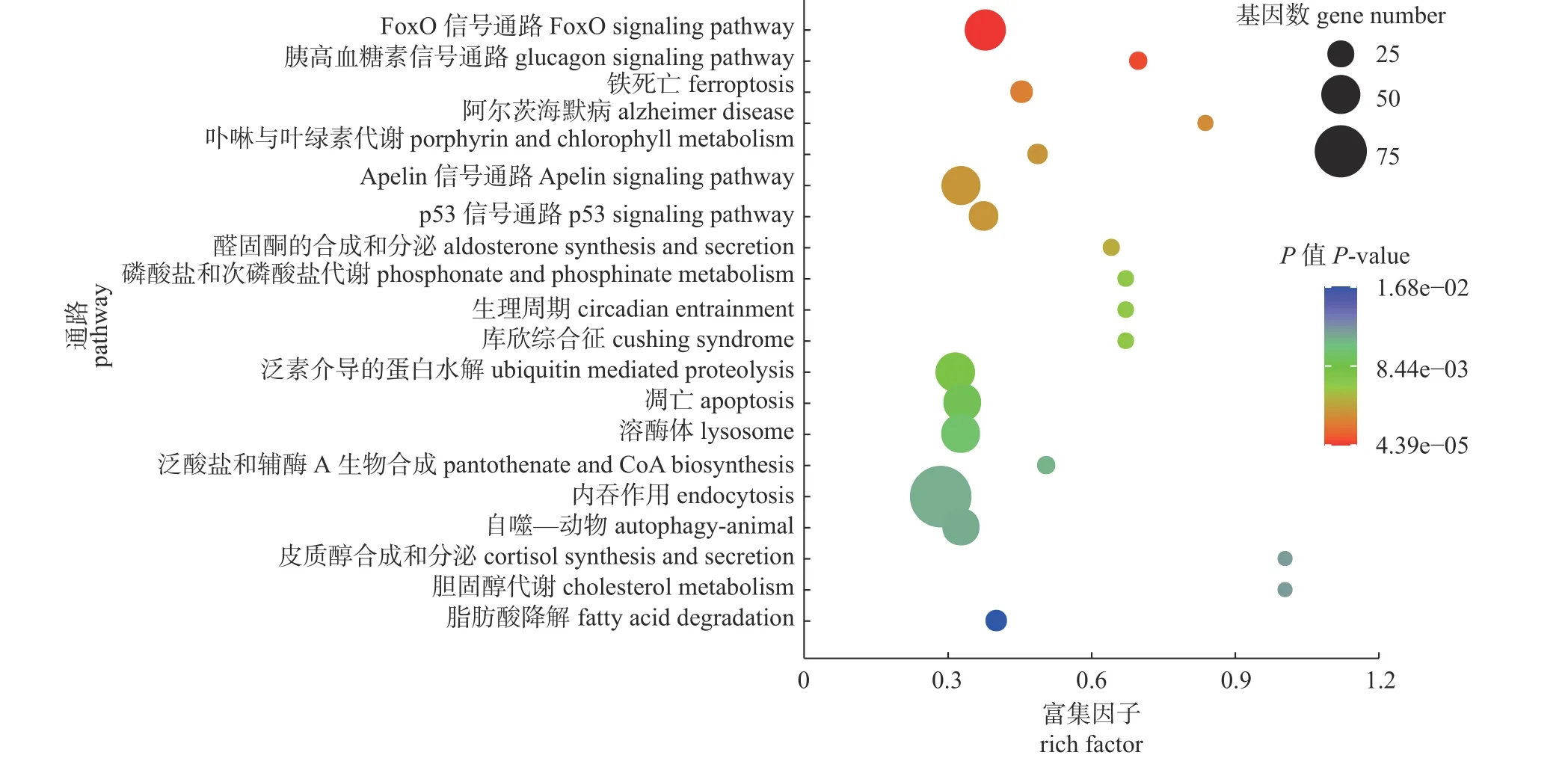
图5 差异表达靶基因的KEGG 富集通路Fig.5 KEGG pathways of differentially expressed miRNA target genes
2.5 差异表达miRNA 的RT-qPCR 验证结果
由图6 可知:gga-miR-19b-3p、gga-miR-21-3p、gga-miR-147、gga-miR-153-3p 和gga-miR-451的差异显著上调,gga-let-7b、gga-let7j-5p、ggamiR-125b-3p 和 gga-miR-130b-3p 的差异显著下调。该结果与高通量测序结果一致,且差异表达倍数相近,说明高通量测序结果可靠且准确。
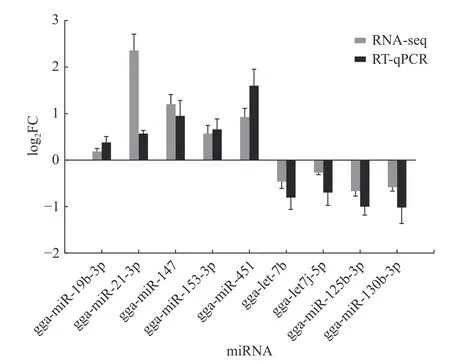
图6 差异表达miRNA 荧光定量验证Fig.6 Validation of the differentially expressed miRNA by RT-qPCR
3 讨论
本研究利用Illumina 高通量测序平台检测鸡白痢沙门氏菌感染雏鸡脾脏中miRNA 的表达谱,共获得817 个miRNAs,包括725 个已知miRNAs和92 个新miRNAs。其中29 个miRNAs 的表达存在显著差异,是鸡白痢沙门氏菌感染潜在的候选miRNA;选取9 个差异表达的miRNAs,利用RT-qPCR 技术进行验证,结果显示9 个差异表达miRNAs 表达量趋势与高通量测序结果一致,说明Illumina 测序数据具有覆盖率高、通量高和测序准确可靠等特性。
Toll 样受体具有识别病原菌和激活固有免疫的作用。TLR4 及其信号分子MyD88 和 NF-кB介导革兰氏阴性菌脂多糖的刺激传导,是连接天然免疫和获得性免疫的桥梁[12]。CHEN 等[13]研究显示:gga-miR-19b-3p 过表达促进了新城疫病毒诱导的炎性细胞因子产生并抑制该病毒复制,通过靶向RNF11 和ZMYND11 激活NF-κB 信号传导,增强炎性细胞因子产生。本研究中,感染鸡白痢沙门氏菌后脾脏中gga-miR-19b-3p 显著上调,该miRNA 是否也通过NF-κB 通路抵抗鸡白痢沙门氏菌的感染还需后续研究证实。
本研究中差异表达的gga-miR-21-3p、ggamiR-130b-3p、gga-miR-451 和 gga-miR-147 等也可参与调控 MAPK 和 NF-κB 等炎症相关通路,抵御细菌感染。在滑液囊支原体感染DF-1 细胞模型中,gga-miR-21 上调,靶向MAP3K1 激活MAPK和NF-κB 通路,促进TNF-α 和IL-6 等产生,并通过增加细胞周期和抑制细胞凋亡促进炎症细胞因子的产生和细胞增殖,以抵御支原体感染[14];在滑液囊支原体感染时,miR-130b-3p 上调,激活PI3K/AKT/NF-κB 途径,下调PTEN 促进细胞增殖[15];在脂多糖处理的小鼠中,miR-130b-3p 上调并靶向IRF1 抑制经典活化巨噬细胞极化[16];gga-miR-451 过表达并靶向YWHAZ 降低了滑液囊支原体感染诱导的炎性细胞因子(如TNF-α、IL-1β 和IL-6 等)产生[17];miR-147 已被证明与人类传染病、癌症、心血管疾病和神经退行性疾病等相关[18],在感染分枝杆菌的小鼠巨噬细胞中,miR-147-3p 表达上调,抑制了IL-6 和IL-10 产生,并显著降低了分枝杆菌的存活率[19];核苷酸结合寡聚化结构域蛋白的激活可抑制小鼠肺内皮细胞中的miR-147-3p 表达,导致TNF-α 和IL-6 等细胞因子上调,而小鼠TNF-α 和IL-6 mRNA 的3'UTR含有miR-147 的预测结合位点[20],miR-147-3p 表现为负调控炎症因子的表达。在GO 富集分析中,脂多糖介导的信号通路正调控以及NIK/NFκB 信号的负调控等生物学过程也显著富集,说明gga-miR-19b-3p、gga-miR-21-3p、gga-miR-130b-3p、gga-miR-451 和gga-miR-147可能参与调控MAPK 和NF-κB 等炎症相关通路,进而调控鸡白痢沙门氏菌的感染。
溶酶体是宿主防御系统的组成部分,含有大量酸性水解酶以抵抗细菌感染。通过与含有细菌的内体融合,溶酶体可经水解酶系统降解细菌[21]。然而,沙门氏菌已进化出逃避溶酶体降解的系统。沙门氏菌隐藏于含沙门氏菌液泡(Salmonella-containing vacuole,SCV)的特殊隔室中,从而阻止与溶酶体融合[22-23]。沙门氏菌的感染可减少宿主细胞溶酶体数量,而SCV不断分裂形成新的SCV,导致没有足够的溶酶体靶向不断形成的SCV,从而有助于沙门氏菌的胞内存活[17,24]。鸡白痢沙门氏菌的持续感染机制主要基于巨噬细胞中的存活、复制和SCV 分裂[25]。本研究中溶酶体通路在KEGG 分析中显著富集,该通路预测到靶基因最多的前3 个差异表达miRNAs 为ggamiR-214、gga-miR-21-3p 和gga-miR-19b-3p,它们可能是潜在参与调控溶酶体通路的miRNA。KEGG 分析显示:差异表达miRNA 预测靶基因显著富集于凋亡、内吞作用和自噬等重要免疫相关通路,其具体调控机制还需进一步研究证实。
4 结论
成功鉴定了鸡白痢沙门氏菌感染雏鸡脾脏miRNA 表达谱,获得29 个鸡白痢沙门氏菌感染潜在相关miRNAs,它们可能通过调控NF-κB 和溶酶体等免疫相关通路参与鸡白痢感染宿主引起的免疫反应。本研究为阐明miRNA 在鸡白痢沙门氏菌感染中的调控机制提供了理论基础。
