白介素-6化学发光检测方法的建立
2023-05-17肖锴成肖锦华谢露丹李帅鹏
肖锴成, 肖锦华, 谢露丹, 李帅鹏
(1. 无锡市妇幼保健院医学检验科,江苏 无锡 214002; 2. 江南大学附属医院医学检验科,江苏 无锡 214122; 3. 江苏拜明生物技术有限公司,江苏 盐城 224005)
1980年Weissenbach等人首次发现白介素-6(IL-6),命名为β2干扰素,直到1989年才正式统一为IL-6[1]。IL-6作为机体重要的多功能细胞因子,归属于白介素家族,在炎症反应、免疫应答和肿瘤形成等机体病理和生理活动中发挥着多种作用[2-3]。目前的临床检测中,IL-6、血清淀粉样蛋白A、C反应蛋白和降钙素原联合检测可以对感染早期进行鉴别,有助于感染性疾病的诊断、分层、治疗和预后评估,以及合理使用抗生素、防止耐药率增高和控制耐药菌过快增长[4-5];此外,检测IL-6和肿瘤坏死因子α(TNF-α)可辅助诊断肿瘤的分期,对评估恶性肿瘤预后以及疗效监测具有一定的临床价值[6-8];在席卷全球的COVID-19大流行中,患者体内IL-6水平与疾病的严重程度呈正相关,IL-6可作为药物治疗效果的有效评价指标[9-10]。
目前,国内各大医院已广泛开展IL-6的检测,其方法主要有酶联免疫法和化学发光法。化学发光法较酶联免疫法具有检测灵敏度高、线性范围宽和重复性好等优势,且配套相关仪器能够做到全自动测试。但因IL-6对检测体系的灵敏度要求高,所以医院所用大多为进口试剂盒,罗氏公司IL-6电化学发光方法学试剂盒占据了国内大部分市场。本研究以更为灵敏、可靠的化学发光法为基础,拟采用双抗体夹心法检测血清中IL-6含量,将识别IL-6抗原不同位点的两株配对抗体分别偶联生物素(Biotin)和辣根过氧化物酶(HRP),抗体对与血清中IL-6抗原形成“生物素化IL-6抗体—IL-6抗原—酶标IL-6抗体”的三明治结构,锚定在链霉亲和素包被板(SAC板)中,通过清洗除去未反应的样本和标记抗体,加入底物读取相对光单位(RLU),血清中IL-6含量与RLU呈正相关,然后由校准曲线计算其含量,从而建立具有较高灵敏度,重复性好,线性范围宽,检测时间短,可满足临床应用需求的IL-6检测方法。
1 材料和方法
1.1 主要材料
IL-6配对单克隆抗体和抗原由江苏拜明生物技术有限公司提供,配套检测仪器为BMbio-POCT10;对照试剂为罗氏公司的IL-6电化学发光检测试剂盒(批号:57032602),配套仪器为e602;临床血清样本自江南大学附属医院收集;IL-6国际标准品(英国国家生物标准与检定,NIBSC,89/548);马血清购自广州蕊特生物(批号:20220113);本研究中用到的其他材料及设备参照文献[11]。
1.2 方法
1.2.1 生物素化抗体(Biotin-AB)制备与纯化 制备标记抗体:取出-20 ℃保存的活化生物素,在室温平衡1 h,随后溶解于PBS中,终浓度为5 mg/mL;在充分溶解的生物素中加入IL-6抗体,每1 mg抗体加18.0 μL生物素溶液,室温反应1 h。纯化标记抗体:将标记后的样品放在PBS中透析,测定其浓度;标记好的抗体里添加牛血清白蛋白(终浓度20 mg/mL)和等体积的甘油,过滤除菌。
1.2.2 辣根过氧化物酶标记抗体(HRP-AB)制备与纯化 活化标记抗体和HRP:取出-20 ℃下保存的磺基琥珀酰亚胺4-(N-马来酰亚胺甲基)环己烷-1-羧酸盐(Sulfo-SMCC),在室温平衡1 h,随后溶解于二甲基亚砜中,终浓度为5 mg/mL;在充分溶解的Sulfo-SMCC中加入IL-6抗体,每1 mg IL-6抗体加18.0 μL Sulfo-SMCC溶液,混匀后室温下避光反应1 h;加入适量的10%甘氨酸终止反应。取出-20 ℃下保存的HRP,在室温条件下平衡1 h,溶解到PBS中,终浓度为10 mg/mL;加入定量的琥珀酰亚胺-S-乙酰巯基乙酸酯溶液,充分混匀,室温避光反应1 h;加入盐酸羟胺溶液,终止标记反应。制备酶标抗体:透析后的活化抗体和透析后的活化HRP温和混匀后,静置,室温避光反应2 h;每1 mg抗体加入4 μL 1%的2-巯基乙醇溶液,室温避光静置15 min;加入40 mg/mL的N-乙基马来酰亚胺溶液终止反应。纯化标记抗体:偶联了HRP的抗体加入等体积饱和硫酸铵液体,混匀后放入4 ℃静置3 h;离心30 min,弃去上清液,沉淀用PBS重新溶解;标记好的抗体里添加铁氰化钾(终浓度200 mg/mL)、牛血清白蛋白(终浓度20 mg/mL)和等体积的甘油,过滤除菌。
1.2.3 IL-6校准品配置和测定 使用马血清将IL-6抗原分别稀释成不同浓度的校准品,记为S1~S6,浓度分别为0、5、20、100、400和2 000 pg/mL,分装并于-80 ℃冻存。检测S1~S6,得到每个校准品对应的RLU,使用软件对曲线进行拟合,建立四参数Logistic Log方程。
1.2.4 Biotin-AB和HRP-AB工作浓度确定 配置不同工作浓度的抗体工作液,进行交叉实验检测不同校准品[12],以S1的RLU较低且相邻两个校准品RLU相差较大为最佳工作浓度。
1.2.5 最佳孵育时间的确定 使用优化后的Biotin-AB和HRP-AB浓度进行实验,检测校准品和不同浓度的血清样本1~4(分别为6.08、35.26、225.70和1 583.50 pg/mL),以RLU基本接近或达到最高点,且重复性较好的时间为最佳孵育时间。
1.2.6 分析性能评估
1.2.6.1 分析灵敏度 参考GB/T 26124—2011文件,分析灵敏度是测量示值的变化除以相应的被测量值变化所得的商。由于本项目的校准函数为非线性关系,且不能转化为线性关系,故选择2例浓度水平处于参考区间上限附近的样本进行分析灵敏度的测定。
1.2.6.2 线性范围 取预估检测线性上限附近的样本,采用正常人血清稀释至下限附近,共11个样本,每个样本检测2次,对结果平均值和理论浓度值进行拟合,确定线性范围。
1.2.6.3 准确度 将IL-6国际标准品配置成确定浓度的标准品溶液(1 000 pg/mL),然后按照不同的比例(2%、4%、6%、8%和10%)加入到低值样本池(2.83 pg/mL)中制备5个样品。每个样品重复测定3次,计算均值浓度,按以下公式计算回收率:
式中:R—回收率;V—加入标准液体积;V0—基础样品的体积;C—基础样品加入标准液后的测定结果(均值);C0—基础样品的测定结果;CS—标准液的浓度。
1.2.6.4 精密度 依据EP05-A3文件对试剂进行精密度的考核。准备6个不同浓度值的血清样本,每天检测2次(间隔至少2 h),每次2个重复,连续检测20 d,分别计算各样本的重复性和中间精密度。
1.2.6.5 临床样本相关性 在江南大学附属医院选取覆盖线性范围的116例临床血清样本,分别用本研究建立的方法和罗氏公司生产的IL-6试剂同时进行检测,并对样本检测结果进行相关性分析。
1.2.6.6 不同疾病患者血清IL-6水平分析 根据临床诊断主要病症分为肿瘤组(96例),其中男73例,女23例,平均年龄(54±22)岁;炎症组(46例),其中男36例,女10例,平均年龄(42±20)岁;结石组(56例),其中男42例,女14例,平均年龄(54±24)岁;烧伤组(44例),其中男26例,女18例,平均年龄(43±30)岁;33例于本院进行体检的表观正常人群作为对照组,其中男17例,女16例,平均年龄(56±17)岁。将检测结果应用SPSS 22.0软件进行统计分析,计量资料用中位数(四分位数间距)即M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Biotin-AB和HRP-AB工作浓度的确定
根据经验配置不同浓度的抗体工作液,测定6个校准品(S1~S6)的RLU,结果如表1所示。随着标记抗体浓度的增大,RLU逐渐升高,但S1的RLU同时增大,这导致阳性和阴性浓度比值(P/N)减小,低值样本区分度较差。综合考虑本底和成本问题,在同等条件下选择较低的抗体浓度,确定Biotin-AB浓度为2.00 μg/mL,HRP-AB浓度为1.75 μg/mL。
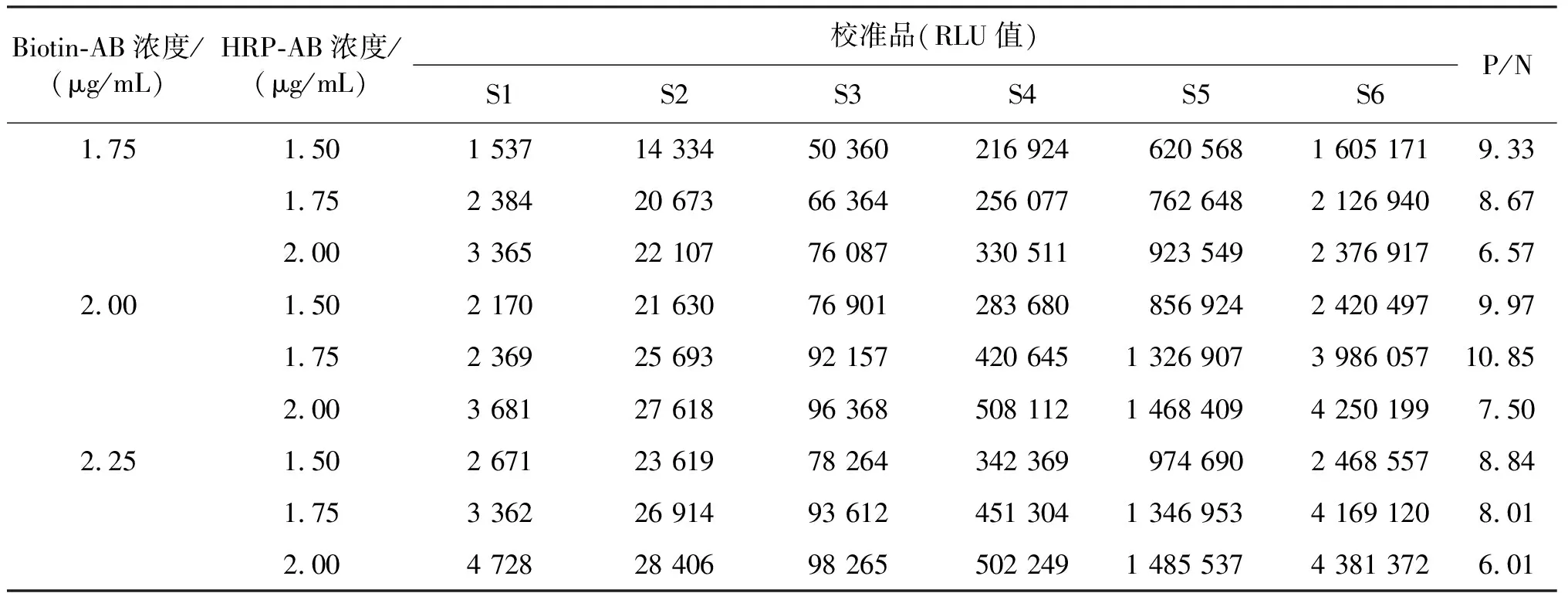
表1 Biotin-AB和HRP-AB工作浓度的确定
2.2 样品最佳孵育时间
样品孵育时间占据整个测试时间的90%左右,时间的长短会影响RLU。选择不同的孵育时间对校准品、低值和高值血清样本进行RLU检测,结果如图1所示。在孵育12.5 min后,校准品S2~S6和不同浓度血清样本的RLU基本达到最大值,同时本底RLU也较低,较短的孵育时间可以大幅缩减整个测试时间,提高检测通量。
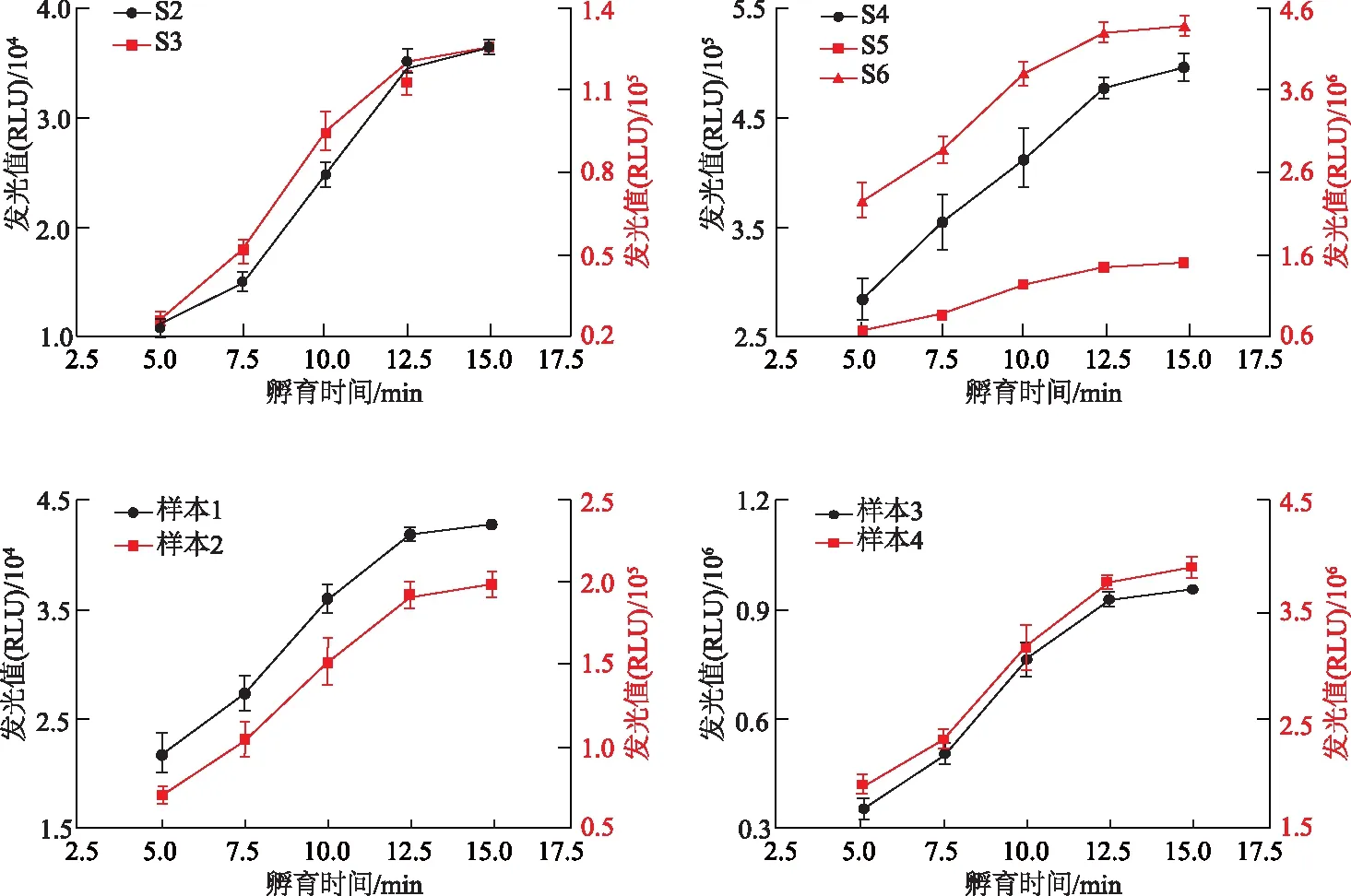
图1 不同孵育时间对校准品和血清样本RLU值的影响
2.3 试剂分析性能评估
2.3.1 分析灵敏度 对已确定浓度的2例血清样本(6.89、7.17 pg/mL)分别检测3次,计算平均值,得到分析灵敏度,结果如表2所示。经过计算得到分析灵敏度为1.89 pg/mL,所以本项目试剂的分析灵敏度定为2.00 pg/mL。
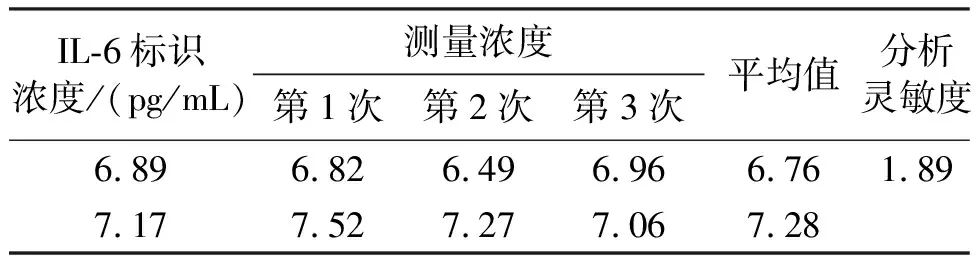
表2 分析灵敏度测试 pg/mL
2.3.2 线性范围 理论浓度与实测浓度线性回归方程的相关系数R2=0.999 1,且每个样本两种浓度结果的相对偏差均小于10%,结果如图2所示。因此本研究建立的IL-6检测方法的线性范围设定为2.5~2 000 pg/mL。
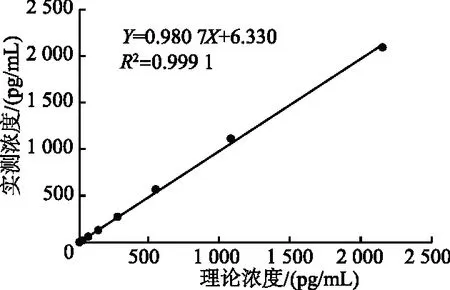
图2 线性范围检测结果
2.3.3 准确度 将标准品溶液按照不同的比例添加到低值样本池中制备成5个回收样品,重复检测3次,按照公式计算回收率,结果见表3。由表3可知,实验中的5个标本的回收率均在(100±10)%范围内,故此方法的准确度满足要求。
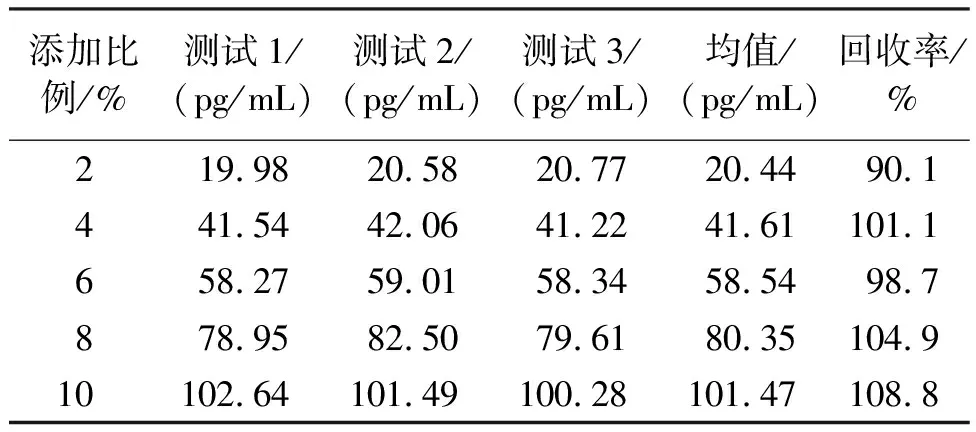
表3 准确度测试
2.3.4 精密度 对覆盖线性范围的6个样本进行精密度测试,结果如表4所示,重复性<8%,中间精密度<10%,精密度测试符合要求。
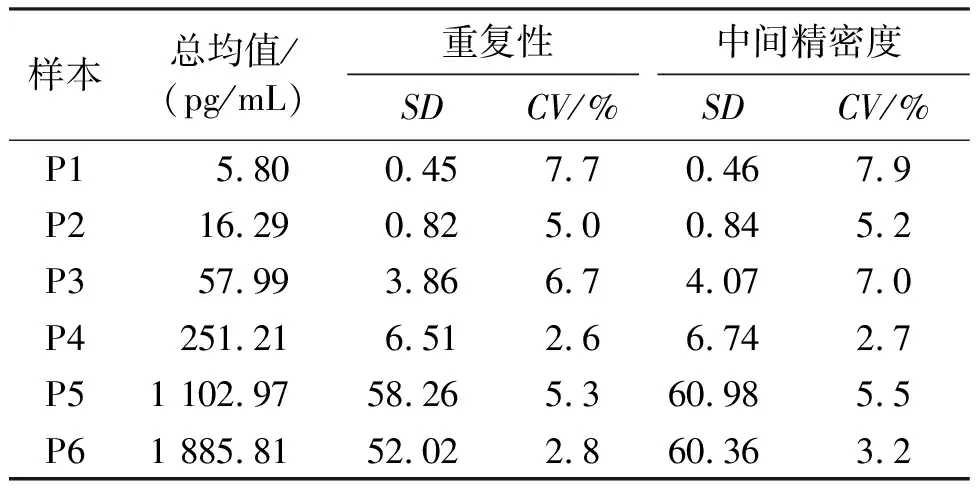
表4 重复性和中间精密度测试
2.3.5 临床样本相关性 使用本试剂与罗氏IL-6电化学发光试剂对116份血清样本分别检测,计算相关系数R2=0.987 7,同时曲线斜率为0.983 9,表明两种检测方法相关性较好(图3)。
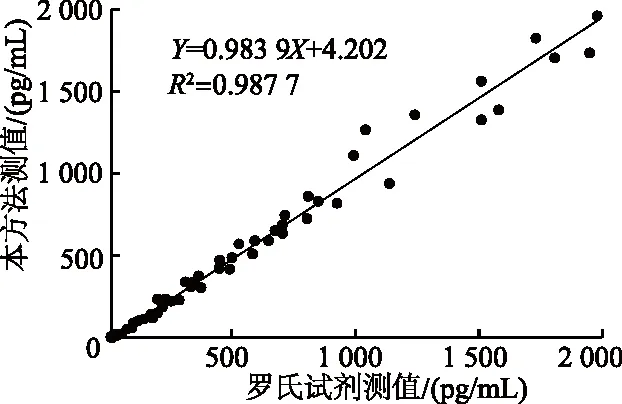
图3 本方法与罗氏试剂检测相关性
2.3.6 不同疾病患者血清IL-6水平 与对照组相比,恶性肿瘤、炎症、结石和烧伤患者血清IL-6水平明显升高,差异均有统计学意义(P<0.05),见表5。
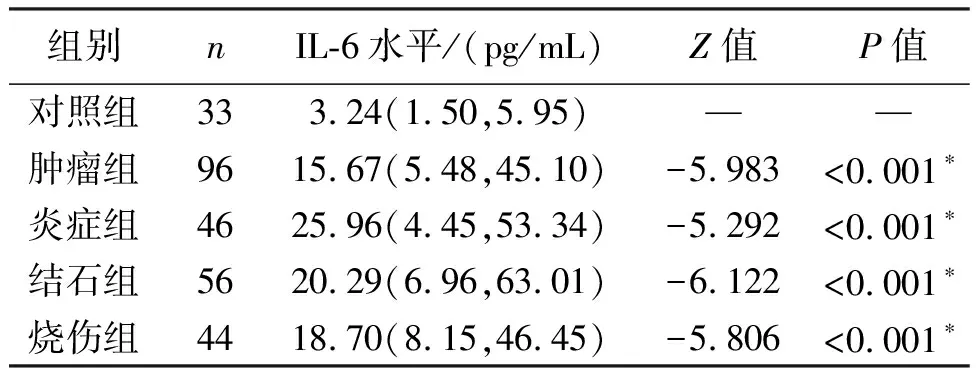
表5 各组患者血清IL-6水平比较
3 讨论
大分子蛋白质含量的临床测定方法主要为胶体金法、ELISA法和化学发光法。化学发光法以其检测灵敏度高、测值范围宽、重复性好等优点被广泛应用于各种临床标志物的检测。以罗氏IL-6电化学发光试剂为参比试剂,通过对试剂组分优化,本研究开发试剂性能接近参比试剂水平。
本研究依据棋盘法探究标记抗体的浓度,当选择生物素化抗体和酶标抗体浓度分别为2.00 μg/mL和1.75 μg/mL时,校准品S1的本底RLU值较小,且相邻校准品间RLU比值较大,说明该抗体浓度下校准品间拉开程度大,可提高样本检测的准确性,减少RLU值波动对结果的影响,同时较低的抗体浓度可减少生产成本。当孵育时间为12.5 min时,血清样本和校准品的RLU基本达到最大值,此时总检测时间为14 min,明显少于罗氏IL-6检测试剂的总检测时间18 min。本试剂的分析灵敏度为2.00 pg/mL,虽然高于参比试剂的1.50 pg/mL,但不影响对结果的阴阳性判断(截断值是7 pg/mL)。线性回归方程的相关系数R2=0.999 1,检测范围定为2.5~2 000 pg/mL,虽然不如参比试剂的检测范围宽(1.5~5 000 pg/mL),但临床上的样本IL-6浓度多数低于1 000 pg/mL,本试剂的检测范围完全能够满足要求。准确度测试中样本回收率在(100±10)%以内,重复性<8%,中间精密度<10%,以上数据表明该方法的准确度和精密度均达到临床要求,试剂质量控制较好,为后续试剂推广和样本比对提供了有力的支撑。本试剂与罗氏IL-6电化学发光试剂同时检测116例血清样本,R2=0.987 7,表明两种方法检测结果具有等同性;不同疾病患者血清IL-6水平明显高于正常对照组,符合临床实际。
综上所述,本研究建立的IL-6化学发光法可定量检测人血清中IL-6浓度,该方法具有总检测时间短、灵敏度高、精密度高和线性范围宽等优势,且试剂成本低于同类进口产品,能够满足临床检测需要。
