黏蛋白的结构与功能及其在肿瘤诊断治疗中的应用前景
2023-05-17刘梦琪周小明张维宁
刘梦琪, 周小明, 张维宁
(江苏大学医学院,江苏 镇江 212013)
癌症是导致人口死亡的主要原因之一。2020年中国新发癌症病例约457万,共导致约300万人死亡[1]。手术、化疗、放疗等传统治疗方法给癌症患者带来的益处已趋于稳定峰值,但往往伴随着不良反应,导致患者生活质量普遍下降,甚至由于不能耐受而被迫中断治疗。近年发展起来的癌症免疫治疗是通过重新启动并维持肿瘤-免疫循环,恢复机体正常的抗肿瘤免疫反应以控制肿瘤的一种治疗方法,具有针对性强、正常组织损伤小、患者易于接受等优势。近年来,针对免疫治疗的肿瘤抗原发掘得到飞速发展,确立了多种与癌症相关的肿瘤抗原,并针对某些肿瘤抗原成功开发出免疫治疗药物。例如抗PD-1受体的纳武利尤单抗、以血管生长因子受体(VEGFR)为靶点的贝伐单抗和针对细胞毒性T淋巴细胞相关蛋白4(CTLA-4)的抗体Ipilimumab[2]。其中,黏蛋白(mucins,MUC)被发现可用于肿瘤诊断的标志物或癌症治疗的潜在靶点。黏蛋白是一类高度糖基化的大分子糖蛋白,O型糖基化占该类分子质量的50%~90%。它们主要由胃肠道、呼吸道、卵巢及乳腺等器官中的上皮细胞分泌,是凝胶状分泌物的关键成分,提供润滑、细胞信号传导以及化学屏障等生物学功能。在肿瘤组织中,黏蛋白往往过量表达或其糖基化结构出现异常[3],因此,黏蛋白的异常可用于多种上皮来源恶性肿瘤的诊断,而针对黏蛋白靶点的肿瘤免疫治疗研究在近年也取得重要进展。本文就黏蛋白的结构和功能及其在肿瘤诊断治疗中的应用前景进行综述。
1 分泌型黏蛋白和膜结合型黏蛋白及其体内分布
迄今已报道的黏蛋白有20余种,根据其结构与功能可分为分泌型黏蛋白和膜结合型黏蛋白两类。分泌型黏蛋白包括MUC2、MUC5AC、MUC5B、MUC6和MUC19等类型,由呼吸道或胃肠道上皮的杯状细胞和分泌腺合成、分泌。这些分泌型黏蛋白具有富含半胱氨酸的N端和C端结构,能够介导低聚反应,在呼吸道或胃肠道上皮的表面与水结合形成一层300~700 μm厚的黏液凝胶,起润滑和保护肠道的作用[4]。膜结合型黏蛋白又称细胞表面黏蛋白,主要包括MUC1、MUC3、MUC4、MUC12、MUC13、MUC15、MUC16、MUC17、MUC20、MUC21和MUC22等类型,是单次跨膜的Ⅰ型膜蛋白。膜结合型黏蛋白N端胞外区域具有串联重复序列(TR)结构域、海胆精子蛋白-肠激酶-聚集蛋白(SEA)结构域或表皮生长因子(EGF)样结构域。TR结构域包含不同数量的重复氨基酸(丝氨酸、苏氨酸和脯氨酸)序列,这些丝氨酸、苏氨酸和脯氨酸残基是O-连接N-乙酰半乳糖胺的位点,以进一步启动N-连接糖基化链反应[5]。SEA结构域的细胞膜外侧附近存在一个高度保守的酶切割位点,跨膜黏蛋白的蛋白水解酶可将它们裂解成一个N端亚单位(包含TR结构域)和C端亚单位(包含跨膜和细胞质结构域)。EGF样结构域与一些生长因子序列同源,并能与生长因子受体等相互作用。黏蛋白在人体组织中的表达如表1所示,分泌型黏蛋白MUC5AC和MUC6多在胃中表达,MUC2、MUC5AC、MUC5B和MUC6在肝脏中表达,MUC5AC、MUC5B和MUC6在胰腺中表达。在肠道中,膜结合型黏蛋白MUC3、MUC4、MUC12、MUC13和MUC17通常成组性表达,而MUC1和MUC16在宿主受病毒感染或肿瘤时上调表达[6]。此外,MUC1和MUC3在肝脏中表达,MUC1、MUC3、MUC13和MUC20在胃中表达,MUC1、MUC3、MUC4、MUC11、MUC13和MUC20在肺中表达。
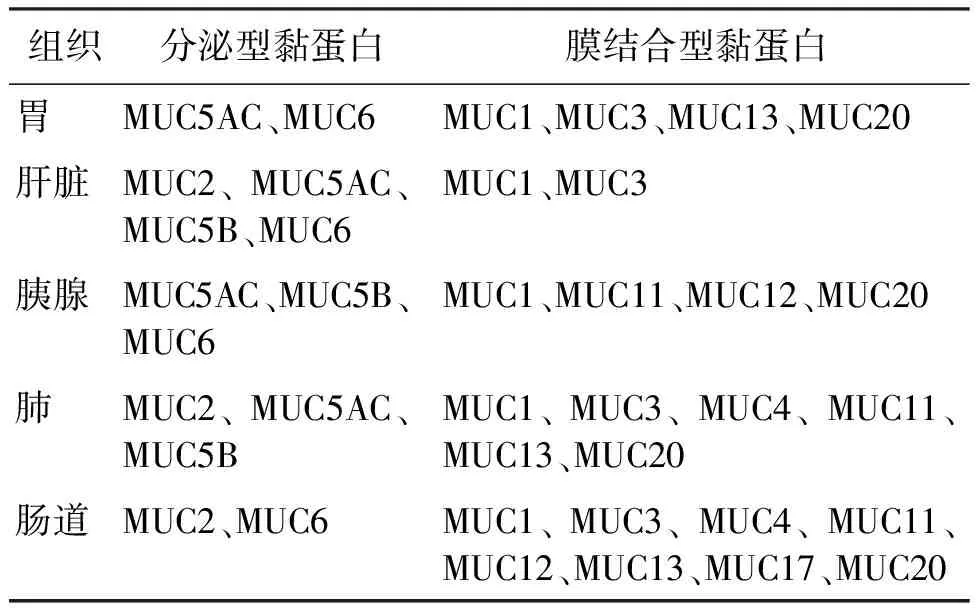
表1 黏蛋白在人体各组织中的表达
2 黏蛋白的结构
黏蛋白的分子量为0.5~20.0 MDa,正常黏蛋白具有相似的结构特征,蛋白质核心区域由两个不同结构构成。一个是包含10~80个残基形成多个串联重复序列的中心糖基化区域,主要富含丝氨酸、苏氨酸和脯氨酸,这些重复序列占氨基酸的60%以上。另一个是位于氨基和羧基末端的由氨基酸组成的球状蛋白区域,通常具有较少串联重复序列和O型糖基化及较高比例的半胱氨酸,散布于串联重复序列之间。这些富含半胱氨酸的区域具有与von Willebrand因子C和D结构域及胱氨酸C末端结构域相似的序列。研究证明该区域通过形成二硫键参与二聚体反应,并能够通过聚合二聚体形成多聚体结构[7]。此外,黏蛋白含大量N-乙酰氨基半乳糖、N-乙酰氨基葡萄糖、岩藻糖和半乳糖等碳水化合物的糖基化结构。一些寡糖链通过与丝氨酸和苏氨酸羟基侧链上的O-糖苷键排列在蛋白质核心区域周围,共同形成黏蛋白分子。
黏蛋白能够携带与肿瘤密切相关的异常O-聚糖,特别是在肿瘤恶化时,一些正常的抗原会被修饰成肿瘤特殊抗原。黏蛋白在多种肿瘤发生时表现为表达的上调、下调及糖结构的改变,O-聚糖的异常生物合成或结构的改变会导致合成的T、Tn或STn聚糖被缩短。sialy-Tn或sialy-T抗原就是常见的肿瘤恶化后由Tn或T抗原被唾液酸化修饰而形成的,70%以上的结肠癌都能发现Tn抗原的存在。特别是在肿瘤发生恶性转化、转移及预后不良反应时,T、Tn、STn聚糖和sLea、sLex等肿瘤细胞表位的表达就会异常增加[8]。因此,这些肿瘤特异聚糖的出现可被视为肿瘤标志物应用于肿瘤的临床诊断。
3 黏蛋白的生物学功能
3.1 调节组织黏膜屏障
机体完整的黏膜屏障功能是体内微生物与宿主共生、抵御内毒素和病菌侵染组织的保障。当肠黏膜的免疫屏障功能异常时,肠腔内抗原物质就会激活免疫细胞,产生大量炎症因子和细胞介质,黏蛋白此时能够辅助肠黏膜进行免疫系统调节。黏蛋白MUC2在肠道中表达,通过其网状结构和糖基侧链黏附或包裹致病菌及内毒素等有害物质,并将它们隔离于肠上皮细胞之外,抵御有害物质的侵袭[7]。MUC2中大量的O型寡聚糖链骨架结构能够提供与分泌型免疫球蛋白A及抗菌肽结合的免疫位点,重塑肠道屏障的免疫功能。在结肠外的黏液层中,黏蛋白是微生物菌群的生态结合位点,不仅能促进益生菌黏附并定植于肠腔,而且为益生菌提供生长所需的营养代谢物质,从而抑制有害菌的繁殖[9]。除了肠道以外,黏蛋白在胃、肝脏、肺和正常气道中均有表达,MUC5AC是气道防御的重要组成部分,但分泌过多会导致气道阻塞,甚至由于气道黏液过多引发致死性哮喘[10]。黏蛋白MUC19是位于眼表的黏蛋白,是构成泪膜中黏蛋白层的主要成分,具有亲水性,可以锁住水液层并稳定泪膜中的脂质成分。眼表中MUC19表达下调会导致干眼症,增加眼表MUC19的合成和表达是恢复泪腺功能及治疗干眼症的重要前提[11]。
3.2 参与细胞信号传导
MUC1(120~500 kDa)的多肽骨架由胞外段、跨膜段和胞内段3部分组成,因此可作为膜表面受体参与信号传导(图1)。MUC1中的串联重复域由20个氨基酸(PAPGSTAPPAHGVTSAPDTR)的重复序列组成,并包含110个氨基酸长度的SEA、短跨膜区和74个氨基酸的胞内区。其胞内结构域中的蛋白质结合基序可与糖原合成酶激酶3β、β-连环蛋白、生长因子受体结合蛋白2等相互作用[12]。此外,MUC1或MUC1/Y可能通过影响Sos蛋白参与调节Ras信号通路。MUC1胞内段的基因YTNP中的Tyr(Y)被磷酸化后可通过pYTNP与Grb-2上的SH2结构域结合,形成DF3/Grb-2复合物并通过Grb-2的SH3结构域与Sos蛋白结合,形成DF3/Grb-2/Sos复合物。同时,MUC1在胞外蛋白酶的降解下能够释放MUC1-N,从而改变MUC1-C的构象和配体状态,随后激活下游细胞传导信号,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)和Wnt信号通路[13]。MUC1的胞内尾区还可以协同转录活化因子3、核转录因子κB、p53和β-连环蛋白,促进靶基因的表达,调控细胞增殖、生存和凋亡[14]。
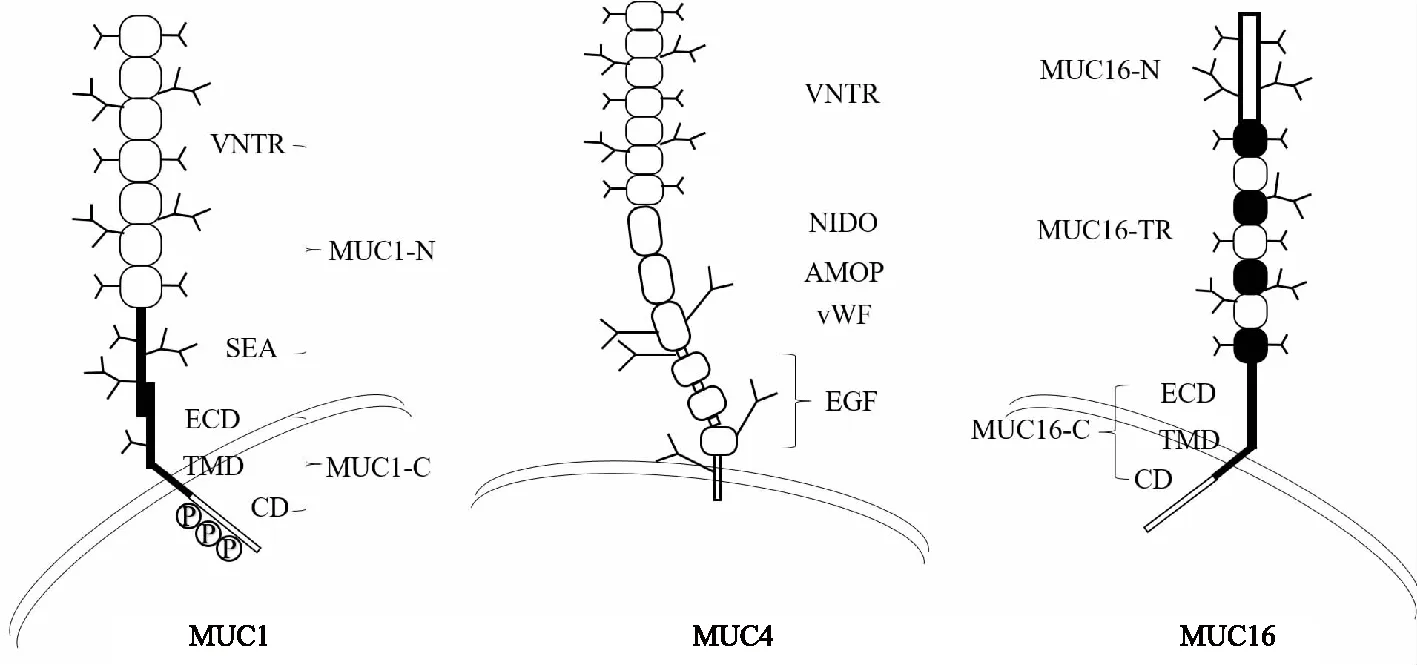
VNTR:数目可变串联重复序列;SEA:海胆精子蛋白-肠激酶-聚集蛋白结构域;ECD:细胞外结构域;TMD:跨膜结构域;CD:白细胞分化抗原;NIDO:巢蛋白样结构域;AMOP:黏附相关结构域;vWF:血管性血友病因子;EGF:表皮生长因子
3.3 介导机体免疫
黏蛋白能与人体内可识别其空间结构表位的抗体形成免疫复合物,与B细胞的FcR结合,产生体液免疫应答并抑制细胞免疫应答的产生。此外,多年研究发现,黏蛋白及其聚糖通过与免疫细胞的凝集素结合发挥免疫效应。因此,由聚糖排列形成的黏蛋白结构域表面,对于与受体的结合能力就显得很重要。单聚糖-蛋白质相互作用通常亲和力较低,但蛋白质与聚糖表面的结合可能很快达到高亲和力,黏蛋白及其聚糖能够促使选择蛋白招募免疫细胞至炎症部位。Beatson等[15]发现唾液酸化的MUC1能与Siglec-9+髓样细胞结合,引起慢性炎症,并且唾液酸化的MUC1能够在COX-2的作用下持续表达。此外,唾液酸化的MUC1诱导巨噬细胞呈现肿瘤相关巨噬细胞样的表型,并增加配体PD-L1的表达。已有研究表明PD-L1表达下调和γ干扰素表达上调与MUC1-C被抑制密切相关。MUC-1的高表达还有利于肿瘤细胞抵御细胞损伤,尤其是凋亡相关因子自杀配体,肿瘤坏死因子相关性凋亡诱导配体以及T细胞分泌的颗粒酶和穿孔素引起的细胞损伤。髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)在促进疾病生长和免疫耐受中至关重要,当MDSCs发生抑制自体T细胞反应时,T细胞增殖减少并且Th1向Th2表型转变[16-17]。Pyzer等[18]发现MUC1是肿瘤来源的胞外囊泡介导MDSC扩张的关键驱动因子,MUC1通过对细胞周期蛋白的下游作用,诱导MDSC的增殖,使细胞外囊泡中的c-myc基因表达增加。然而,黏蛋白是否具有直接的免疫作用仍需进一步的研究与验证。
4 黏蛋白在肿瘤诊断和治疗中的应用
4.1 癌症诊断与预后评估
黏蛋白的差异表达与潜在肿瘤的形成具有一定的相关性,黏蛋白作为恶性肿瘤的标志物已被广泛用于多种肿瘤的临床诊断和预后评估。MUC1在肺癌中高表达并且其结构和生化特性发生改变,参与肿瘤的发生、增殖和转移,可作为识别和监测肺癌的生物标志物[12]。研究发现,MUC1介导产生结缔组织生长因子、血小板衍生生长因子,参与STAT3、PI3K及NF-κB通路,并通过β-catenin/TCF4通路激活MYC癌基因,从而增强肿瘤细胞的增殖能力,促进肿瘤的发展[14]。MUC1在肺鳞癌和肺腺癌患者血及癌组织中表达水平升高,血MUC1对肺鳞癌和肺腺癌的诊断敏感度为52.94%和61.54%,特异度为100%和95%[19]。非小细胞肺癌患者的外周血MUC1mRNA水平显著升高,其对非小细胞肺癌的诊断灵敏度为68.8%,特异度为94.4%,联合cyfra21-1可将灵敏度提高至87.5%[20]。此外,MUC1的表达对评价上皮源性肿瘤的预后具有指导意义,MUC1过表达显著影响手术和非手术治疗的肺癌患者的总生存期和无进展生存期,高表达的MUC1提示潜在的预后不良[21]。
MUC4(550~930 kDa)可以以膜结合型和分泌型两种形式存在,GDPH位点的蛋白水解将MUC4分解成MUC4α和MUC4β两个亚基。MUC4α由一个寡糖侧链修饰的富含丝氨酸、苏氨酸和脯氨酸残基的VNTR区域组成,VNTR区域下游存在黏着相关结构域和类巢蛋白结构域两个部分。MUC4β包含1个血管性血友病因子结构域、3个类表皮生长因子样结构域、1个跨膜蛋白和1段22个氨基酸构成的胞内片段。其中,NIDO、AMOP和vWF是MUC4特有的结构域。MUC4在正常胰腺中检测不到,但在胰腺癌的癌前病变中可检测到,其表达水平与胰腺癌发展程度呈正相关。此外,MUC4可以与表达E-选择素和P-选择素的内皮细胞相互作用,还可与循环中的半乳糖苷-3结合,增强MUC4与内皮细胞的相互作用,导致内皮细胞之间的黏附和肿瘤的转移[22-23]。Urey等[24]发现,90%以上的胰腺癌组织样本呈MUC4阳性表达,且相较于组织样本中高表达MUC4的肿瘤患者而言,低表达MUC4的肿瘤患者的长期生存率更高。在胰腺癌患者接受吉西他滨治疗后发现,MUC4的低表达与患者的良好预后高度相关,表明MUC4的表达水平可辅助判断肿瘤治疗后的预后情况。
膜结合型黏蛋白MUC16是卵巢癌中过度表达的一种肿瘤特异性抗原,目前是临床上诊断卵巢癌应用最为广泛的重要血清生物标志物[25]。MUC16(1.5~5.0 MDa)常表达于眼表、呼吸道和子宫内膜组织(特别是在腺体和上皮细胞中,以及宫颈黏液),含约14 000个氨基酸,包含N端结构域(MUC16-N)、串联重复结构域(MUC16-TR)和C端结构域(MUC16-C)三个主要结构域。其N-末端结构域在一个长约12 000个氨基酸的区域内,包含多个富含丝氨酸的区域,该区域仅为O-糖基化。TR结构域包含156个氨基酸的12~60个重复序列,具有散布的SEA结构域,其中包含O-连接和N-连接的糖基化位点。MUC16的C端结构域包括一个胞外结构域、短跨膜区和一个32个氨基酸的胞内结构域。研究发现,80%以上卵巢癌患者其MUC16由于胞内近膜侧被磷酸化,胞外部分会从细胞表面脱落释放入血或胞外基质,造成MUC16表达水平较高[26]。动物实验研究表明,N端敲除后的MUC16转载入卵巢癌细胞会刺激癌细胞黏附依赖的克隆形成,增强黏附依赖的生长时间和卵巢癌细胞侵袭和转移的能力,导致裸鼠皮下成瘤及瘤体生长[27]。利用MUC16的动态变化监测疗效已用于临床,卵巢癌患者血清中MUC16水平是化疗方案的有效依据,可作为患者前3次化疗结束后的评价指标[28]。
4.2 基于黏蛋白的癌症靶向治疗
肿瘤免疫逃逸指肿瘤细胞逃避机体免疫系统识别和攻击,从而在机体内生存和增殖。免疫治疗能够恢复身体的免疫系统对抗肿瘤细胞,以促进对肿瘤细胞的抑制。基于黏蛋白的癌症靶向治疗研究进展如表2所示。低糖基化MUC1可暴露肿瘤抗原表位,下调MUC1可抑制肿瘤细胞增殖和转移并促进癌细胞凋亡[29]。TG4010疫苗是一种重组修饰牛痘病毒悬浊液,可编码MUC1肿瘤相关抗原和IL-2,从而诱导或放大针对肿瘤的细胞免疫应答。在Quoix等[30]进行的一项随机、双盲、安慰剂对照的临床试验中,222例患者分别接受了TG4010疫苗、安慰剂及化疗干预,结果表明,TG4010组和安慰剂组的中位无进展生存期分别为5.9个月和5.1个月。L-BLP25脂质体疫苗是MUC1抗原特异性的长肽脂质体疫苗,临床前及Ⅰ期研究表明其能够激活MUC1抗原特异性T细胞并抑制MUC1转基因小鼠肺部肿瘤的生长,明显延长了对疫苗产生免疫应答的肺癌患者的生存期。全球多中心Ⅲ期临床试验纳入了1 513例稳定或者临床缓解的Ⅲ期非小细胞肺癌患者,L-BLP25与安慰剂组的中位总生存期为25.6个月和22.3个月。亚组分析显示在既往接受同步放化疗的患者中,L-BLP25较安慰剂组的中位生存期延长了10.2个月(P=0.016),表明L-BLP25可作为维持治疗肺癌的策略[31]。树突细胞是一种具有分支或树突状形态及吞噬功能,能够递呈抗原的细胞。树突细胞疫苗是利用树突细胞的抗原递呈能力,将癌细胞的抗原特征递呈给T细胞,活化T细胞对癌细胞发起攻击。在一项研究中,Liu等[32]发现利用开发的纳米颗粒递送系统使荷瘤小鼠接受MUC1抗原肽冲击树突细胞的疗法后,与对照组相比,小鼠特异性T细胞的免疫应答得到增强,抑制了肿瘤的生长。此外,Ota等[33]发现晚期或复发胰腺癌患者在接受MUC1抗原肽冲击树突细胞治疗后可诱导细胞免疫反应,并有助于逆转细胞的免疫抑制作用。Scheid等[34]纳入16名非转移性去势抵抗性前列腺癌患者接受Tn-MUC1糖肽树突细胞疫苗治疗,有11名患者的前列腺特异性抗原的倍增时间显著改善(P=0.037)。免疫反应分析发现,在7名接受评估的患者中,有5名患者出现了显著的Tn-MUC1特异性CD4+和(或)CD8+T细胞内细胞因子反应,表明MUC1能够诱导显著的T细胞反应,且具有生物活性。
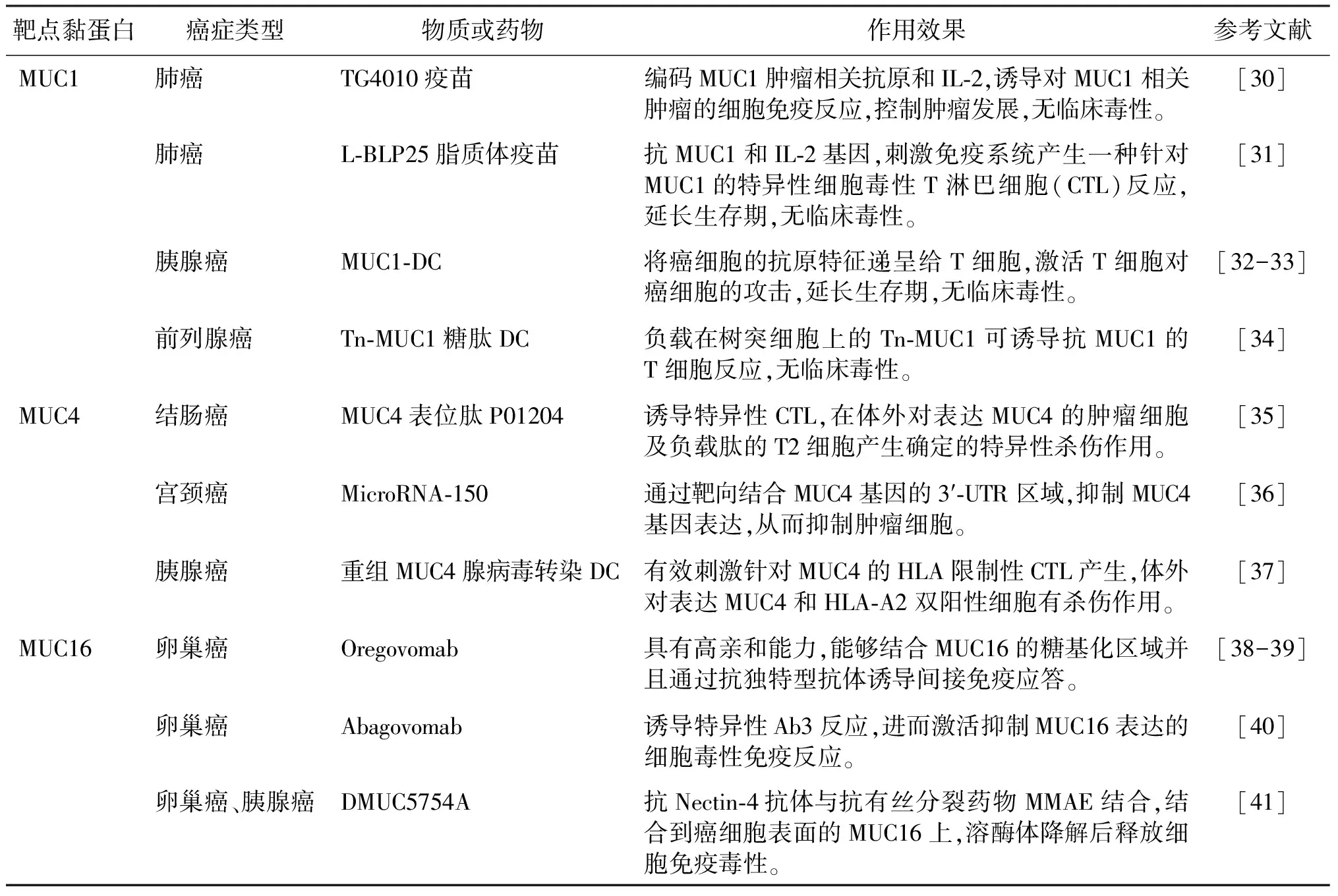
表2 黏蛋白作为靶点的癌症治疗进展
研究发现MUC4蛋白具有抑制细胞与基质连接,帮助肿瘤细胞逃避免疫细胞攻击,促进肿瘤细胞生长和转移,抑制细胞凋亡等生物学功能,在肿瘤的发生发展过程中起着重要作用[35-37]。目前可以利用生物信息学技术预测并鉴定肿瘤抗原特异性的细胞毒性T淋巴细胞(CTL)表位,T细胞表位预测旨在鉴定抗原内能够刺激CD4+或CD8+T细胞的最短肽,并且在产生抗原合成肽的试验中被证实。Wu等[35]利用数据库预测并筛选出P01202(1125LLLGVGTFV1133)、P01203(498WLLEPHDAI506)、P01204(1126LLGVGTFVV1134)、P01205(1119GALGGLLLL1124)和P01206(944GTLDMRAFL952)共5个表位肽,其中P01204表位肽诱导的CTL对人体结肠癌细胞HCT-116具有特异性杀伤作用。玛依努尔等[36]通过生物信息学分析预测MUC4为miR-150的潜在靶点,MUC4 3′-UTR是miR-150的假定结合位点。miR-150过表达与细胞自噬相关,MUC4表达随着miR-150过表达显著降低,SiHa细胞增殖、迁移侵袭能力显著降低且细胞凋亡增加。
FDA目前已批准将MUC16作为诊断依据,MUC16目前是临床上应用最为广泛的卵巢癌诊断标志物。Oregovomab是首个针对MUC16的临床试验单克隆抗体药物,已用于原发性卵巢癌患者的用药。Oregovomab具有高亲和能力,能够结合MUC16的糖基化区域并且通过抗独特型抗体诱导间接免疫应答。在一个纳入97例Ⅲ/Ⅳ期卵巢癌患者的治疗中,Oregovomab联合应用卡铂与紫杉醇治疗组患者的无进展生存期为41.8个月,单独紫杉醇治疗患者的无进展生存期为12.2个月(P=0.003,HR=0.46,95%CI:0.28~0.70)[38]。在紫杉醇与Oregovomab联合给药后,外周血中MUC16-IFN-γ+CD8+T淋巴细胞数量增加,Oregovomab单抗的免疫应答被激活[39]。Abagovomab是一种针对肿瘤相关抗原CA125的鼠源性单克隆抗体,能刺激宿主产生细胞毒性免疫反应抑制肿瘤细胞。在多中心临床Ⅲ期研究中,Sabbatini等[40]纳入了888名卵巢癌患者进行Abagovomab的双盲、安慰剂对照试验,80.9%的患者在第3个治疗周期后,癌抗原CA125≤35 U/mL,治疗组无复发生存风险比为1.099(95%CI:0.919~1.315,P=0.301)[39]。DMUC5754A是一种抗体-药物偶联物,由一种人源性抗Nectin-4抗体与抗有丝分裂药物一甲基澳瑞他汀E(MMAE)结合,结合到癌细胞表面的MUC16上,然后通过网格蛋白介导的内吞作用使偶联物-抗原复合物被内化,降解溶酶体后释放细胞毒性。由于具有毒性,其本身不能作为药物使用,通常与一种单克隆抗体(mAb)相连,mAb将其导向癌细胞,MMAE破坏微管,诱导肿瘤细胞凋亡。DMUC5754A还可能通过信号转导抑制、抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)发挥抗肿瘤作用[41]。
5 展望
随着对黏蛋白研究的深入,黏蛋白分子结构、功能差异以及正常组织和肿瘤组织中的表达差异逐渐被了解,针对黏蛋白的开发主要是以黏蛋白为靶点的肿瘤免疫治疗。黏蛋白的应用多为肿瘤的监测及预后诊断,对黏蛋白作为靶点的药物开发仍然处在早期。目前黏蛋白相关疫苗正处于临床试验阶段,其有望在未来肿瘤的综合治疗中进一步发挥其优势。为了开发更有效的基于黏蛋白的肿瘤治疗策略,需要更好地理解黏蛋白异常糖基化、剪接变体、致癌信号级联和互作结合蛋白的内在机制。
