脑脊液分析对动脉瘤性蛛网膜下腔出血介入术后亚急性脑积水的预测价值
2023-05-17李云飞程琼汪银洲刘君鹏郑峥魏文
李云飞, 程琼, 汪银洲, 刘君鹏, 郑峥, 魏文
(1. 福建医科大学省立临床医学院,福建 福州 350001; 2. 福建省立医院神经内科,福建 福州 350001; 3. 赣州市立医院康复医学科,江西 赣州 341000)
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)作为神经科的重症之一,死亡率达27%~44%[1]。尽管介入手术有了飞跃发展,病死率明显下降,但功能结局仍不理想。脑积水是aSAH患者常见的并发症,发生率为15.0%~58.4%[2]。但是,脑积水造成的头痛、呕吐症状往往被蛛网膜下腔出血本身造成的刺激性及颅高压性头痛所掩盖,部分患者急性期发生脑疝,严重时危及生命,部分易进展为慢性脑积水,造成认知功能下降、步态不稳及大小便失禁,需再行脑室造口术及脑室腹腔引流术。目前关于aSAH亚急性脑积水的预测因素研究不多,且结果相互矛盾,如Di Russo等[3]认为脑积水与动脉瘤修复方式有关,而Rahmanian等[4]则认为与动脉瘤位置有关而与修复方式无关。由于急诊动脉瘤介入栓塞术的广泛开展,aSAH患者术后早期行腰椎穿刺术使得脑脊液生物学指标测定成为可能。因此,本研究对2017年1月至2021年8月福建省立医院神经内科收治的147例aSAH患者进行回顾性研究,分析脑脊液中相关定量指标对继发脑积水发生的预测价值。
1 资料与方法
1.1 一般资料
选择2017年1月至2021年8月在福建省立医院神经内科住院并行血管内介入栓塞术的aSAH患者共200例。纳入标准:首次诊断为aSAH的所有年龄段患者;诊断符合《中国动脉瘤性蛛网膜下腔出血诊疗指导规范》标准[5];经数字减影血管造影术确认动脉瘤位置,并行血管内介入栓塞治疗;所有患者术后3 d内行腰椎穿刺脑脊液置换术,并送检脑脊液,行脑脊液常规、生化、细胞学、IL-6检测。排除标准:非动脉瘤性破裂导致蛛网膜下腔出血;既往存在脑部疾病,如脑梗死、脑积水、脑外伤、脑部手术等;继发颅内感染或家属不同意腰椎穿刺术。本研究经医院伦理委员会审核通过(审批号K2020-01-025)。
最终纳入aSAH患者147例,年龄15~87岁,平均(55.68±12.49)岁;男60例,女87例。经急诊CT血管成像(CTA)或数字减影血管成像(DSA)诊断为颅内动脉瘤,其中,颈内动脉及前交通动脉瘤111例,大脑前动脉瘤8例,大脑中动脉动脉瘤11例,后循环动脉瘤17例;单发动脉瘤110例,多发颅内动脉瘤37例。
按照发病30 d内CT检查结果,将147例aSAH患者分为亚急性脑积水组(n=50)与无脑积水组(n=97)。
1.2 治疗方法
所有患者入院后急诊行血管内造影及动脉瘤血管内介入栓塞术。对瘤颈宽的动脉瘤实行支架辅助介入栓塞术,术中加用替罗非班抗血小板聚集24 h,术后口服波立维(赛诺菲制药有限公司)和拜阿司匹林(北京拜耳医药保健有限公司)双联抗血小板聚集,与替罗非班(武汉远大制药集团有限公司)重叠4~6 h。术后经颅多普勒超声(transcranial Doppler,TCD)检测脑血管痉挛情况。147例患者均于术后3 d内行多次脑脊液置换治疗。根据脑水肿情况常规予脱水降颅压,尼莫地平(北京拜耳医药保健有限公司)预防脑血管痉挛。
所有患者治疗好转后出院,平均住院20 d,术后30 d行颅脑CT平扫,门诊随访1年。
1.3 观察指标
1.3.1 分析临床资料及影像学资料 临床资料包括性别、年龄、高血压、糖尿病、血脂、Hunt-Hess分级、改良Fisher分级、手术方式、脑脊液指标(术后3 d内首次脑脊液压力、白细胞计数、红细胞计数及蛋白定量,并采用高通量蛋白芯片检测脑脊液中IL-6)、术后并发症(脑血管痉挛、合并迟发性脑梗死)以及术后是否扩容治疗;影像学指标包括是否合并脑室出血、术前脑积水、颅内动脉瘤相关指标(动脉瘤位置及直径)。
1.3.2 脑血管痉挛评估 采用TCD进行评估。脑血管痉挛定义为蛛网膜下腔出血后血流速度增加50%或大脑中动脉血流速度达120 cm/s[6]。迟发性脑梗死定义为aSAH患者在一段明显的稳定或改善期后,由于组织灌注恶化造成相应感觉、运动或认知功能的恶化;认定的标准:在动脉瘤闭塞术后一段时间后(非即刻)发生的局灶性神经功能障碍(例如偏瘫、失语、失用症、偏盲)或格拉斯哥昏迷评分降低≥2分,且上述症状持续≥1 h,并通过临床评估、脑部CT或MRI扫描以及适当的实验室检查排除全身情况及再出血、脑积水等其他原因[7]。
出血后脑积水按照发生时间不同,分为急性期(72 h内)、亚急性期(3~30 d)、慢性期(>30 d),诊断根据公认的临床和放射学标准[8],即出现临床症状(精神状态下降,轴向僵硬和失禁)合并脑室扩大的影像学证据。
1.4 统计学方法

2 结果
2.1 临床指标及比较
147例aSAH并行血管内介入栓塞治疗患者均未继发颅内感染,30 d内发生脑积水50例(34.0%),其中41例经多次腰穿及持续硬膜外引流好转,9例发展为分流依赖性脑积水行侧脑室钻孔引流。
两组患者年龄、Hunt-Hess分级、改良Fisher分级、术前脑积水、合并脑室出血及脑脊液红细胞计数、IL-6水平比较,差异均有统计学意义(P<0.01或P<0.05),其余指标差异均无统计学意义(P均>0.05)。见表1。
2.2 多因素Logistic回归模型分析急性脑积水的影响因素
将单因素变量分析中P<0.05的因素纳入多因素Logistic回归分析,结果显示,影像学特征性改变(合并脑室出血、术前脑积水)以及脑脊液中红细胞计数、IL-6水平是aSAH患者30 d内并发脑积水的独立危险因素(P<0.05)。见表2。

表1 两组患者临床指标比较
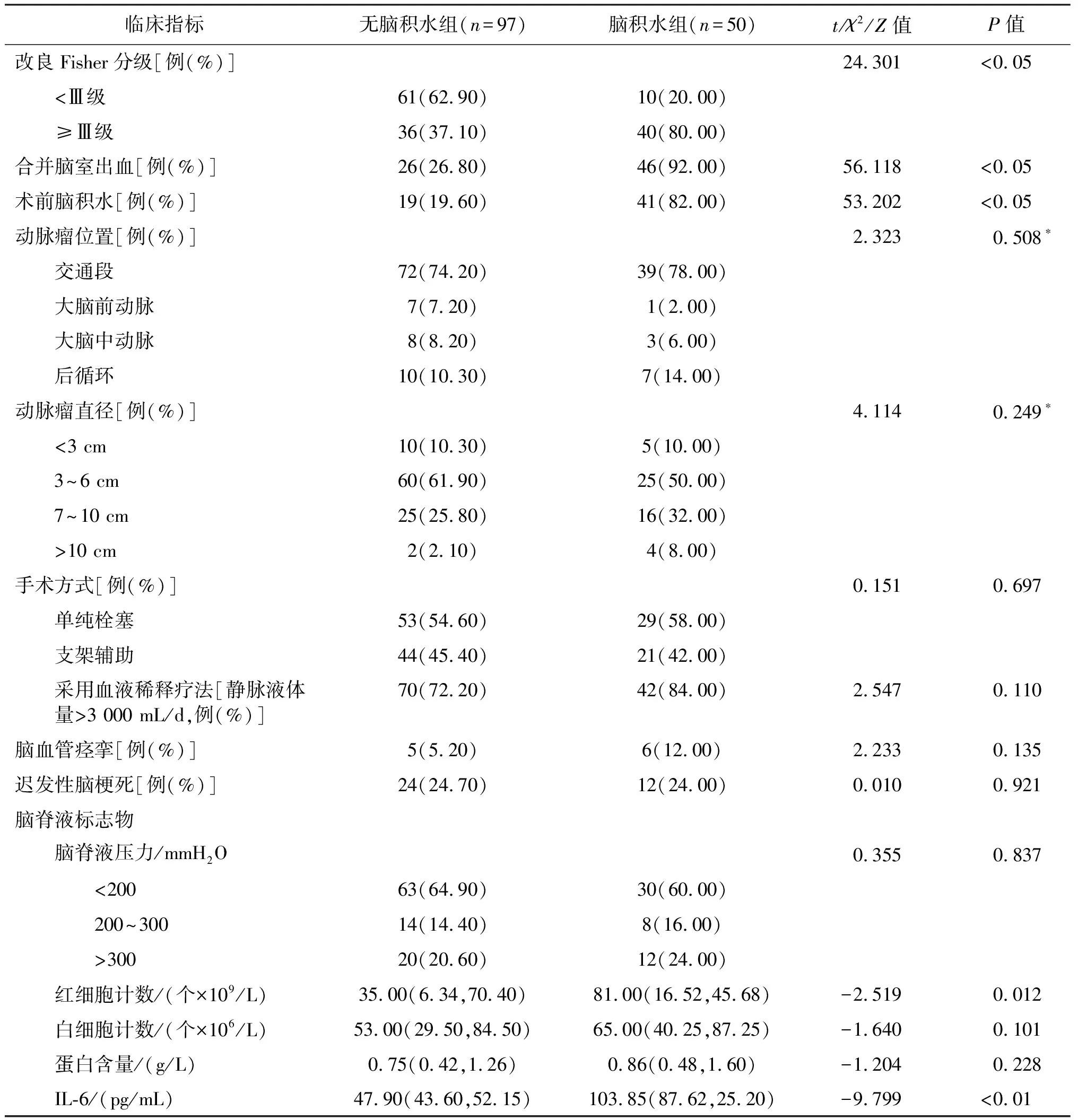
续表1

表2 多因素Logistic回归分析急性脑积水的相关因素
2.3 脑脊液分析预测aSAH患者亚急性脑积水的ROC曲线
脑脊液红细胞计数及IL-6预测aSAH患者术后30 d内发生脑积水的曲线下面积分别为0.627(0.525~0.729)、0.966(0.936~0.997),诊断界值分别为78 950×106/L及62.25 pg/mL;脑脊液红细胞计数的敏感度和特异度分别为52.0%、79.4%,IL-6的敏感度和特异度分别为96.9%、96.0%。见图1。
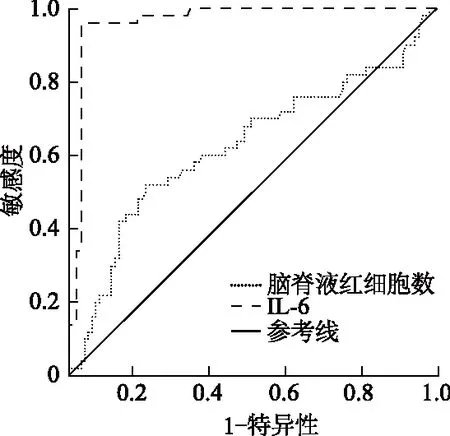
图1 脑脊液红细胞计数及IL-6的ROC曲线
3 讨论
本研究结果显示,aSAH患者亚急性脑积水发生率达34.0%,略低于Bashir、Chang等[1,9]报道的发生率36.2%~55.5%,可能与本研究患者观察时间短,局限于亚急性期有关。本研究单因素分析结果显示,年龄为亚急性脑积水的危险因素,这与Xie等[2]报道年龄≥50岁,Bae等[8]及其他研究[9-10]报道年龄≥70岁是发生脑积水的危险因素相符。但是,多因素分析时剔除年龄,原因可能与入组患者平均年龄集中在50~70岁有关。Xie等[2]研究发现,初诊时脑室扩大、动脉瘤位置、脑室脑池积血分布计分和术后颅内感染为aSAH患者发生术后脑积水的危险因素,Chang等[9]报道脑室内出血、大脑前动脉瘤和外部脑脊液引流为危险因素。另有Wilson和Shigematsu等[10-11]研究表明,aSAH患者的分流依赖性危险因素包括高龄、脑室出血、高Hunt-Hess分级评分、急性脑积水、后路动脉瘤和再出血;其中,脑室出血可使分流依赖性脑积水的风险增加4倍,不同脑室出血的预测价值逐级递减依次为四脑室、侧脑室、三脑室,本研究均合并侧脑室出血,故未进行分类。本研究多因素分析显示侧脑室出血与继发脑积水相关,与上述文献报道相符。其相关机制已经动物实验验证,Okubo等[12]研究发现,在脑室出血模型SD大鼠脑室内注射溶血红细胞,可直接导致急性脑积水,可能为溶血红细胞诱导脑脊液铁超负荷,导致室管膜细胞死亡和纤毛丧失,引发脑脊液动力学缺陷和脑室蛛网膜颗粒功能障碍,进而致脑脊液重吸收降低。研究表明[13-14],脑池内纤维蛋白溶解治疗可改善蛛网膜下腔出血患者的不良预后并降低脑积水发生率和死亡率,进一步验证脑室出血为脑积水的危险因素。因此,脑室内注射纤维蛋白溶解剂有望通过临床Ⅳ期实验成为患者出血后脑积水一种新的治疗方式。本研究未观察到aSAH患者术后亚急性脑积水与瘤体位置、手术方式等因素相关,可能与纳入患者均采用血管内栓塞介入,不影响脑脊液循环通路有关。
Chaudhry等[15]研究发现,在出血后的前2周内,aSAH患者尤其合并癫痫、脑血管痉挛和慢性脑积水者,其血清IL-6水平显著高于正常对照组。但是,血清IL-6水平受感染、应激状态等全身因素干扰,不能准确反映颅内的炎症水平。随着腰椎穿刺脑脊液置换术越来越多用于蛛网膜下腔出血术后治疗,有关aSAH患者脑脊液分析的临床研究很多,但关注点多围绕迟发脑血管痉挛[16-17]、脑缺血并发症[18]以及不良预后[19],是否与出血后脑积水有关以及可否作为生物预测标志物,因与所选取的术后时间节点不同,研究结论不尽相同[20-21]。多项研究发现,脑脊液炎性因子如IL-6[16,22-24]、干扰素-γ诱导单核细胞因子[22]、基质金属蛋白酶-9[17,22]等均参与脑脊液炎性反应,尤其在疾病急性期IL-6水平显著升高,3~5 d达峰值,2 周内保持高水平,随后逐渐下降,与迟发性脑缺血、脑积水及不良预后密切相关[22-24]。另有研究报道,IL-6为慢性分流依赖性脑积水的唯一独立预测因子[23]。因慢性脑积水多为不可逆,均需要二期脑室腹腔分流手术治疗,错失早发现及干预时机。故本研究选取术后3 d脑脊液IL-6高峰期为观察节点,并以亚急性期脑积水为观察指标;结果显示,脑脊液红细胞计数升高及IL-6水平升高是影响aSAH患者术后30 d内亚急性脑积水的独立危险性因素,但红细胞计数的诊断价值较低,可能与脑脊液循环障碍条件下,腰池红细胞计数不能如实反映脑池的蛛网膜下腔出血量有关。IL-6可作为颅内急性炎症过程的标志物,可能在促进免疫反应性星形胶质细胞和小胶质细胞出现大量的神经胶质增生,继发疤痕形成中发挥作用[23]。研究表明,脑脊液炎症参与血脑脊液屏障破坏,通过刺激脉络丛上皮Na+/K+/2Cl-离子共转运蛋白(NKCC1)磷酸化,增加转运蛋白的活性,从而导致脑脊液多度分泌[14,25-26];在出血后脑积水模型大鼠中,发现通过富含脯氨酸的丙氨酸激酶SPAK-NKCC1抑制剂(布美他尼)治疗可预防脑积水[27]。
本研究建议对术前合并脑室出血及脑积水的aSAH患者术后3 d内积极行腰穿脑脊液检测,若脑脊液IL-6>62.25 pg/mL,则术后30 d内亚急性出血后脑积水概率明显升高,建议积极放置临时的脑脊液导流装置或多次行腰椎穿刺脑脊液引流术,并加用地塞米松鞘内注射抗炎治疗降低颅内炎性反应,避免远期发展为不可逆性慢性迟发性分流依赖性脑积水。由于本研究属于回顾性病例分析,部分数据采集存在一定偏倚,且仅纳入行介入栓塞术后aSAH患者,脑脊液测定指标仅为单点采样、单次测验,存在测量误差及观察盲点等缺陷,有待进一步行外部验证确认其预测价值。
综上所述,临床上可通过动脉瘤栓塞术后3 d内脑脊液IL-6的定量分析对aSAH患者进行亚急性脑积水的预测,以达到早关注早干预的目的。
