基于自支撑多孔硅微腔的DNA光学检测*
2023-05-16马仲伟谢洁荣吕长武
马仲伟,谢洁荣,吕长武
(新疆大学 物理科学与技术学院,新疆 乌鲁木齐 830017)
0 引言
多孔硅(Porous Silicon, PSi)是一种纳米多孔硅材料,因其具有较大的比表面积、易于生物分子修饰、折射率可调控等优势,广泛应用于制作各类生物传感器[1].PSi根据平均孔径尺寸分为微孔(<2 nm)、介孔(2~50 nm)和大孔(>50 nm)多孔硅.PSi的平均孔径主要取决于硅衬底的掺杂和制备参数.孔径尺寸直接影响生物分子的渗透,可以通过选择适当的电流密度和电解质组成对孔径尺寸从几纳米到几微米之间进行调节[2].
多孔硅膜(Porous Silicon Membranes, PSiMs)是通过单晶硅基底分离多孔层制成的具有高渗透性的自支撑多孔硅薄膜[3].根据多孔化制备工艺策略可以制备出具有独立式[4]、横向[5]、微型[6]等多种结构特征的PSiMs.它的孔隙率和厚度在单个层内可以调控,厚度可以是从纳米到毫米量级.近年来,因PSiMs具有独特的光电学、化学、热学等性能,研究者对其研究兴趣不断增长.PSiMs的应用领域不断拓展,主要包括微流体、医疗应用、传感、能量转换和电子器件等方面.
目前,已有多种结构类型的PSi光学生物传感器被报道,如PSM[7]、布拉格反射镜(Distributed Bragg Reflector, DBR)[8-9]、表面光栅[10]等结构.在这诸多结构的生物传感器中,PSM生物传感器由于其强大的场抗干扰能力和反射光谱存在半宽高较窄的高透射共振峰,使其具有较高的检测灵敏度[11].因此,基于PSM的生物传感器被广泛应用于DNA、抗原、酶、蛋白质、细菌等生物分子的检测[12-16].Li等[17]在P型硅片上制备了PSM生物传感器,并通过反射角度谱检测方法对8个碱基DNA生物分子的结合进行了检测,检测限为87 nmol/L.该团队为了避免多孔硅对可见激光的强吸收,在检测过程中用红外激光作为检测光源,提高了对DNA生物分子的检测灵敏度.另外,Neeraj等[18]通过制备独立式PSM生物传感器检测牛血清白蛋白(Bovine Serum Albumin, BSA).这种生物传感器的识别元素是在氧化后的PSi上通过3-氨基丙基三乙氧基硅烷((3-Aminopropyl)triethoxysilane,APTES)功能化来提供胺基,然后加入戊二醛偶联剂.当BSA被戊二醛捕获到多孔基质内时,独立式PSM生物传感器的折射率增加,共振波长红移实现高灵敏度BSA检测.Zhao等[19]制备的独立式PSM生物传感器在APTES和生物素修饰后,链霉蛋白吸附使微腔共振波长发生红移.总的检测时间为20分钟,比基于PSi层的生物传感器快6倍.PSi层与PSiMs的生物传感特性多次对比研究表明[20]:PSi的渗透性弱,生物分子进入多孔硅层的深度有限,浓度在垂直于表面方向呈现梯度递减的趋势,对生物分子的捕获量往往受到限制.而PSiMs较大的开放性表面增强了生物分子的渗透性,从而提高了对生物分子的捕获能力,可在生物传感方面产生较高的检测灵敏度和快速的响应时间.这就使得PSiMs在生物传感方面的应用更具有吸引力[21-22].
基于PSi的生物传感器主要依靠结构光学特征的变化作为检测手段,例如反射、透射光谱的移动和荧光强度的变化等[23-25].其它检测方法还包括阻抗和安培传感[26],这些检测手段需要昂贵的检测仪器.本研究为了提高DNA分子的检测灵敏度、降低检测成本,用电化学蚀刻在单晶硅表面制备多孔硅微腔后,用大电流脉冲分离制备自支撑多孔硅微腔.并采用一种免光谱仪的透射角度谱法对8个碱基序列DNA进行了检测,获得了高灵敏度的检测结果.
1 理论分析与实验
1.1 理论分析
基于PSM的生物传感器在生物检测过程中目标生物分子进入孔洞与孔壁偶联的数目越多则器件折射率变化越大,其检测生物分子的灵敏度就越高.但在单晶表面制备的PSM生物传感器在检测生物分子时,由于生物分子的大小和多孔层孔径尺寸之比太小,易影响生物分子进入多孔层的深度,阻碍生物分子的检测灵敏度的提高.为了克服这一困难,从单晶硅基底分离多孔硅微腔吸附在石英玻璃表面制备自支撑的多孔硅微腔,多孔硅微腔和石英玻璃之间形成一个微米级的空气层,空气层为生物分子提供了新的通道,继而有更多的生物分子进入使PSM的折射率增加,从而提高生物分子的检测灵敏度.图1是生物分子进入自支撑多孔硅微腔多孔层的示意图.

图1 生物分子进入自支撑多孔硅微腔多孔层示意图
1.2 实验
制备多孔硅的方法是单晶硅在含有氢氟酸(HF)的电解液中进行电化学蚀刻.多孔硅的孔隙率和厚度取决于基底的特性以及制备参数(如蚀刻电流密度和时间、电解质中HF浓度和环境温度),但主要受蚀刻电流密度和HF浓度的制约.本实验用电化学蚀刻法制备自支撑多孔硅微腔的过程分两步进行.
1.2.1 电化学蚀刻制备多孔硅微腔
实验用P型单晶硅(电阻率为0.01~0.06 Ω·cm,晶向为<100>,厚度为(450±10)μm),将硅片切成1.2 cm×1.2 cm的矩形小片.蚀刻前将切好的硅片分别在丙酮、乙醇、去离子水中各超声清洗1分钟以除去表面油污,吹干后置于用聚四氟氯乙烯材料制备的单腐蚀槽中,取5~10 mL由无水乙醇和40%的氢氟酸溶液按体积比(V无水乙醇∶V氢氟酸=1∶1)混合而成的电解液倒入腐蚀槽中.用CS系列电化学工作站的工作电极(Working Electrodes, WE)连接硅片、对电极(Counter Electrode, CE)连接铜丝,设置制备一维光子晶体的高、低蚀刻电流密度分别为110 mA/cm2和60 mA/cm2,蚀刻时间分别为2 s和2.4 s,缺陷层蚀刻电流密度为110 mA/cm2,蚀刻时间为4 s.蚀刻的多孔硅面积约为0.502 4 cm2.蚀刻结束后分别用去离子水和无水乙醇反复冲洗,然后用吹风机吹干.
1.2.2 分离制备自支撑多孔硅微腔
在特定的HF浓度和蚀刻条件下多孔层将会从硅基底分离.为了分离多孔硅微腔,需将干燥后的多孔硅样品再次置于腐蚀槽中,加入无水乙醇和40%的氢氟酸溶液按体积比(V无水乙醇∶V氢氟酸=3∶1)混合的电解液.设置蚀刻电流密度为160 mA/cm2,蚀刻时间为1.2 s.蚀刻后的PSM底部产生一层大孔隙率的牺牲层,牺牲层在微小外力作用下断裂,多孔硅微腔与基底分离,并转移到石英玻璃片上.图2是成功分离的自支撑多孔硅微腔样品.

图2 自支撑的纳米多孔硅微腔
1.3 样品的功能化
1.3.1 氧化
新制备的PSM样品在空气环境中不稳定,其表面的Si-H键容易在空气中被氧化,为了让其表面化学性质稳定,将样品置于40%浓度的H2O2溶液中,并在60 ℃的恒温干燥箱中存放30分钟进行氧化.取出后用去离子水浸泡10分钟,并在空气环境中缓慢干燥.
1.3.2 硅烷化
将氧化后的样品置于浓度为5%的APTES溶液中浸泡30分钟,该溶液由APTES、甲醇和去离子水按体积比(VAPTES∶V甲醇∶V去离子水=1∶10∶10)混合组成.硅烷化结束后取出样品用去离子水浸泡10分钟,去除多余量的APTES和甲醇溶剂,并在空气环境中缓慢干燥.
1.3.3 戊二醛
为了在样品表面固定探针DNA生物分子,硅烷化修饰后将其浸泡在浓度为2.5%的戊二醛溶液中30分钟,该溶液由戊二醛和去离子水按体积比(V戊二醛∶V去离子水=1∶19)混合组成.取出样品后用pH=7.4的磷酸缓冲液(Phosphate Buffer, PB)和去离子水各浸泡10分钟,去除剩余的戊二醛,并在空气环境中缓慢干燥.
1.4 材料仪器与检测
1.4.1 实验材料和仪器
检测8个碱基对的探针、目标、非目标DNA序列分别是5’-TGCAACGT-3’-NH2、5’-ACGTTGCA-3’-NH2、5’-TAGCCGAT-3’-NH2,APTES、戊二醛(Glutaraldehyde, GA)、甲醇和PB.用场发射扫描电子显微镜(FESEM)拍摄样品的表面形貌和截面(ZEISS SUPRA 55VP,德国).用紫外可见分光光度计(日立/U-4100,日本)采集样品的反射光谱.
1.4.2 样品检测
用透射角度谱法对样品进行检测,为了减少样品对光的吸收,选择功率为1 mW、波长为1 550 nm的半导体激光器作为入射光源.把样品固定在分光计的载物台上,光束经过TE偏振器后到达自支撑多孔硅微腔表面,用触摸屏手持光功率计接收微腔的透射光.检测的光路示意图如图3所示,转动分光计可获得不同入射角时透射光的强度.

图3 光路示意图
2 结果与讨论
在单晶硅表面成功制备PSM后用大电流脉冲分离制成自支撑PSM样品,分离后样品的机械性能差,容易破碎.为了便于实验研究,将其转移到石英玻璃片上.图4是用扫描电镜拍摄的PSM的表面和截面,图4(a)为样品的表面形貌图,图中黑色区域是孔洞,灰色区域是剩余的硅,孔径的尺寸和分布是随机性的,孔径尺寸一般在20~30 nm之间,足以让检测的DNA分子进入.图4(b)为样品的截面图,可以明显观察到高、低折射率层周期性分布的一维光子晶体结构.浅灰色层是高折射率(nH)多孔层,层厚度约为196.0 nm,而深灰色层是低折射率(nL)多孔层,层厚度约为178.0 nm.整个样品的总体厚度约为9.21 μm.另外,图4(c)红色虚线是通过理论仿真得到的反射光谱,黑色实线是实验样品的反射光谱,可以观察到理论与实验的缺陷峰波长位置在λ=1 020 nm处.由于散射、吸收和表面波动的影响,实验样品相比理论仿真的反射率低,半宽高增加[27].

图4 自支撑多孔硅微腔表面SEM形貌(a)、截面(b)和反射光谱(c)
本文对自支撑PSM样品进行氧化、硅烷化和戊二醛三个过程的功能化修饰,目的是使样品的孔隙表面含有大量的醛基以稳定链接探针DNA生物分子.为了确保每一步功能化修饰的成功,必须在每一步功能化结束后对样品进行透射角度谱测量.图5(a)是样品在氧化、硅烷化、戊二醛功能化后测量的透射角度谱,可以看出每一步功能化后透射角度谱发生明显的移动,说明样品功能化成功.随后用微量移液管取70 μL浓度为10 μmol/L的探针DNA滴在样品上,在37 ℃环境下存放2 h.为了防止非特异性吸附,用PB浸泡去除多余的探针DNA,并在空气中缓慢干燥.由于探针DNA用氨基修饰后与样品表面的醛基连接,因此被固定在样品孔隙中.为了封闭多余的醛基,取70 μL浓度为3 mol/L的乙醇胺缓冲液滴在样品上并存放在37 ℃环境中1 h,然后用PB浸泡除去多余的乙醇胺,取出样品置于空气环境中缓慢干燥.为确保探针DNA的固定,对样品进行透射角度谱的测量.测量后在样品上滴加70 μL浓度为1 μmol/L的目标DNA,在37 ℃环境下存放2 h后用PB浸泡并干燥,然后对样品进行透射角度谱的测量,结果如图5(b)所示.由于目标DNA与样品中固定的探针DNA发生偶联,改变了PSM多孔层折射率,导致透射角度谱红移了约6°.图6(a)和图6(b)分别是加入70 μL浓度为1 μmol/L的非目标DNA和浓度为3 mol/L PB后测量的透射角度谱.可以观察到,透射角度谱的红移可以忽略不计,这是由于探针DNA与非目标DNA和PB不发生偶联.因此,样品的折射率不发生改变.

图5 氧化、硅烷化、戊二醛功能化后透射角度谱的变化(a)和加入1 μmol/L浓度的目标DNA后透射角度谱的变化(b)

图6 加入非目标DNA(a)和PB(b)后透射角度谱的变化
分别取0.1、0.2、0.5、0.75、1.0 μmol/L浓度的目标DNA,测量其透射角度谱的红移发现,在0.1~1.0 μmol/L的范围内,样品的透射角度谱红移随着目标DNA浓度的增加而增加.从图7中的线性拟合曲线可以观察到,在0.1~1.0 μmol/L范围内,样品的透射角度谱移动量与目标DNA的浓度呈良好的线性关系.拟合系数为0.975,线性方程为Y =5.462X+0.814.其中:Y 为加入不同浓度的目标DNA分子后样品的透射角度谱移动量,X为目标DNA的浓度.通过计算得到该生物传感器的灵敏度5.5(°)/(μmol·L-1).本实验中采用的设备的分辨率大约为0.2°[14].因此,自支撑多孔硅微腔对8个碱基对DNA序列的检测限为0.037 μmol/L.自支撑多孔硅微腔对生物分子的通透性增加,增强了生物分子的捕获能力,进而提高了对生物分子的检测灵敏度.
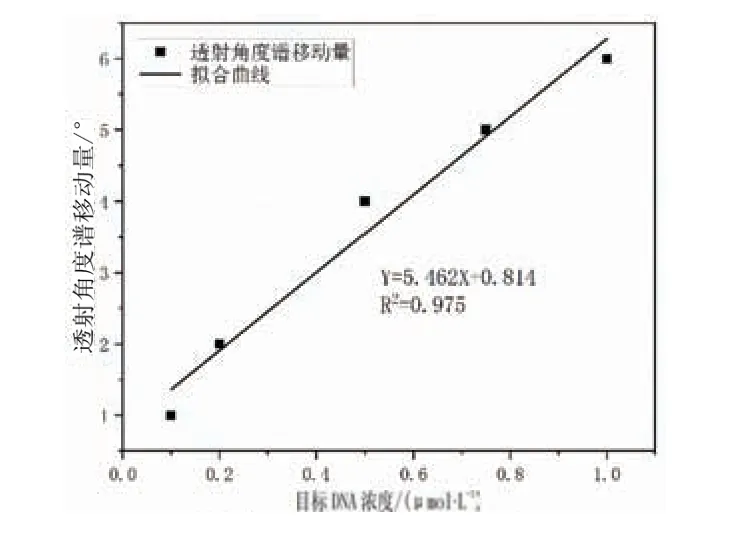
图7 透射角度谱的移动量随着目标DNA浓度的变化
3 结论
用电化学工作站在单晶硅上制备PSM结构,然后用大电流脉冲分离了多孔硅微腔,并转移到石英玻璃片上.用扫描电子显微镜拍摄了多孔硅微腔样品的表面和截面形貌.功能化后将样品与探针DNA偶联.使用免光谱仪器的透射角度谱检测了8个碱基对不同浓度的目标DNA,检测限达0.037 μmol/L.相比Li等[17]在单晶硅上制备的未分离的PSM生物传感的检测灵敏度提高了2.4倍.自支撑多孔硅微腔检测生物分子具有灵敏度高、成本低等优点,可实现快速、无标记的生物检测.
