菌/酶添加对甜高粱渣青贮预处理作用的强化效果
2023-05-15任海伟石瑞锋魏慧元郭晓鹏刘瑞媛李金平
任海伟,石瑞锋,魏慧元,王 莉,郭晓鹏,陆 栋,刘瑞媛,李金平
·农产品加工工程·
菌/酶添加对甜高粱渣青贮预处理作用的强化效果
任海伟1,2,3,石瑞锋1,魏慧元1,王 莉1,郭晓鹏1,陆 栋4,刘瑞媛4,李金平2,3※
(1. 兰州理工大学生命科学与工程学院/西部能源与环境研究中心,兰州 730050;2. 甘肃省生物质能与太阳能互补供能系统重点实验室,兰州 730050;3. 西北低碳城镇支撑技术协同创新中心,兰州 730050;4. 中科院近代物理研究所,兰州 730050)
为实现生物质甜高粱渣的青贮强化预处理和能源化利用,该研究探究了不同添加剂对其青贮质量和酶解糖化效果的影响。试验设置对照组(CK组)、植物乳杆菌组(L组)、纤维复合酶组(E组)和复合添加剂组(LE组),系统考察甜高粱渣在21 d青贮预处理期间的营养成分、木质纤维组分和发酵品质的动态变化,采用隶属函数法评价青贮质量,利用高通量测序技术分析青贮预处理过程的微生物菌群动态演绎。结合酶解糖化性能评价青贮预处理作用的强化效果,从而筛选适宜的添加剂。结果表明:青贮预处理后甜高粱渣的粗蛋白、淀粉、中性洗涤纤维、酸性洗涤纤维、半纤维素和纤维素等能量组分含量显著高于原料(<0.05)。青贮21 d时,3个添加剂组的干物质、可溶性碳水化合物和粗蛋白含量显著高于CK组(<0.05),综纤维素含量显著低于CK组(<0.05),且E组的干物质含量最高,L组的粗蛋白含量最高,E组和LE组的可溶性碳水化合物含量最高。青贮预处理期间,3 个添加剂组的pH值均低于4.2,L组的乳酸和乙酸含量明显高于CK组(<0.05),E组的乳酸/乙酸和乳酸/总有机酸比值显著高于CK组(<0.05)。隶属函数法综合评价E组的青贮发酵质量最高。微生物菌群结果显示,甜高粱渣经青贮预处理后,3个添加剂组的细菌菌群丰富度和多样性都明显下降,门水平细菌主要以变形菌为主,属水平细菌主要包含肠杆菌、泛菌、明串珠菌、魏斯氏菌、拉恩氏菌和葡糖杆菌等,这些微生物与青贮质量密切相关。甜高粱渣经青贮预处理后的还原糖得率显著提升,尤其E组得率比原料提高了117%。结合成本效益法分析,利用纤维复合酶对甜高粱渣进行青贮强化处理的E组纯收益最高,较甜高粱渣原料提高了近3倍。总之,单独添加纤维复合酶不仅能明显改善甜高粱渣的青贮发酵质量,实现稳定保存,还能使其青贮预处理作用得到强化,进而提高甜高粱渣的生物降解性能,是一种经济合理、技术可行的青贮预处理强化方法。
青贮;发酵;植物乳杆菌;纤维复合酶;甜高粱渣;微生物菌群;酶解糖化
0 引 言
中国生物质资源量丰富,年均产生量约34.94亿t(折合4.6亿t标煤),目前已实现能源化利用的资源量约4.61亿t,碳排量减少约2.18亿t。预计2030年各类生物质能的利用将会为全社会减少碳排放约9亿t,到2060年将实现碳减排约20亿t。因此,大力发展生物质能等清洁能源不仅是“十四五”期间生物经济和可再生能源发展的重点方向,也是中国顺利实现“双碳”目标的重要途径。甜高粱是一种C4能源植物,具有耐旱、耐盐碱、生物产量高等特点。甜高粱茎汁含有丰富的葡萄糖、果糖和蔗糖等可溶性碳水化合物,能发酵制取氢气、丁酸等产品[1-2]。榨汁后的甜高粱渣富含纤维素、半纤维素等结构性碳水化合物,被广泛用于生物乙醇、生物甲烷、复合材料、动物饲料等领域[3-4]。据不完全统计,2022年中国甜高粱种植面积约4.88万hm2,产量约475万t,其榨汁后可产生甜高粱渣136.4万t,资源量巨大[3]。由于甜高粱渣的水分、糖分等营养物质含量还相对较高,若不能及时保质贮存和高效利用,不仅容易造成腐败变质和资源浪费,还会带来环境污染等问题。
青贮作为一种典型的湿法贮存技术,不仅能延长生物质原料贮存时间,有效保存其营养物质和能量组分,还能起到一定的生化预处理作用[5-6]。同时,添加乳酸菌、酵母菌、木质纤维分解菌等微生物菌剂以及酶制剂和有机酸等添加剂能在一定程度上强化青贮预处理作用,进而提高其生物降解性能和乙醇、甲烷等能源产出[7-8]。XING等[7]发现高粱秸秆青贮过程中加入复合酶(纤维素酶和半纤维素酶)能显著降低中性洗涤纤维、酸性洗涤纤维含量,提高青贮质量。USMAN等[9]发现添加产阿魏酸酯酶的植物乳杆菌能促进高粱秸秆的青贮发酵,降低pH值并抑制不良微生物生长,提高还原糖和乙醇发酵得率。WRIGHT等[10]发现通过青贮甜高粱渣可有效抑制不良微生物,获得稳定保存并用于能源生产。WILK等[11]发现添加布氏乳杆菌能促进青贮甜高粱渣的异型乳酸发酵,提高乙酸含量,改善有氧稳定性,强化青贮效果。DONG等[12]认为甜高粱渣青贮中添加植物乳杆菌、布氏乳杆菌和纤维素酶进行联合强化作用后,可获得低pH值、高含量乳酸和可溶性碳水化合物。ZEGADA-LIZARAZU等[13]认为联合添加布氏乳杆菌和干酪乳杆菌能显著降低青贮甜高粱渣的干物质损失,提高乳酸、乙酸和丙酸含量及产甲烷潜力。但有关纤维复合酶、植乳乳杆菌对甜高粱渣青贮预处理效果评价的研究还鲜有报道。
本文以甜高粱渣的保质贮存和强化生物降解为目标,探讨了甜高粱渣青贮预处理过程中添加植物乳杆菌、纤维复合酶(纤维素酶和木聚糖酶)对木质纤维等有机组分、青贮发酵品质的动态影响并通过HiSeq2500高通量测序平台分析青贮过程中的细菌群落动态演绎进程,通过酶解糖化试验比较不同添加剂对青贮预处理作用的强化效果,同时结合成本效益法综合评价不同添加剂的经济合理性,进而筛选适宜的添加剂,以期为甜高粱渣木质纤维组分高效转化和能源化利用奠定基础。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料
甜高粱(KFJT-3品系)原料来自中科院近代物理研究所白银种植基地,榨汁后切短至1~2 cm备用。植物乳杆菌(ACCC11016)购自中国农业微生物菌种保藏管理中心。
青贮预处理所用纤维复合酶(含纤维素酶和木聚糖酶,复合比4∶1)购于宁夏和氏璧生物技术有限公司。依《饲用纤维素酶活性的测定:GB/T 23881-2009》和《饲料添加剂木聚糖酶活力的测定:GB/T 23874-2009》测得该复合酶的纤维素酶活力为60 000 U/g,木聚糖酶活力为20 000 U/g,综合酶活力为52 000 U/g。酶活力定义:1 g酶粉于50 ℃、pH 值5.0条件下,1 min水解羧甲基纤维素或木聚糖产生1 μg葡萄糖或木糖的酶量为1个酶活力单位。
1.1.2 试验仪器与设备
F800纤维分析仪和K9840 半自动凯氏定氮仪,山东海能科学仪器有限公司;Agilent 1260 高效液相色谱仪,安捷伦科技公司;SpectraMax M5酶标仪,Molecular Devices公司。
1.2 青贮发酵试验设计
准确称取一定量甜高粱渣原料(sweet sorghum bagasse,SSB),与不同添加剂充分混匀后立即装入聚乙烯包装袋,抽真空后迅速密封,常温(20±2) ℃下避光青贮21 d。每隔7 d定期取样分析有机组分、发酵品质和微生物菌群多样性。添加剂加入量均以原料鲜重(fresh weight,FW)为基础,设置植物乳杆菌组(L组,添加量1×108CFU/g 以FW计,下同)、纤维复合酶组(E组,添加量3 g/kg)和菌酶联合处理组(LE组,植物乳杆菌添加量1×108CFU/g,纤维复合酶添加量3 g/kg)3个添加剂处理组和1个空白对照组(CK组,青贮时添加等量蒸馏水),每个试验组3个平行[14]。
1.3 青贮质量评价
1.3.1 有机组分含量分析
干物质(dry matter,DM)、水溶性碳水化合物(water soluble carbohydrates,WSC)、粗蛋白(crude protein,CP)、淀粉(starch,ST)、中性洗涤纤维NDF(neutral detergent fiber,NDF)、酸性洗涤纤维ADF(acid detergent fiber,ADF)和酸性洗涤木质素ADL(acid detergent lignin,ADL)等组分测定参考文献[15]进行。纤维素CL(cellulose,CL)、半纤维素HC(hemicellulose,HC)和综纤维素HoC(holocellulose,HoC)含量依式(1)~(3)计算[16]。
CL=ADF-ADL(1)
HC=NDF-ADF(2)
HoC=CL+HC(3)
1.3.2 青贮发酵品质分析
pH值测定采用UB-7酸度计,氨态氮(ammonia nitrogen,AN)分析采用苯酚-次氯酸钠比色法,乳酸、乙酸、丙酸等有机酸产物分析采用安捷伦1 200高效液相色谱仪检测,配置 KC-811 离子柱和 DAD 检测器,柱温50 ℃,流动相3 mmol/L HClO4溶液,进样量 5 μL[6]。
1.3.3 青贮质量综合评价
采用模糊数学隶属函数法对有机组分和发酵特性等9个指标进行综合评价[17],计算参考式(4)~(5)。以全部指标隶属函数值平均值大小进行排序。
U(+)=(X-min)/(max-min)(4)
U(-)=1-(X-min)/(max-min)(5)
式中U(+)为各指标正相关隶属函数值;U(-)为各指标负相关隶属函数值;X为某指标测定值;min和max分别为某指标所有测定值的最小值和最大值。
1.3.4 青贮预处理前后的甜高粱渣生物降解性能评价
采用酶解糖化方法评价其生物降解性能。准确称取0.5 g甜高粱渣原料或青贮21 d样品,按照1∶20(g/mL)料液比加入柠檬酸缓冲液(pH 值为4.8,0.05 mol/L),然后依次添加购自北京索莱宝科技有限公司的纤维素酶(标注酶活力3 000 U/g,加酶量1 000 U/g)、半纤维素酶(标注酶活力1 500 U/g,加酶量500 U/g)和-葡聚糖苷酶(标注酶活力3 300 U/mg加酶量1 U/g)进行酶解反应,对照组加入等量蒸馏水,恒温振荡酶解72 h,间隔12 h测定酶解液中的单糖组分。葡萄糖与木糖得率按式(6)~(7)计算,还原糖得率由各单糖得率相加[18]。


式中Y为葡萄糖得率,mg/g;Y为木糖得率,mg/g;为单糖浓度,g/mL;为上清液体积,mL;为稀释倍数;为样品质量,g;0.9为葡萄糖与葡聚糖转化系数;0.88为木糖与木聚糖转化系数。
1.4 青贮发酵过程的微生物菌群分析
依Water DNA试剂盒步骤提取微生物总DNA。PCR 扩增区域16SrDNA V3-V4 区,选择引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACT ACHVGGGTWTCTAAT-3')。采用 PCR仪对细菌16SrDNA基因进行 PCR 扩增。每个样本3个重复,将同一样本的 PCR 产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA试剂盒切胶回收PCR产物,Tris-HCl 洗脱;最后采用NaOH对PCR产物变性,产生单链DNA片段,用HiSeq2500平台进行测序。测序结果与NCBI基因库进行比对,按照97%相似性水平划分操作分类单元(OTU)。采用QIIME软件计算Shannon和Chao1等Alpha多样性指数,选取相对丰度高于0.1%的细菌类群进行门、属水平分析,并基于属水平相对丰度构建主坐标分析(PCA)[19]。
1.5 经济效益指标分析
运用成本收益法对甜高粱渣青贮预处理过程涉及的成本投入和综合收益进行计算。根据成本收益理论构建适宜的青贮预处理成本收益模型,计算式为
I=M·-W·-(E+1)(8)
M=W·R(9)
式中表示甜高粱渣(原料或青贮预处理)的纯收益,元;表示每吨甜高粱渣(原料或青贮预处理)酶解糖化后的还原糖质量,t;表示每吨甜高粱渣(原料或青贮预处理)的干基质量,t;表示酶解糖化后的还原糖得率,mg/g;表示还原糖的市场收购价格,4 520元/t,(参考99%葡萄糖售价);表示纤维素酶解成本,1 300 元/t 以计[20];表示每吨甜高粱渣的青贮成本,元/t(含添加剂成本);1表示每吨甜高粱渣的收购成本,元;表示原料或不同预处理方法。
1.6 数据分析
经Excel 2019软件整理原始数据,采用平均值±标准差表示。使用SPSS 26.0软件进行双因素方差分析,单因子 ANOVO模型处理及Duncan方法对数据进行多重比较分析,数据用平均值±标准差表示,使用Origin 9.0软件绘制图表。<0.05 代表数据差异显著,>0.05代表数据差异不显著。
2 结果与分析
2.1 青贮预处理过程中营养成分的变化
2.1.1 干物质与干物质损失率
甜高粱渣中的干物质主要包括粗蛋白、淀粉和可溶性碳水化合物等,其含量高低能综合反映青贮质量优劣,这些组分的含量越高,说明营养物质损失越少,青贮品质越好[21]。由图1a可知,与原料相比,4个试验组在青贮7d时的干物质含量显著下降(<0.05),这是因为青贮初期原料附着的乳酸菌等微生物菌群利用WSC和淀粉等易降解组分发酵产生有机酸、CO2和H2O所致[22]。青贮14和21 d时,4个试验组的DM含量总体保持稳定,其中E组在14和21 d呈现升高趋势,说明添加纤维复合酶有助于减缓干物质损失。寇江涛等[23]也认为纤维素酶和木聚糖酶能减少青贮过程中营养物质的损耗,提高青贮DM含量。原因在于纤维复合酶的添加有效分解了植物细胞壁中的纤维素和半纤维素等结构性碳水化合物,为有益乳酸菌等微生物活动提供了充足的发酵底物,促进了发酵进程。同时,随着乳酸等有机酸积累和pH值降低,也抑制了其他不良微生物活性,进而减少干物质损耗。这与E组在21 d青贮期间的干物质含量显著高于CK组(<0.05),干物质损失率显著低于CK组(<0.05)结果相吻合。

注:CK,对照组;L,植物乳杆菌处理组;E,纤维复合酶处理组;LE,菌酶联合处理组。不同大写字母表示相同处理组不同时间差异显著(P<0.05);不同小写字母表示相同时间不同处理组差异显著(P<0.05)。下同。
2.1.2 粗蛋白
粗蛋白含量是反应青贮质量优劣的重要指标。由图 2a可知,青贮甜高粱渣的CP含量均显著高于原料(<0.05),且青贮21 d时,3个添加剂组均显著高于CK组(<0.05),说明青贮发酵有利于减少CP损失,尤其加入植物乳杆菌和纤维复合酶等添加剂对保存CP均能起到积极作用。L组的CP含量在21 d青贮期间始终处于最高值,显著高于其他试验组(<0.05)。这是因为植物乳杆菌的加入能使青贮发酵过程中的乳酸菌等有益微生物迅速繁殖,代谢产生大量乳酸并使pH值下降,从而抑制有害微生物对蛋白质和氨基酸的分解[24]。另一方面,植物蛋白水解酶的最适pH值为5.5,低pH的酸性青贮环境也会抑制植物蛋白水解酶活性,从而减少CP分解[25]。XING等[7]也认为添加植物乳杆菌有利于保存青贮甜高粱的蛋白组分。
2.1.3 淀粉
淀粉是甜高粱渣中重要的非结构性碳水化合物。从图2b可以看出,青贮7 d时甜高粱渣的淀粉含量均显著高于原料(<0.05),其中CK组的淀粉含量随青贮时间延长总体呈现升高趋势,而其余3个添加剂组则呈现先升高后下降趋势,使得L组、E组和LE组的淀粉含量在7 d时均显著高于CK组(<0.05),在14和21 d时显著低于CK组(<0.05)。原因可能是因为青贮前期植物乳杆菌和纤维复合酶添加剂能强化青贮发酵进程,加快体系中的乳酸和乙酸等有机酸积累,进一步使pH值快速下降,并有效抑制芽孢杆菌等可降解淀粉微生物的活性,减少了青贮初期的淀粉消耗[26]。但随着青贮过程的继续,青贮微生物菌群不断发生变化,可能会形成具有能分泌淀粉酶的微生物菌群,并使之发生降解,导致3个添加剂组在14和21 d时的淀粉含量明显低于CK组。申瑞瑞等[24]报道的研究结果也证实了这一点。

图2 青贮预处理过程中粗蛋白、淀粉和可溶性碳水化合物含量的动态变化
2.1.4 可溶性碳水化合物
WSC是青贮发酵微生物菌群繁殖代谢的重要底物,WSC≥7%(DM)是青贮pH值能否快速下降的关键[27]。试验中,甜高粱渣原料的WSC含量能完全满足青贮启动之必要条件。青贮7 d时,4个试验组的WSC含量均明显下降(<0.05),原因在于青贮发酵初期体系中的微生物菌群活动频繁,WSC作为代谢底物被优先消耗[28]。青贮21 d时,3个添加剂组的WSC含量显著高于CK组(<0.05)。这是因为低pH值的青贮环境抑制了体系内不良微生物菌群的代谢活性,使3个添加剂组中WSC的消耗量低于CK组;同时青贮体系中加入的植物乳杆菌和纤维复合酶等添加剂在一定程度上也促进了纤维素、半纤维素、淀粉等碳水化合物的分解,使之相较于CK组而言形成了更多的WSC[9,23]。DONG等[12]认为添加商业乳酸菌和菌酶制剂(植物乳杆菌、布氏乳杆菌和纤维素酶)有利于保存青贮甜高粱渣中的WSC组分。FOSTER等[29]也认为在甜高粱青贮中添加纤维素酶和木聚糖酶能提高WSC含量。总之,甜高粱渣青贮预处理过程中加入添加剂有利于甜高粱渣WSC含量保存。
2.2 青贮预处理过程中木质纤维组分变化
木质纤维组分主要包括NDF、ADF、ADL、CL和HC等,这些组分既是甜高粱渣的重要能量组分,也对其降解性能有很大影响。由表1可知,发酵时间、添加剂和其交互作用对青贮甜高粱渣的木质纤维组分含量均有极显著影响(<0.001)。具体地,青贮7 d时,4个试验组的ADF和NDF含量均显著高于原料(<0.05),且NDF含量随时间延长总体呈现显著增加趋势,3个添加剂组的ADF含量则呈现先升高后下降趋势,分别在7 d和14 d时达到最高值。这是因为木质纤维组分因其致密的抗降解屏障网络空间结构,较难被青贮微生物菌群利用,这与ZHANG等[5]研究结果一致。然而,DONG等[12]发现甜高粱渣在青贮60 d时的NDF和ADF含量均呈下降趋势,说明较长时间的青贮预处理能显著降低NDF和ADF含量。本试验的青贮周期相对较短(21 d),使得青贮发酵过程中蕴藏的生物预处理作用尚未能充分发挥效果。
ADF是生物质经过酸性处理后,不溶于酸性洗涤剂的结构性碳水化合物,主要包含纤维素和木质素等。与CK组和E组相比,L组和LE组的ADF含量在整个青贮期间显著增加(<0.05)。有报道认为,植物乳杆菌自身降解CL的能力较弱,而且在植物乳杆菌的影响下纤维素酶不能有效发挥对CL的降解作用,致使L组和LE组中的ADF含量升高[30]。NDF包括酸性洗涤木质素、纤维素和半纤维素等组分,其中半纤维素(HC)是较容易降解的组分之一,在酸性青贮条件下更易被降解[31]。L组和LE组在添加植物乳杆菌后,乳酸协同其他有机酸形成的低pH环境强化了对HC的降解作用,使L组和LE组的NDF和HC含量显著低于CK组和E组(<0.05)。青贮21 d时,E组在纤维素酶和木聚糖酶的共同作用下有效破坏了木质纤维的致密结构,强化了CL的降解效果,使其CL含量显著低于CK组(<0.05)。HC和CL组分含量的同时下降,使3个添加剂组在14 和21 d时的NDF和HoC含量显著低于CK组(<0.05)。ADL组分一般通过共价键、酯键和氢键与纤维素、半纤维素紧密结合,不仅自身较难被降解,而且也是结构性碳水化合物降解的主要屏障。整个青贮期间,4个试验组中的ADL含量均显著高于未青贮原料(<0.05),且CK组和LE组中ADL含量呈现先升高后下降趋势,二者在14 d时达到最高值,而L组和E组则呈现显著升高趋势,这种变化趋势致使青贮21 d时的L组中ADL含量显著高于CK组(<0.05),但LE组和E组与CK组之间没有显著差异(>0.05)。这与GUO等[32]报道在玉米/青稞混合青贮中添加酶制剂(纤维素酶和木聚糖酶)和菌酶(植物乳杆菌、纤维素酶和木聚糖酶)之后的ADL含量显著上升结果相一致。总之,添加植物乳杆菌和纤维复合酶有利于HC的降解,并有效保存CL含量,青贮预处理能为后续的酶解糖化反应提供充足的能量组分。

表1 青贮预处理过程中木质纤维组分的变化
注:不同大写字母表示相同处理组不同时间差异显著(<0.05);不同小写字母表示相同时间不同处理组差异显著(<0.05)。*<0.05,影响显著;**<0.01,影响高度显著;***<0.001,影响极显著。下同。
Note: Different capital letters indicated significant difference between the same treatments at different time (<0.05); Different lowercase letters indicate significant difference between different treatments at the same time (<0.05). *<0.05, significant effects; **<0.01,very significant effects; ***<0.001, extremely significant effects. The same below.
2.3 青贮预处理过程的发酵品质变化
2.3.1 pH值
pH 值是衡量青贮发酵质量优劣的重要指标,pH值介于3.8~4.2范围说明发酵品质相对较好。从图3可知,由于青贮初期原料表面附着的乳酸菌等有益微生物利用WSC组分大量繁殖并代谢产生乳酸(pKa=3.86)和乙酸(pKa= 4.75)等有机酸[33],使得4个试验组在7 d时的pH值均快速下降至4.2以下(3.83~4.15)。尤其乳酸对pH值的影响强度是乙酸的12倍,是pH值下降的主要驱动因素[33]。青贮7 d时,L组和LE组的pH值明显低于CK组和E组(<0.05),说明植物乳杆菌添加后强化了青贮体系中的乳酸发酵,使青贮pH值低于其它试验组,这一点与表2中乳酸含量变化趋势相一致。青贮14和21 d时,尽管L组和LE组的pH值均高于CK对照组,但仍低于优良青贮范围(<4.2)。这可能是因为青贮体系中的肠杆菌等微生物菌群能将乳酸代谢转化为乙酸;而且LE组在21 d时有较高含量的氨氮物质(图4),对体系pH值下降也有一定的缓冲能力,这些因素都可能是造成其较高pH值的原因[34]。

图3 青贮预处理过程中的pH值变化
2.3.2 氨态氮含量
氨态氮含量反映了青贮过程中蛋白质和氨基酸的分解程度,氨态氮含量越高说明分解越多,意味着发酵品质变差,当超出阈值7%时即认为腐败变质[35]。由图4可知,青贮甜高粱渣中的氨氮含量均显著高于原料(<0.05),且CK组、L组和E组随时间延长呈现先升高后下降趋势,在14 d时达到最高值;LE组则总体呈现增加趋势,在21 d时达到最高。所有试验组的氨态氮含量均低于腐败变质的阈值7%,说明本试验中甜高粱渣青贮过程中的蛋白质分解程度较低,青贮品质良好。这可能是因为青贮发酵进程使体系pH值快速下降,有效抑制了植物蛋白酶或有害微生物活性所致[9,33]。青贮21 d时,L组和E组的AN含量显著低于CK组(<0.05),说明纤维复合酶和植物乳杆菌的添加有助于减少蛋白分解。同时,E组的氨态氮含量在整个青贮期间均显著低于CK组(<0.05),L组在14和21 d时也显著低于CK组(<0.05)。说明青贮过程中加入纤维素酶或植物乳杆菌能不同程度地促进青贮乳酸发酵,强化对梭状芽孢杆菌等腐败菌和植物蛋白酶活性的抑制作用,进而减少蛋白质的分解[36]。
2.3.3 青贮微生物菌群的代谢产物
小分子有机酸是青贮微生物菌群的主要代谢产物。由表2可知,发酵时间、添加剂及其交互作用对青贮发酵产物的构成及其含量均有极显著影响(<0.001)。具体地,4个试验组LA含量均显著高于原料(<0.05),且随着青贮周期延长总体呈现先升高后下降趋势,其中L组和LE组在7 d时达到最高值,CK组和E组在14 d达到最高值。说明青贮预处理过程中的微生物菌群代谢产生了一定量的乳酸[5],而且加入植物乳杆菌作为添加剂更有助于乳酸菌群的快速繁殖和乳酸生成,进而促进乳酸含量快速累积[28]。另一方面,3个添加剂组的LA含量在整个青贮过程中均显著高于CK组(<0.05),这与XU等[37]研究结果一致。说明不仅植物乳杆菌能有效促进乳酸积累,添加纤维复合酶也有同样效果,因为甜高粱渣在纤维复合酶的作用下,纤维素和半纤维素等结构性碳水化合物组分会发生一定程度地降解,从而释放更多可溶性糖,为青贮过程中的乳酸菌发酵提供了充足底物,促进了乳酸菌群代谢[6]。

图4 青贮预处理过程中氨态氮含量动态变化

表2 青贮预处理过程中有机酸含量的变化
注:有机酸为乳酸、乙酸和丙酸之和。
ote: Total organic acids are the sum of lactic acid, acetic acid and propionic acid.
乙酸是青贮过程中常见的有机酸,是一种良好的酸化剂和防腐剂,可以有效抑制霉菌和酵母菌生长,提高有氧稳定性。优质青贮的乙酸含量(DM)一般为1~3%[33]。由表2可知,CK组和E组的乙酸含量随时间延长呈现先升高后下降的趋势,二者均在14 d达到最高值;L组和LE组的乙酸含量则随时间延长呈现显著增加趋势,且L组在整个青贮期间始终高于CK组(<0.05)。青贮7 d时体系中的乙酸含量迅速增加,原因可能是明串珠菌、魏斯氏菌等异型乳酸发酵菌的相对丰度显著增加,代谢产生乙酸所致[38],这与图9结果相吻合。青贮21 d时,L组和LE组在青贮后期的高乙酸含量可能与厌氧环境中肠杆菌群将体系中的WSC和LA转化为乙酸、丙酸等物质有关[34]。丙酸也是一种短链脂肪酸,有助于提高青贮有氧稳定性。试验中的丙酸含量均很低,最高含量仅为0.54 g/kg DM,处于良好青贮范围(<0.1%DM)[33]。整个青贮过程中均未检测出丁酸,说明没有梭状芽孢杆菌等典型的丁酸腐败菌[14]。
乳酸、乙酸等有机酸的联动变化使4个试验组的乳酸/乙酸(LA/AA)和乳酸/总有机酸(LA/TOA)比值均显著高于原料(<0.05),且呈现先升高后下降的趋势,并在7 d时均达到最高值。研究表明,LA/AA比值反映了青贮过程的乳酸发酵模式,LA/AA比值高于2.0一般被认为是同型乳酸发酵[39]。4个试验组在21 d青贮期间的LA/AA值始终大于2.0,LA/TOA值始终高于0.65,说明4个试验组均以同型乳酸发酵为主,具有良好的乳酸发酵强度,也达到了优良青贮范畴[40]。这与USMAN等[9]报道的甜高粱青贮中添加植物乳杆菌的作用效果一致。尤其E组的LA/AA和LA/TOA比值在21 d青贮期间始终明显高于其他试验组(<0.05),说明纤维复合酶的加入强化了青贮过程的乳酸发酵强度。FOSTER等[29]在高粱青贮中添加纤维复合酶(纤维素酶和木聚糖酶)也发现有类似效果。
2.3.4 青贮预处理过程中各指标参数的相关性分析
由图5可知,青贮7 d时,甜高粱渣中的WSC含量与CP含量呈显著正相关(<0.05),与ADL含量呈显著负相关(<0.05),相关系数分别为0.95、0.96。青贮pH值与ADF和CL含量呈显著负相关(<0.05),相关系数分别为0.99、0.98。青贮14 d时,甜高粱渣中的NDF含量与HC含量呈显著正相关(<0.05),CL含量与ADF含量呈显著正相关(<0.05),相关系数分别为0.88、0.99。青贮21 d时,甜高粱渣中的NDF含量和Hoc含量呈显著正相关(<0.05),相关系数为0.99,Hoc含量与ST、NDF呈显著正相关关系(<0.05)相关系数分别为0.98和0.99,与CP、ADL呈显著负相关关系,相关系数分别为0.96和0.97。在青贮前期,原料附着乳酸菌利用丰富的WSC作为代谢底物,大量繁殖并产生LA等有机酸,降低青贮pH值,抑制了植物蛋白酶和梭菌等蛋白分解菌,有效保存了CP组分(图2 a)。随着青贮发酵的正向发展,青贮过程蕴藏的生化预处理作用进一步促进了木质纤维组分的优化重组,这些变化将对甜高粱渣的降解性能起到积极促进作用[12,41]。

图5 青贮预处理过程中各指标之间的相关性分析
2.3.5 基于隶属函数法的青贮质量综合评价
利用隶属函数法对甜高粱渣的青贮质量进行综合评价,其中DM、CP、LA、ST、NDF为正向指标,pH值、ADF和AN含量为负向指标,综合评价值越高说明质量越好。由图6可知,青贮21 d时E组的平均隶属值为0.78,其次是CK组(0.62)、L组(0.56)和LE组(0.39);在7和14 d时E组的平均隶属函数值也相对较高。综合判定,青贮过程中单独添加纤维复合酶有利于提高甜高粱渣的青贮质量。
2.4 青贮预处理过程中的细菌菌群多样性分析
2.4.1 Alpha 多样性指数
青贮过程中的细菌菌群变化与发酵产物的生成以及有机组分变化息息相关,特别是优势细菌种群将直接影响青贮品质。覆盖率数值反映样本检测质量,数值越高说明样本中物种被测出的概率越高。试验中,所有青贮样本Reads范围60 909~76 467,覆盖率均大于0.99,说明测序结果能充分反映细菌菌群的真实情况。

注:综合价值为各正负隶属函数值和的平均值。
Chao1和ACE指数表示群落物种的丰富度,其值随着群落物种丰富度的升高而增大;Shannon指数表示群落物种的多样性,其值随着菌群多样性的上升而增加[14]。由图7可知,在青贮7 和14 d时,CK组和E组的Chao1和ACE指数与CK组相比无显著性差异(>0.05);青贮21 d时,3个添加剂组均显著低于CK组(<0.05)。就Shannon指数而言,随着青贮周期的延长CK组呈现持续上升趋势,L组和CK组则呈现先上升后下降趋势,LE组呈现“上升-下降-上升”趋势。可见,3个添加剂青贮组中的细菌菌群丰富度和多样性均显著下降,说明添加剂能有效调控青贮发酵体系中的细菌菌群丰富度,通过有益乳酸菌群的发酵繁殖降低pH值,抑制梭状芽胞杆菌等不良微生物繁殖,降低细菌多样性,对获得良好青贮品质起到重要作用。PUNTILLO等[42]发现在高粱青贮过程中加入包含植物乳杆菌的复合乳酸菌剂能显著降低细菌种群的丰富度和多样性。DONG等[12]在甜高粱渣青贮过程中也发现有类似结果。
总之,相较于CK组而言,添加植物乳杆菌、纤维复合酶或二者联合添加均能有效降低青贮体系中的细菌菌群丰富度和多样性。

a. ACE 指数 a. ACE indexb. Chao1指数 b. Chao1 indexc. Shannon 指数 c. Shannon index
2.4.2 主坐标分析
PCA分析是一种探索和可视化细菌菌群异同性的方法,2个样本点之间的距离越近,说明细菌菌群结构相似度越高[28]。由图 8所示,新鲜甜高粱渣样品与青贮样品之间分离明显,这与ZHANG等[5]报道的青贮高粱秆的细菌聚类与原料显著分离结果一致。另一方面,随着青贮时间的变化,不同添加剂对细菌菌群构成的影响也存在差异。其中,不同青贮时期的CK组样品聚集较为明显,L组(14和21 d)和LE组(7和14 d)的青贮样品也存在明显聚集,E组的青贮样品则较为分散。青贮21 d时E组和LE组样品的细菌菌群与CK组相近。
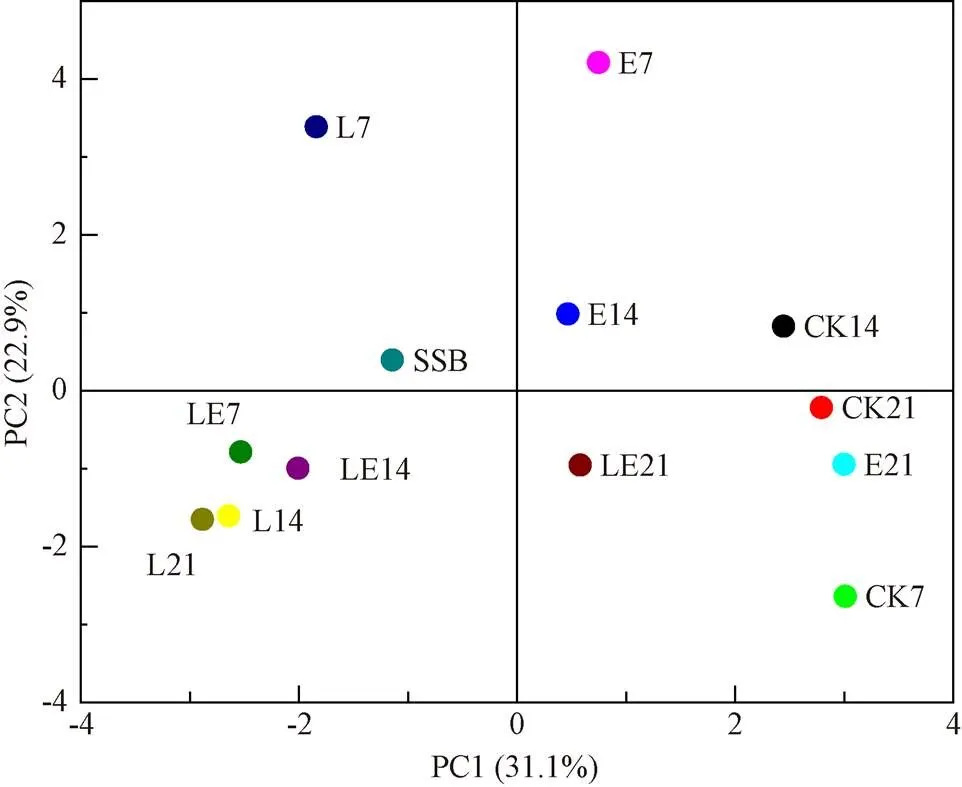
注:SSB为甜高粱渣。
2.4.3 门分类水平细菌群落组成
由图9a可知,甜高粱渣原料表面附着的门水平优势细菌主要是变形菌(Proteobacteria,90.87%)和少量厚壁菌(Firmicutes,4.48%)、拟杆菌(Bacteroidetes,1.55%)、蓝细菌(Cyanobacteria,0.89%)。青贮发酵后,4个试验组的细菌群落仍以变形菌为主,但厚壁菌相对丰度有明显提升,说明在厌氧酸性青贮环境中厚壁菌能快速适应并生长繁殖[5]。其中,L组的厚壁菌相对丰度随时间延长呈现先上升后下降趋势,E组和LE组则呈现上升趋势并维持较高水平。说明添加纤维复合酶能形成有利于维持厚壁菌生长代谢的微生态环境[28]。
2.4.4 属分类水平细菌群落组成
如图9b所示,甜高粱渣原料表面附着的属水平细菌主要有泛菌(,48.72%)、肠杆菌(,37.65%)和少量拉恩氏菌(,3.34%)、葡糖杆菌(,1.44%)、明串珠菌(,1.24%)、乳杆菌(,1.18%)等。DONG等[12]也报道发现甜高粱渣原料中的优势菌群为泛菌(39%)。青贮21 d时,4个试验组的乳酸细菌(以明串珠菌为主)总丰度从原料的2.86%分别升至13.28%(CK组)、11.58%(L组)、12.54%(E组)和13.56%(LE组),但仍未占据主导优势。这可能是因为原料表面自身附着的乳酸细菌较少,且青贮时间相对较短,乳酸菌群尚未能充分生长繁殖。与此同时,4个青贮组在21 d时的泛菌相对丰度分别降至22.14%(CK组)、21.61%(L组)、19.14%(E组)和24.1%(LE组),这与DONG等[12]的研究结果类似。OGUNADE等[43]认为泛菌能抑制梭状芽孢杆菌生长,进而降低青贮中的氨氮含量,这也可能是4个试验组中氨氮含量维持在良好阈值范围的原因之一。

图9 青贮预处理过程中的门水平和属水平的细菌菌群多样性
就肠杆菌群而言,CK组在青贮21 d时的相对丰度降至36.26%,3个添加剂组则分别升至60.64%(L组)、46.18%(E组)和44.24%(LE组)。DONG等[12]也发现青贮甜高粱渣的肠杆菌相对丰度由原料中不足5%增至20%以上。研究表明,肠杆菌群可以在厌氧和弱酸性环境中生长繁殖,并与乳酸细菌竞争发酵底物,将乳酸和WSC转化为乙酸、琥珀酸、乙醇或2,3-丁二醇,导致营养物质的损失[34]。相较于CK组,3个添加剂组中的肠杆菌相对丰度均显著升高,其原因可能是在植物乳杆菌和纤维复合酶的作用下,体系内可利用的WSC含量升高,进而促进了肠杆菌的生长繁殖,使其相对丰度提高。但由于肠杆菌也能代谢产生一定量的有机酸,故尚未对青贮发酵品质形成不良影响。
2.5 添加剂对甜高粱渣青贮预处理作用的强化效果
由图10可知,4个青贮组的甜高粱渣还原糖得率均显著高于原料(<0.05),酶解糖化72 h的还原糖得率分别比原料提高了116%(CK组)、77%(L组)、117%(E组)和107%(LE组)。其中E组的青贮预处理效果最好,还原糖得率高达888.56 mg/g,明显高于MISHRA等[44]报道的使用多种真菌混合预处理甜高粱渣后的还原糖得率750 mg/g,也高于CAO等[45]使用20%的NaOH溶液预处理甜高粱渣后的还原糖得率696.1 mg/g。说明青贮发酵能有效强化甜高粱渣的生物降解效果,这可能是因为青贮过程的酸性环境和有机酸组分能打破木质素和半纤维素的屏障作用,增加纤维素对水解酶的可及面积,进而释放出较多的可发酵糖[6]。青贮过程中微生物菌群的协同作用也是促进木质纤维组分降解的原因之一。另一方面,添加纤维复合酶有助于解聚原先紧密的木质纤维抗降解屏障结构,促进纤维素和半纤维素分解,进而提高纤维素可及面积和降解机率,使其更容易在糖化过程中被生物酶作用分解,强化青贮过程中的预处理作用,提高甜高粱渣的生物降解性能[46]。
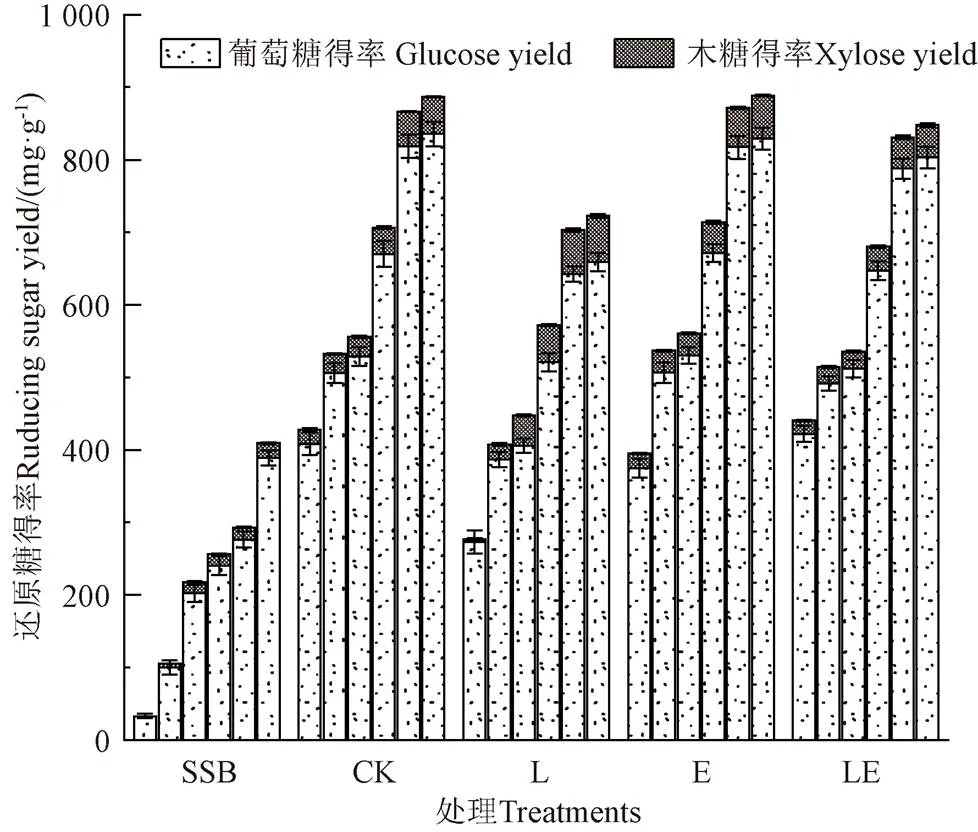
注:CK、L、E和LE为青贮21 d样品。各组从左至右酶解时间分别为12、24、36、48、60和72 h。
2.6 不同添加剂强化青贮预处理的经济效益分析
由表3可知,甜高粱渣经过青贮预处理后获得还原糖的综合理论经济收益远高于原料(SSB组212元/t),说明青贮预处理能有效提高甜高粱渣的利用效率,创造更高的经济收益。而且,不同预处理方式的纯收益差异也较为明显,由高到低顺序依次为E组836元/t、CK组818元/t、LE组686元/t和L组575元/t。其中,采用纤维复合酶进行强化青贮预处理的还原糖收益最高。结合图10中的酶解糖化降解效果分析,建议实际生产中选择添加纤维复合酶进行青贮预处理,该方法具有成本收益和技术高效的双重优势。

表3 青贮预处理前后的经济收益分析
注:计算基准为1 t甜高粱渣原料,还原糖售价参考99%纯度葡萄糖(4 520元/t),总收益=还原糖质量×还原糖售价,单位糖化成本为1 300元/t,糖化成本=干基质量×单位糖化成本,总成本=原料成本+青贮成本+糖化成本,纯收益=总收益-总成本[20]。
Note: The calculation basis was 1 t of sweet sorghum bagasse. The selling price of reducing sugar was based on 99% pure glucose (4 520 Yuan·t-1). Gross income = reducing sugar mass×reducing sugar price. Unit saccharification cost is 1 300 Yuan·t-1. Saccharification cost = dry base mass × unit saccharification cost. Total cost = SSB cost +ensiling cost+ saccharification cost. Net income= gross income-total cost.
3 结 论
1)单独或复合添加植物乳杆菌、纤维复合酶,不仅能有效促进青贮预处理过程的乳酸发酵,提高乳酸和乙酸含量,使青贮pH值降至4.2以下,乳酸/乙酸比值>2.0,乳酸占/总有机酸>0.65,而且有助于保存粗蛋白、可溶性碳水化合物等能量组分,优化重组木质纤维组分,瓦解生物降解结构屏障,起到一定的青贮预处理作用。
2)青贮21 d时,3个添加剂青贮组的ACE指数、Chao1指数和Shannon数值均显著低于CK组(<0.05)。说明加入添加剂有利于降低细菌群落丰富度和多样性,优化青贮微生物菌群结构,进而调控青贮发酵品质和预处理效果。
3)甜高粱渣经过21 d的青贮预处理作用后,酶解糖化的还原糖得率明显高于未青贮原料,且3种添加剂的青贮预处理作用都得到不同程度地强化。尤其添加纤维复合酶的青贮甜高粱渣的糖化得率高达888.56 mg/g,青贮预处理作用的强化效果最佳。
4)添加纤维复合酶能明显降低甜高粱渣青贮预处理过程中的干物质损耗,强化生物酶解糖化效果。每吨甜高粱渣的可发酵糖纯收益与未青贮原料相比有所提高,也远高于其他预处理添加剂。
综合青贮发酵质量、酶解糖化结果和成本收益等分析结果,推荐选择纤维复合酶作为甜高粱渣青贮预处理过程的强化剂,这种通过添加剂来强化青贮预处理的策略可以应用于甜高粱渣的能源化利用工程实际中。
[1] ANTONOPOULOU G, GAVALA H N, SKIADAS I V, et al. Biofuels generation from sweet sorghum: Fermentative hydrogen production and anaerobic digestion of the remaining biomass[J]. Bioresource Technology, 2008, 99(1): 110-119.
[2] WANG L, OU M S, NIEVES I, et al. Fermentation of sweet sorghum derived sugars to butyric acid at high titer and productivity by a moderate thermophile Clostridium thermobutyricum at 50 degrees C[J]. Bioresource Technology, 2015, 198: 533-539.
[3] TINÔCO D, GENIER H L A, da SILVEIRA W B. Technology valuation of cellulosic ethanol production by Kluyveromyces marxianus CCT 7735 from sweet sorghum bagasse at elevated temperatures[J]. Renewable Energy, 2021, 173: 188-196.
[4] VIDYA B, REDDY Y R, RAO D S, et al. Effect of supplementation of concentrate to sweet sorghum bagasse with leaf residue silage on nutrient utilization and nitrogen balance in native sheep[J]. Indian Journal of Animal Research, 2016, 50(3): 387-391.
[5] ZHANG Y, TAO X, LIU Q, et al. Succession changes of fermentation parameters, nutrient components and bacterial community of sorghum stalk silage[J]. Frontiers in Microbiology, 2022, 13: 982489.
[6] LI F, DING Z, KE W, et al. Ferulic acid esterase-producing lactic acid bacteria and cellulase pretreatments of corn stalk silage at two different temperatures: Ensiling characteristics, carbohydrates composition and enzymatic saccharification[J]. Bioresource Technology, 2019, 282: 211-221.
[7] XING L, CHEN L J, HAN L J. The effect of an inoculant and enzymes on fermentation and nutritive value of sorghum straw silages[J]. Bioresource Technology, 2009, 100(1): 488-491.
[8] VERVAEREN H, HOSTYN K, GHEKIERE G, et al. Biological ensilage additives as pretreatment for maize to increase the biogas production[J]. Renewable Energy, 2010, 35(9): 2089-2093.
[9] USMAN S, LI F, AN D, et al. Lignocellulose degradation and wnzymatic hydrolysis of soybean incorporated sorghum silage inoculated with feruloyl-esterase producing[J]. Fermentation, 2022, 8(2): 70-85.
[10] WRIGHT M S, LIMA I M, POWELL R, et al. Effect of compacting and ensiling on stabilization of sweet sorghum bagasse[J]. Sugar Tech, 2018, 20(3): 357-363.
[11] WILK M, KRÓL B, SŁUPCZYŃSKA M, et al. Effect ofon the nutritive value of Sucrosorgo 506 bagasse silage[J]. Journal of Animal and Feed Sciences, 2020, 29(2): 158-166.
[12] DONG M, LI Q, XU F, et al. Effects of microbial inoculants on the fermentation characteristics and microbial communities of sweet sorghum bagasse silage[J]. Scientific Reports, 2020, 10(1): 837.
[13] ZEGADA-LIZARAZU W, MONTI A. An integrated approach to harvest and storage of sweet sorghum at farm scale[J]. Bioenergy Research, 2014, 8(1): 450-458.
[14] 任海伟,王莉,朱朝华,等. 白酒糟与菊芋渣混合青贮发酵品质及微生物菌群多样性[J]. 农业工程学报,2020,36(15):235-244. REN Haiwei, WANG Li, ZHU Chaohua, et al. Ensiling co-fermentation quality and microbial community diversity of grain stiller and inulin processing residue from Helianthus tuberosus[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(15): 235-244. (in Chinese with English abstract)
[15] CHEN L, QU H, BAI S, et al. Effect of wet sea buckthorn pomace utilized as an additive on silage fermentation profile and bacterial community composition of alfalfa[J]. Bioresource Technology, 2020, 314: 123773.
[16] REN H, SUN W, YAN Z, et al. Bioaugmentation of sweet sorghum ensiling with rumen fluid: Fermentation characteristics, chemical composition, microbial community, and enzymatic digestibility of silages[J]. Journal of Cleaner Production, 2021, 294: 126308.
[17] 苗芳,张凡凡,唐开婷,等. 同/异质型乳酸菌添加对全株玉米青贮发酵特性、营养品质及有氧稳定性的影响[J]. 草业学报,2017,26(9):167-175. MIAO Fang, ZHANG Fanfan, TANG Kaiting, et al. Effects of homo-and hetero-fermentative lactic acid bacteria on the fermentation characteristics, nutritional quality, and aerobic stability of whole corn silage[J]. Acta Prataculturae Sinica, 2017, 26(9): 167-175. (in Chinese with English abstract)
[18] 杨洁,杨雪琦,韩鲁佳. 不同NaOH/球磨复合预处理对玉米秸秆酶解效果的影响[J]. 农业工程学报,2022,38(15):226-233. YANG Jie, YANG Xueqi, HAN Lujia. Effects of different NaOH/ball milling combined pretreatments on the enzymatic hydrolysis of corn stalks[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(15): 226-233. (in Chinese with English abstract)
[19] 张秧,艾为党,冯海艳,等. 小麦秸杆好氧堆肥过程中微生物多样性与优势菌群分析[J]. 农业工程学报,2021,37(11):206-212. ZHANG Yang, AI Weidang, FENG Haiyan, et al. Microbial diversity and dominant microbial communities in wheat straw aerobic composting[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(11): 206-212. (in Chinese with English abstract)
[20] REIS C E R, LIBARDI J N, BENTO H B S, et al. Process strategies to reduce cellulase enzyme loading for renewable sugar production in biorefineries[J]. Chemical Engineering Journal, 2023, 451(2): 138690.
[21] 刘晶晶,高丽娟,师建芳,等. 乳酸菌复合系和植物乳杆菌提高柳枝稷青贮效果[J]. 农业工程学报,2015,31(9):295-302. LIU Jingjing, GAO Lijuan, SHI Jianfang, et al. Lactic acid bacteria community andimproving silaging effect of switchgrass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(9): 295-302. (in Chinese with English abstract)
[22] 阴法庭,张凤华. 饲料油菜与玉米秸秆混合青贮营养品质[J]. 草业科学,2018,35(7):1790-1796. YIN Fating, ZHANG Fenghua. Nutritional quality of made with different ratios of forage rape and corn stalk[J]. Pratacultural Science, 2018, 35(7): 1790-1796. (in Chinese with English abstract)
[23] 寇江涛,程钰,张海波,等. 不同酶制剂对水稻秸秆和白酒糟混合青贮品质的影响[J]. 草地学报,2021,29(2):396-401. KOU Jiangtao, CHENG Yu, ZHANG Haibo, et al. Effects of enzyme on mixed silage quality of rice straw and distiller's grains[J]. Acta Grassland Sinica, 2021, 29(2): 396-401. (in Chinese with English abstract)
[24] 申瑞瑞,孙晓玉,刘博,等. 不同复合微生物制剂对薯渣与大豆秸秆混贮发酵品质、营养成分及瘤胃降解率的影响[J]. 动物营养学报,2019,31(7):3319-3329. SHEN Ruirui, SUN Xiaoyu, LIU Bo, et al. Effects of different compound microorganism preparations on fermentation quality, nutritional components and rumen degradation rate of mixed silage of potatopulp and soybean straw[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3319-3329. (in Chinese with English abstract)
[25] Spoelstra S F. Nitrate in silage[J]. Grass and Forage Science, 1985, 40(1): 1-11.
[26] CAI Y, SUYANANDANA P, SAMAN P, et al. Classification and characterization of lactic acid bacteria isolated from the intestines of common carp and freshwater prawns[J]. The Journal of General and Applied Microbiology, 1999, 45(4): 177-184.
[27] YANG H Y, WANG X F, LIU J B, et al. Effects of water-soluble carbohydrate content on silage fermentation of wheat straw[J]. Journal of Bioscience and Bioengineering, 2006, 101(3): 232-237.
[28] FANG D, DONG Z, WANG D, et al. Evaluating the fermentation quality and bacterial community of high-moisture whole-plant quinoa silage ensiled with different additives[J]. Journal of Applied Microbiology, 2022, 132(5): 3578-3589.
[29] FOSTER J L, THOMAS‐MOEN M E, MCCUISTION K C, et al. Potential of ensiling sorghum without grain pretreated with enzymes or bacterial inoculants[J]. Crop Science, 2019, 59(5): 2258-2263.
[30] STOKES M R. Effects of an enzyme mixture, an inoculant, and their interaction on silage fermentation and dairy production[J]. Journal of Dairy Science, 1992, 75(3): 764-773.
[31] 毛翠,刘方圆,宋恩亮,等. 不同乳酸菌添加量和发酵时间对全株玉米青贮营养价值及发酵品质的影响[J]. 草业学报,2020,29(10):172-181. MAO Cui, LIU Fangyuan, SONG Enliang, et al. Effects of lactic acid bacteria inoculant level and ensiling time on nutritional value and fermentation quality of whole-crop maize silage[J]. Acta Pratacultural Science, 2020, 29(10): 172-181. (in Chinese with English abstract)
[32] GUO G, YUAN X, LI L, et al. Effects of fibrolytic enzymes, molasses and lactic acid bacteria on fermentation quality of mixed silage of corn and hulless-barely straw in the Tibetan Plateau[J]. Grassland Science, 2014, 60(4): 240-246.
[33] KUNG L J, SHAVER R D, GRANT R J, et al. Silage review: Interpretation of chemical, microbial, and organoleptic components of silages[J]. Journal of Dairy Science, 2018, 101(5): 4020-4033.
[34] SUN L, JIANG Y, LING Q, et al. Effects of adding pre-fermented fluid prepared from red clover or lucerne on fermentation quality and in vitro digestibility of red clover and lucerne silages[J]. Agriculture, 2021, 11(5): 11050454.
[35] 王旭哲,张凡凡,马春晖,等. 压实度对玉米青贮开窖后营养品质及有氧稳定性的影响[J]. 农业工程学报,2018,34(6):300-306. WANG Xuzhe, ZHANG Fanfan, MA Chunhui, et al. Effect of compaction on nutritional quality and aerobic stability of silage corn after opening silos[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(6): 300-306. (in Chinese with English abstract)
[36] LI M, ZHOU H, ZI X, et al. Silage fermentation and ruminal degradation of stylo prepared with lactic acid bacteria and cellulase[J]. Animal Science Journal, 2017, 88(10): 1531-1537.
[37] XU D, DING Z, BAI J, et al. Evaluation of the effect of feruloyl esterase-producingand cellulase pretreatments on lignocellulosic degradation and cellulose conversion of co-ensiled corn stalk and potato pulp[J]. Bioresource Technology, 2020, 310: 123476.
[38] WANG S R, SHAO T, LI J F, et al. A survey of fermentation parameters, bacterial community compositions and their metabolic pathways during the ensiling of sorghum[J]. Journal of Applied Microbiology, 2022, 132(5): 3563-3577.
[39] KIM J G, HAM J S, LI Y W, et al. Development of a new lactic acid bacterial inoculant for fresh rice straw silage[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(7): 950-956.
[40] MCDONALD P, HENDERSON A R, HERON S J E. The Biochemistry of Silage (Second Edition)[M]. England: Chalcombe Publications, 1991.
[41] KHOTA W, PHOLSEN S, HIGGS D, et al. Fermentation quality and in vitro methane production of sorghum silage prepared with cellulase and lactic acid bacteria[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(11): 1568-1574.
[42] PUNTILLO M, PERALTA G H, BURGI M D M, et al. Metaprofiling of the bacterial community in sorghum silages inoculated with lactic acid bacteria[J]. Journal of Applied Microbiology, 2022. 133(4): 2375-2389.
[43] OGUNADE I M, JIANG Y, CERVANTES A A P, et al. Bacterial diversity and composition of alfalfa silage as analyzed by Illumina MiSeq sequencing: Effects of Escherichia coli O157: H7 and silage additives[J]. Journal of Dairy Science, 2018, 101(3): 2048-2059.
[44] MISHRA V, JANA A K, JANA M M, et al. Fungal pretreatment of sweet sorghum bagasse with supplements: improvement in lignin degradation, selectivity and enzymatic saccharification[J]. 3 Biotech, 2017, 7(2): 110.
[45] CAO W, SUN C, LIU R, et al. Comparison of the effects of five pretreatment methods on enhancing the enzymatic digestibility and ethanol production from sweet sorghum bagasse[J]. Bioresource Technology, 2012, 111: 215-221.
[46] BAJAJ P, MAHAJAN R. Cellulase and xylanase synergism in industrial biotechnology[J]. Applied of Microbiology and Biotechnology, 2019, 103(21/22): 8711-8724.
Improvement for the ensiling pretreatment effectiveness of sweet sorghum bagasse by fortified withand cellulolytic enzymes
REN Haiwei1,2,3, SHI Ruifeng1, WEI Huiyuan1, WANG Li1, GUO Xiaopeng1, LU Dong4, LIU Ruiyuan4, LI Jinping2,3※
(1.,,730050,;2.,,730050,;3.-,730050,; 4.,,730050,)
Sweet sorghum bagasse (SSB) is the resultant waste after extraction of sugar-rich juice from the stalks during bioethanol production. As a typical biomass, the SSB consists of moisture, unspent soluble sugar, and abundant lignocellulosic component (cellulose, hemicelluloses and lignin). Theundisposed SSB can inevitably cause the environmental pollution and resource waste. Hence, the effective storage of SSB is necessary for the year-round stable operation of biofuel plants. Among them, ensiling (wet storage) can be an efficient technology available for the SSB preservation and utilization, which enable the SSB to be processed all year around. Moreover, ensiling can also act as a pretreatment strategy, due to the benefits for the cell wall degradation and the improvement of biomass bioconversion for subsequent processing. In this study, the potential of ensiling pretreatment was investigated to fortify withinoculant and cellulolytic enzymes on the improvement of ensiling quality to modulate the performance of enzymatic saccharification of SSB. The SSB were ensiled with no additives (CK),(L), cellulolytic enzyme (E), and a combination of L and E (LE) for 21 days. The dynamic changes of nutrient composition, lignocellulosic components, and ensiling fermentation characteristics were investigated, and then dynamic evolution of the bacterial community structure was analyzed by high-throughput sequencing at HiSeq2500 platform. Ensiling quality was comprehensively evaluated by membership function method, in order to screen the suitable silages additives in consideration of enzymatic hydrolysis performance. The results showed that the addition ofinoculant and cellulolytic enzymes either alone or in combination was facilitated the lactic acid fermentation to reduce the fermentation losses, as evidenced by the higher content of crude protein, starch, neutral detergent fiber, acid detergent fiber, hemicellulose and cellulose components than that of un-ensiled SSB. The content of dry matter, crude protein and water-soluble carbohydrates in silages with additives were higher than those in the CK, but the content of holocellulose lower. Furthermore, the content of dry matter in the E silages, the content of crude protein in the L silages, and the content of water-soluble carbohydrates in the LE silages were the highest in all silages, respectively. The pH value of all silages significantly decreased to below 4.2, accompanied by the ratio of lactic Acid (LA) and total organic acids (TOA) higher than 0.65 and the ratio of lactic acid (LA) and acetic acid (AA) higher than 2 during the whole ensiling for 21 days. The content of LA and AA in the L silages were significantly higher than those of silages at the CK (<0.05), the ratio of LA/TOA and LA/AA in the E silages were significantly higher than those of silages at the CK(<0.05). The membership function analysis indicated that the silages at the E group shared the highest comprehensive scores at 21 days. The bacterial community structure showed that thewas the main bacteria in all silages during ensiling fermentation. At 21 days of ensilage,andwere the main species in the silages at genus level. ACE, Chao1 and Shannon index in the E, L and LE silages were significantly lower than those of CK group (<0.05). It infers that the ensiling pretreatment with the additives was effectively reduced the microbial richness and diversity. Principal Coordinate Analysis (PCA) was constructed using the relative abundance of bacteria at the genus level, indicating the outstanding separation in the SSB before and after ensiling pretreatment. After ensiling pretreatment, the yield of reducing sugar in all SSB silages significantly increased, compared with the un-ensiled SSB. Consequently, the reducing sugar yield in the E silages increased by 117%. The highest net income of E silages fortified with cellulolytic enzyme was almost three-fold that of un-ensiled SSB using cost-benefit analysis. In conclusion, the ensiling pretreatment fortified by cellulolytic enzymes can be expected to serve as a cost-effective, eco-friendly and tech-feasible strategy for the preservation and pretreatment of SSB biomass. Especially, cellulolytic enzyme can be used to modulate the ensiling pretreatment performance. Therefore, the ensiling quality and the biodegradation performance of SSB silage can be effectively improved for the bioenergy utilization of sweet sorghum bagasse.
ensiling; fermentation;; cellulolytic enzyme; sweet sorghum bagasse; microbial community; enzymatic saccharification
10.11975/j.issn.1002-6819.202211017
S21;S126.4
A
1002-6819(2023)-06-0224-13
任海伟,石瑞锋,魏慧元,等. 菌/酶添加对甜高粱渣青贮预处理作用的强化效果[J]. 农业工程学报,2023,39(6):224-236.doi:10.11975/j.issn.1002-6819.202211017 http://www.tcsae.org
REN Haiwei, SHI Ruifeng, WEI Huiyuan, et al. Improvement for the ensiling pretreatment effectiveness of sweet sorghum bagasse by fortified withand cellulolytic enzymes[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(6): 224-236. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202211017 http://www.tcsae.org
2022-11-02
2022-03-05
国家自然科学基金项目(5166010);甘肃省自然科学基金重点项目(21JR7RA203);中国博士后科学基金项目(2019T120961);兰州理工大学红柳杰出青年支持计划(JQ2020);兰州理工大学红柳一流交叉学科计划(0807J1)和甘肃省研究生“创新之星”项目(2023CXZX-500)资助
任海伟,教授,博士生导师,研究方向为生物质资源转化。Email:rhw52571119@163.com
李金平,教授,博士生导师,研究方向为先进可再生能源系统。Email:lijinpijng77@163.com
中国农业工程学会高级会员: 任海伟(E041200735S)
