何首乌提取物二苯乙烯苷对糖尿病肾病大鼠肾组织SUR2B亚型KATP通道干预作用的研究
2023-05-14苑天彤王宏杨
苑天彤,姜 雪,李 雪,王宏杨
(1黑龙江省中医医院南岗分院·黑龙江 哈尔滨 150001;2黑龙江中医药大学· 黑龙江 哈尔滨 150040)
中药何首乌主要药效成份以 2,3,5,4′-四羟基二苯乙烯-2-O-β-D 葡糖苷 (简称二苯乙烯苷,2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside,TSG)作为其定量指标[1-2]。研究显示TSG具有抗氧化作用,且不伴肝毒性[3-4]。本课题组的前期工作亦提示,TSG 通过干预DN大鼠肾组织 NO-ONOO-氧化途径,明显减少微量蛋白尿,减轻肾小管损伤,对肾脏早期损伤有保护作用[5-8]。本实验探讨了TSG 对中晚期 DN 大鼠肾脏保护作用及机制。
1 材料
1.1 实验动物 健康8周龄SPF级雄性Wistar大鼠40只,体质量(180±20)g,购自哈尔滨市松北区翔林养殖场,合格证号:SCXK(黑)2013-001,大鼠分笼饲养,每笼5只。自由进水、进食。适应性饲养1 周。
1.2 药品和试剂 二苯乙烯苷(TSG):中国科学院成都生物研究所研制,纯度:99.44%,产品批号:MUST-18051611。链脲佐菌素(STZ):Sigma公司,货号:S0130。血肌酐测量试剂盒:南京建成生物研究所。Rabbit Anti-VWF、聚合HRP标记抗兔IgG:武汉博士德生物有限公司。Trizol Reagent、PrimeScript RT reagent Kit with gDNA Erase、TB Green Premix Ex Taq II:TAKARA。
1.3 主要实验仪器 罗康全血糖仪:德国罗氏诊断技术有限公司;LD5-2A型低速离心机:北京京立离心机有限公司;325病理切片机:德国Zeiss公司;Boxun电热鼓风干燥箱:上海博讯医疗生物仪器有限公司;YT-6C生物组织摊考片机:MDF-382E-80℃冰箱:日本SANYO公司;CFX96Real-time PCR仪:Bio-Rad。
2 实验方法
2.1 动物造模与分组给药 雄性 Wistar 大鼠40 只,随机分为2 组:正常对照组10只,余 30 只高糖高脂饲料(普通饲料78.8%、胆固醇1%、牛胆盐0.2%、蛋黄粉10%、猪油10%)喂养 8 周, 30 mg/kg STZ 尾静脉注射(临用前用 0.1mol/L、 pH 4.4 已配制的枸橼酸缓冲液溶解,浓度 2%)。注射 STZ 72 h 后,大鼠尾静脉取血检测血糖,连续3 d非空腹血糖≥16.7 mmol/L 为 DM大鼠模型成功[9]。30只大鼠24只成模,随机分为DN 组12只、TSG组12只。TSG组大鼠每天腹腔注射浓度1%的TSG溶液(30 mg/kg溶于生理盐水)8周,正常组、模型组腹腔注射等量生理盐水。实验观察20周,正常组大鼠死亡1只,模型组、TSG组大鼠均死亡4只。
2.2 观察指标及检测
2.2.1 尿UALB/UCr、血SCr测定 实验20 周末,用代谢笼收集24 h 尿液,散色比浊发测定UALB、UCr,计算UALB/UCr。末次给药后禁食水12 h,用10%的水合氯醛腹腔注射麻醉,腹主动脉采血,离心,分离血清,生化分析仪检测GLU、SCr。
2.2.2 肾组织vWF表达的免疫组化检测 腹主动脉采血后处死大鼠,取肾组织放10%的甲醛固定液中用于免疫组化的检测;应用Image-pro plus6.0病理图像分析系统对阳性表达定量分析,每组每只大鼠肾脏组织标本随机抽取5个高倍镜下视野(×400),棕黄色颗粒为阳性表达,以光密度(IOD)代表蛋白的表达量。IOD=阳性的面积×平均的光密度,并取其均值作为该片子的相对表达量。
2.2.3 肾组织SUR2B/Kir6.1mRNA表达的Real-Time PCR测定 取肾脏组织加入1 mL Trizol 按试剂盒说明提取RNA。 cDNA的合成根据primeScriptTMRT Master Mix 要求操作。取1μLRNA溶液在PCR仪器上70 ℃温度下孵育5 min,静置在冰盒上冷却;在溶液中加逆转录反应体系并使其混合均匀,PCR仪上与37 ℃反应15 min,然后85 ℃反应10 s,迅速将其降温至4 ℃,将其逆转录为cDNA,-80 ℃冰箱中保存以备使用。qPCR:测量cDNA的浓度,将其定量为100 mg/L在1.5 mL的离心管中将其配置成n+1个混合体系。如下:取0.2 mL的PCR管,按照19μL将其每个分装,分别加入cDNA的模板1μL,瞬时进行离心后将其轻摇混匀,然后瞬时将其离心。将QPCR仪器设置好,开始PCR扩增(95 ℃,10 s;95℃,5 s,40 cycles;55 ℃,10 s,40 cycles;72 ℃,15 s,40 cycles;4 ℃,+∞)。引物序列见表1。以GAPDH为内参,整理并将数据导出。
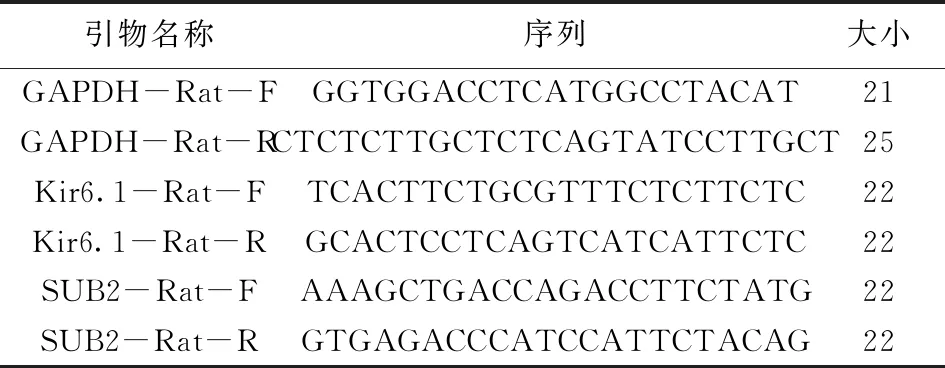
表1 PCR引物序列

3 实验结果
3.1 实验第20 周各组大鼠UALB/UCr、SCr比较 见表2。

表2 实验第20周各组大鼠UALB/UCr、SCr比较
3.2 实验第20 周各组大鼠肾组织vWF表达比较 见图1,表3。

图1 各组大鼠实验第20 周肾组织vWF表达的免疫组化测定(×400)
表3 实验第20周各组大鼠肾组织vWF表达比较
3.3 实验第20 周各组大鼠肾组织SUR2B/Kir6.1mRNA表达的RT-PCR检测结果 见表4。

表4 实验第20周各组大鼠肾组织SUR2B mRNA、Kri6.1 mRNA表达比较
4 讨论
众所周知高血糖导致的代谢紊乱、炎症反应、氧化应激等引起血管内皮细胞受损,内皮细胞合成的血管性血友病因子(von Willebrand Factor,vWF),在血管内皮细胞损伤时释放入血,主要介导血小板与血管内皮黏附,促进血栓形成,引起血流动力学异常,血流动力学异常是DN进展至终末期肾病的重要机制[10]。ATP敏感性钾离子通道(ATP-sensitive K+ channels,KATP)是由内向整流亚基(Kir)和调节性磺脲受体(sulfony urea receptor,SUR)组合而成的八聚体,SUR可感受细胞内ATP/ADP 浓度的变化,进而通过KATP通道开放或关闭,调整NO生成和释放,缓解血液动力学异常,改善血管内皮细胞功能紊乱。肾脏存在不同的KATP通道,且KATP通道在肾脏生理调节过程中,对维持钾离子的稳态和肾脏微血管张力起着重要作用[11]。在病理状态下,KATP结构和功能的改变与肾功能的改变密切相关[12-13]。本实验结果显示,与模型组相比,TSG 组肾组织vWF 表达减弱、SUR2B/Kir6.1mRNA表达量增加,提示TSG可能通过干预ATP敏感性钾离子通道SUR2B/Kir6.1亚型基因水平上的表达,改善血流动力学异常,保护肾脏血管内皮,延缓DN进程。
