甜瓜未授粉子房超低温保存方法初探
2023-05-13李海伦高宁宁李晓慧康利允常高正王慧颖徐小利赵卫星
李海伦,高宁宁,李晓慧,康利允,常高正,梁 慎,王慧颖,徐小利,赵卫星
(河南省农业科学院园艺研究所 郑州 450002)
甜瓜(Cucumis meloL.)是葫芦科甜瓜属一年生草本植物,具有丰富的营养价值和可观的经济价值,在全球范围内广泛种植。甜瓜产业在我国农业产业结构中占据重要地位,具有广阔的前景。目前,甜瓜优异种质资源更新滞后且无法满足市场需求,因此亟需加速育种工作的进度。单倍体培养是创制新种质的重要手段,利用甜瓜未授粉子房或胚珠离体培养获得单倍体,将有效加速甜瓜育种进程,其中,材料是培养成功的先决条件。同时甜瓜离体雌核培养获取单倍体技术还处于初级阶段,并未获得较成熟的技术,加快培养进度需大量的供试材料,而甜瓜未授粉子房的取材受生长季节的限制。为解决材料供应问题,笔者通过在甜瓜生长季节大量取样,并进行超低温保存,增加供材量和延长供样期,从而加速甜瓜单倍体的培育进程。
适宜的保存条件可以使细胞分裂和代谢暂时处于停滞状态从而延长生命周期,还可以最大程度保持材料的遗传稳定性。其中,超低温保存方法是将植物的细胞、组织、器官等离体材料存放于液氮(-196 ℃)中保存[1],该方法备受青睐,在花粉、茎尖、休眠芽、愈伤组织等离体组织中被广泛应用[2-6],但对甜瓜子房的保存鲜见报道。笔者的研究结合包埋法和玻璃化法对超低温保存方法进行改良,旨在探索最适合甜瓜子房的保存方法,最大限度减少材料损伤,并保持较高的活性,以期加速甜瓜单倍体育种的进度,为创制新种质提供技术支撑。
1 材料与方法
1.1 材料
供试厚皮甜瓜品种为晚熟品种众云18(网纹红肉)和早熟品种锦绣(白皮红肉),均由河南省农业科学院园艺研究所西瓜甜瓜课题室提供。
1.2 设计
众云18 和锦绣于2019 年5 月在河南现代农业开发研究基地连栋大棚种植,采用常规管理。每个材料种植20 株。在甜瓜花期,于开花前一天09:00—11:00 取长势健壮无损伤的未授粉子房,带回实验室4 ℃暗处理2 d。2 种材料的每一批取样的样本数量相同,每个处理各取30 个甜瓜子房,每个处理每个材料分别设置3 次重复。
1.3 方法
1.3.1 甜瓜子房消毒灭菌 把2 d 暗处理后的子房用流水冲洗0.5~1.0 h,去除子房表面茸毛,洗净后在超净工作台上用70%乙醇消毒30 s,再用无菌水清洗3 遍,接着用0.2%次氯酸钠灭菌10 min,最后用无菌水冲洗3~5 遍,备用。
1.3.2 改良超低温保存方法建立 (1)预处理:把子房分别进行纵切和横切,放入0.4 mol·L-1的蔗糖溶液中,置于培养间中暗培养8、24、48、72、96 h。(2)包埋:取出预培养的子房,晾干表面液体,用3%海藻酸钠将子房完全包裹,再用0.1 mol·L-1氯化钙固定10 min,取出晾干。(3)加载:把包裹的子房放入加载液(1/2 MS+136 g·L-1蔗糖+180 g·L-1甘油)中,处理20 min,取出晾干。(4)脱水:用PVS2 玻璃化液(MS+300 ml·L-1甘油+150 ml·L-1乙二醇+150 ml·L-1二甲基亚砜+136 g·L-1蔗糖)给予30、60、90 min 处理,取出晾干。(5)低温保存:用无菌铝箔纸把处理过的子房包裹好迅速放入液氮(-196 ℃)中保存。
1.3.3 低温保存后恢复培养 (1)解冻:将保存0、20、40、60 d 的子房放入25、38、40、42 ℃恒温的卸载液(MS+410 g·L-1蔗糖)中解冻5 min,最后再用新卸载液清洗一遍,晾干。(2)接种:将解冻的子房接入诱导培养基中(MS+0.03 mg·L-1TDZ+0.2 mg·L-1KT+150 mL·L-1椰汁+30 g·L-1蔗糖+7 g·L-1琼脂)。(3)培养:接种后的子房在黑暗条件下,培养箱中34 ℃热激3 d,光照度1500~2000 lx、16 h/8 h 光暗周期的培养室中进行培养。(4)恢复培养后甜瓜子房存活率:子房存活率/%=接入子房成活数/接入子房的总数×100。
1.4 数据统计与分析
采用Excel 2016 工具进行数据统计、分析和制图,采用SPASS 21 软件进行One-way ANOVA 法单因素方差分析。
2 结果与分析
2.1 预培养时间对甜瓜子房存活率的影响
预培养可通过减少细胞内含水量和提高细胞分裂分化能力来改善材料的生理状态,提高材料的抗冻性。笔者通过高浓度蔗糖溶液进行预培养来提高超低温保存后材料的存活率。如图1 所示,子房预培养的时间不同,超低温保存后子房的存活率也存在差异。随着预培养时间的增加,子房的存活率呈先增高后降低的趋势。预培养8 h 时,冷冻20 d后子房的存活率只有55%左右;预培养24 h 时,众云18 和锦绣的子房存活率分别高达82.30%和82.80%;预培养48 h 时,子房存活率开始降到71%左右;预培养72 h 时,子房存活率持续降低到50%左右;预培养96 h 时,子房存活率低至45%左右。预培养的时间过长易导致细胞过度脱水而造成损伤,进而影响子房的存活率。在0.4 mol·L-1的蔗糖溶液中预培养24 h 和48 h 时子房存活率的差异不显著,但24 h 的预培养极大地缩短了培养时间,所以预培养24 h 效果最佳。
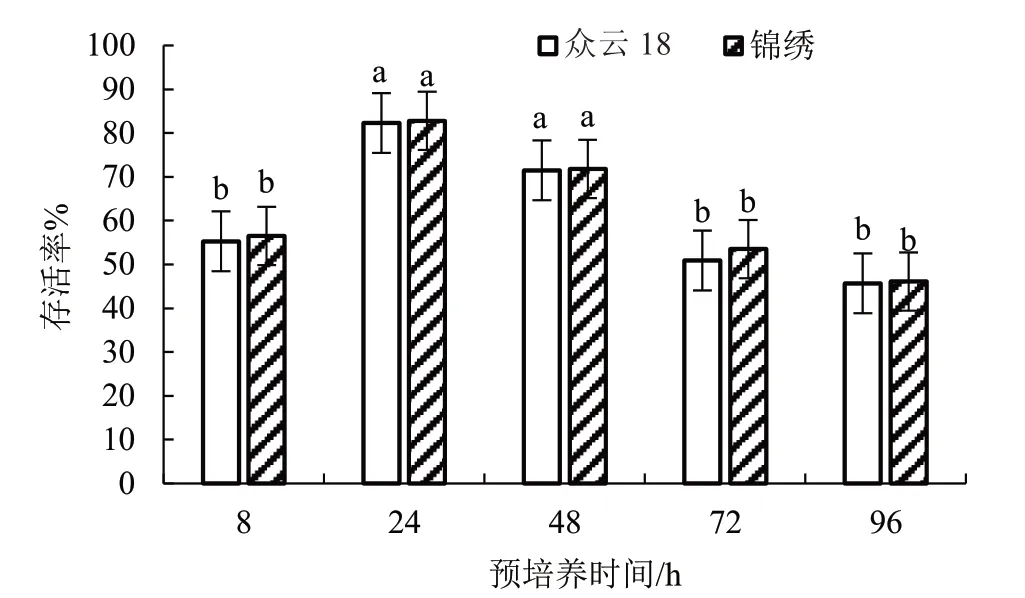
图1 预培养时间对低温保存子房存活率的影响
2.2 PVS2 玻璃化液处理时间对甜瓜子房存活率的影响
超低温保存的程序中玻璃化过程是最关键的环节,其中,玻璃化液处理时间也至关重要。由图2可知,随着PVS2 处理时间的增加,子房冻后的存活率逐渐降低。处理30 min 时存活率最高,2 个甜瓜品种的子房存活率均在82%以上。处理60 min时也均在81%左右,与处理30 min 时存活率无显著差异,但都显著高于处理90 min。随着PVS2 脱水处理时间的增加,PVS2 的毒害作用也逐渐增强,从而导致子房存活率下降。为避免PVS2 玻璃液的毒害作用加剧,以30 min 为最佳处理时间。
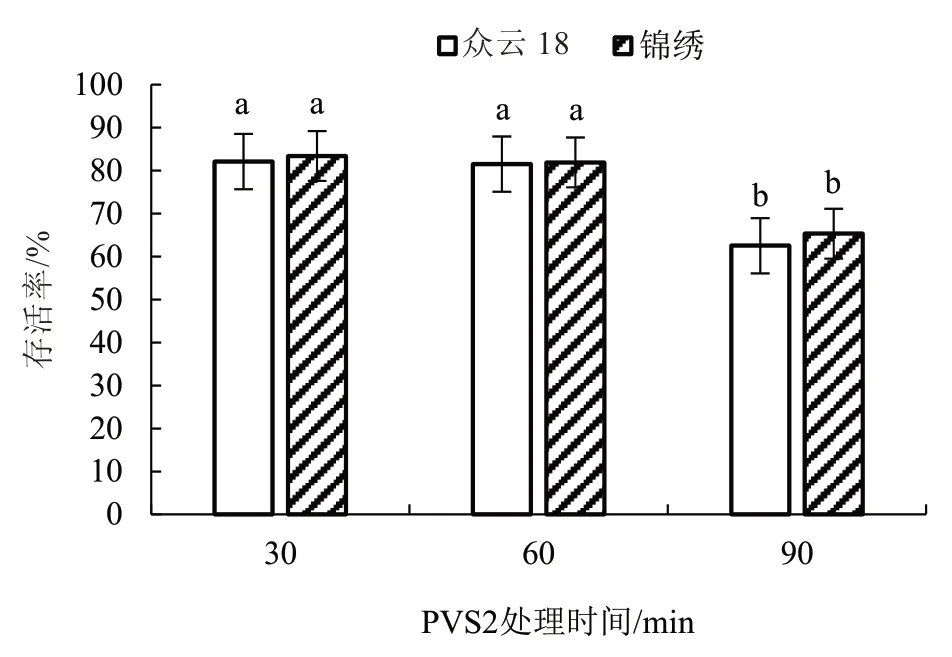
图2 PVS2 处理时间对低温保存子房的影响
2.3 解冻温度对甜瓜子房存活率的影响
解冻是材料恢复培养最关键的一步,迅速解冻可以避免细胞内再次出现结冰而造成细胞死亡。采用MS+410 g·L-1 蔗糖卸载液解冻,分析不同解冻温度对子房存活率的影响,由图3 可知,当解冻温度为25 ℃时,子房的存活率远低于50%,随着解冻温度的升高,子房的存活率也随之增高。解冻温度在38 ℃时,子房存活率最高,晚熟品种众云18 和早熟品种锦绣都在80%左右;解冻温度在40 ℃和42 ℃时,子房存活率略低于38 ℃,但无显著差异,以38 ℃为最佳解冻温度。
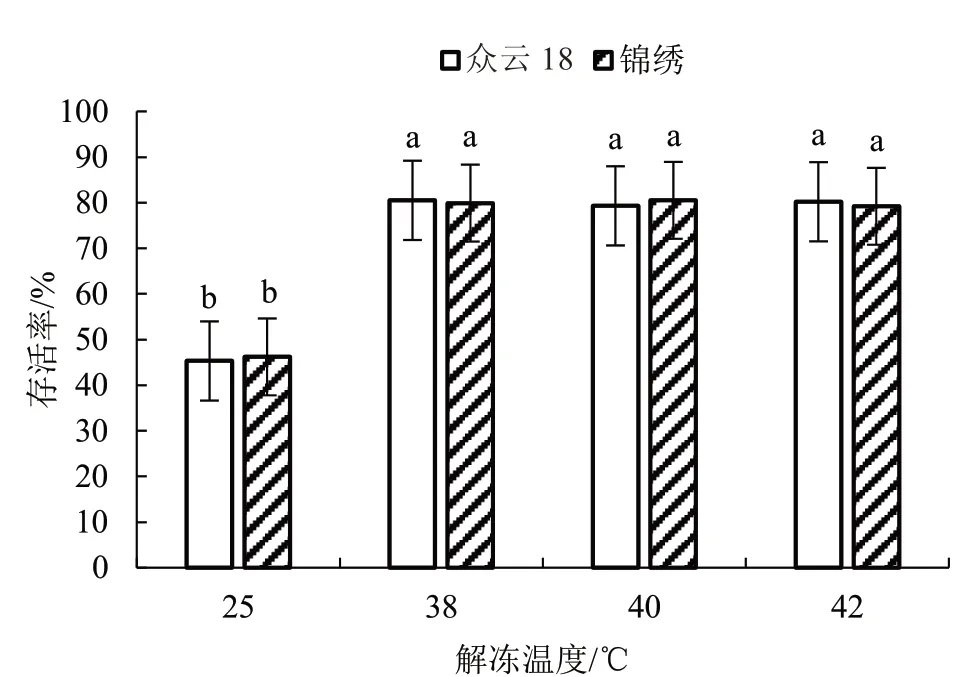
图3 解冻温度对低温保存子房的影响
2.4 超低温保存时长对甜瓜子房存活率的影响
理论上材料保存在液氮中保存时间的长短不会影响其存活率。采用改良的超低温保存方法把众云18 和锦绣未授粉子房预培养24 h,经过3%海藻酸钠包埋,0.1 mol·L-1氯化钙固定,加载液处理20 min,PVS2 脱水30 min,铝箔纸包裹迅速放入液氮中保存。为分析保存时长对材料存活率的影响,将保存了0、20、40、60 d 的子房在38 ℃的卸载液中处理5 min 进行解冻,再接入诱导培养基中培养,结果如表1 所示,0 d 时2 个甜瓜材料子房的存活率都在92%以上;随着保存时间的延长,子房的存活率也开始降低;保存20、40 d 和60 d 时存活率在80%~87%之间,子房存活率无显著差异,表明液氮保存时长对冻后子房的存活率无明显影响,且保存60 d 时子房的存活率仍在80%以上。
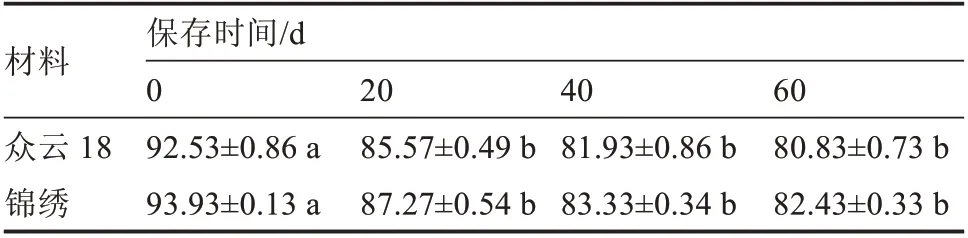
表1 低温保存不同时间未授粉子房的存活率%
3 讨论与结论
超低温保存法可以保持材料正常的细胞活性、全能性和遗传性,且操作简单、成本低,并能长期保存,适用于细胞、组织等离体材料的保存。笔者采用包埋法和玻璃化法结合的改良超低温保存法对甜瓜离体子房进行保存。经过4 ℃暗处理2 d 的子房,先用0.4 mol·L-1蔗糖溶液预培养24 h,再用3%海藻酸钠包埋并用0.1 mol·L-1氯化钙固定,经过加载液(1/2 MS+136 g·L-1蔗糖+180 g·L-1甘油)处理后,再用PVS2(MS+300 ml·L-1甘油+150 ml·L-1乙二醇+150 ml·L-1二甲基亚砜+136 g·L-1蔗糖)脱水,接着用铝箔纸包裹迅速放入液氮中保存,最后用卸载液(MS+1.2 mol·L-1蔗糖)解冻接入诱导培养基中进行恢复培养。笔者使用改良超低温保存法对甜瓜离体子房组织进行保存,可解决甜瓜未授粉子房离体培养材料受生长季节和生长期的影响而导致的供应不足的问题。
材料的选择对超低温保存后植物的存活率起决定性作用[7]。已报道的超低温保存的研究材料有胚性愈伤组织、原生质体、体细胞胚、小孢子、花粉、不定芽、腋芽、休眠芽、茎尖、种子、幼苗等[6,8-17],但还未发现对甜瓜子房保存研究的相关报道。甜瓜子房体积偏大,在超低温保存的程序中需要先通过预处理来减少细胞内含水量,避免其在PVS2 脱水过程中细胞脱水死亡而影响存活率。预培养、低温锻炼等[18-19]是常用的预处理方法。预处理的目的是改善材料的生理状态,使细胞内自由水含量减少以提高材料的抗冻性[20]。笔者采用0.4 mol·L-1的蔗糖保护液预培养24 h,众云18 和锦绣子房的存活率均在82%以上。白建明等[21]在马铃薯茎尖研究中用0.3 mol·L-1的蔗糖溶液,李泳[22]在罗汉果茎尖中用0.7 mol·L-1蔗糖溶液,均预培养24 h,获得最高的存活率。也有研究表明,高洁等[23]在红掌腋芽中用0.4 mol·L-1蔗糖溶液预培养96 h 效果最佳,说明不同种植物的预培养时间可能与其保存的组织部位以及预培养液的浓度有关。
玻璃化液处理是将细胞内的自由水从液态转变为玻璃化状态,避免细胞内形成冰晶来提高细胞的抗冻能力[24]。PVS2 是最常使用且效果最佳的玻璃化保护液。笔者采用PVS2 玻璃化液处理30 min,众云18 和锦绣子房存活率分别高达82.13%、83.40%,软枣猕猴桃茎尖用PVS2 处理40~60 min,而休眠芽需要120 min 效果最好[4,14];扁桃休眠芽则需要70 min[25];羽状鸡冠花幼苗需要处理60 min[17];越橘腋芽需要40 min[13];九里香种子处理30 min[26]。但也有研究表明,PVS2 处理反而降低存活率[27]。不同材料的组织部位PVS2 处理存在较大的差异,因此,需要筛选适合的PVS2 玻璃化液处理时间。晋玲等[28]认为PVS2 处理时间一般是在20~100 min。
解冻是超低温保存过程中防止材料受到损伤的关键,在解冻过程中若不能快速解冻材料,容易使细胞内再次结冰造成细胞死亡,所以要针对保存的材料选择适合的解冻方式。理论上一般采用37~40 ℃恒温解冻。梨茎尖在25 ℃水浴解冻效果好[29];白菜小孢子37 ℃恒温水浴40 s 解冻效果最佳[10];柿子休眠芽在40 ℃时快速解冻的效果较好[30];而密花石斛花粉在室温和37 ℃解冻无明显差异[27]。笔者的研究中甜瓜子房在卸载液中恒温38 ℃解冻5 min 效果最好。在解冻时为避免PVS2在材料细胞内的毒害作用,需要卸载液洗涤。笔者的试验使用的卸载液是MS+410 g·L-1蔗糖。有研究表明,在解冻时高浓度的蔗糖可防止水分的快速进入,降低冰晶对细胞的损伤。软枣猕猴桃休眠芽[14]和蓝果忍冬茎尖[31]在卸载液MS+1.2 mol·L-1蔗糖中处理30 min 达到最好效果,与笔者试验的卸载液配方相同,但笔者的研究缩短了解冻时间。九里香种子[26]只要40 ℃温水解冻2 min 就能达到理想效果,说明解冻方式以及解冻的温度和时间与物种及材料部位和大小密切相关。
材料在超低温保存的过程中生理活动处于近乎停止的状态,理论上可以长久保存。早在1997年对樱桃茎尖超低温保存1 d 和10 min 的研究结果发现,二者并没有表现出明显差异[32];芍药花粉超低温保存4 a 和美国山核桃花粉保存10 a 以上都还具有生活力[33-34];秦艽休眠芽在超低温保存1、14、28、46 d 存活率也没差异[35];软枣猕猴桃茎尖在液氮中保存时间长短并未对材料的存活力造成明显区别[4]。这些报道与笔者的研究结果一致,甜瓜子房在超低温保存20、40、60 d 后子房存活率并无显著差异,说明超低温保存时长对子房的存活率影响不明显。本试验结果表明,甜瓜子房在超低温保存60 d 后仍可维持较高的存活率,随着低温保存时间的延长,其存活率虽然开始降低,但保存时长之间的差异并不显著。
笔者首次尝试以子房作为保存材料进行研究,甜瓜子房通过预培养24 h,用海藻酸钠包埋,氯化钠固定,经加载液处理20 min,PVS2 脱水30 min,用铝箔纸包裹放入液氮中保存,之后卸载液在38 ℃恒温解冻5 min,接入诱导培养基中即可恢复培养。初步得到甜瓜子房超低温保存的条件,建立适合甜瓜子房超低温保存及恢复培养的体系。该技术有效地解决了甜瓜大孢子培养供体不足且无法长期持续供应的问题,为葫芦科作物大孢子超低温保存提供了可靠的技术参考。
