176例血管母细胞瘤的临床病理特征分析
2023-05-13刘雪咏蔡珊珊张声陈余朋曾赛凡王行富
刘雪咏, 蔡珊珊, 张声, 陈余朋, 曾赛凡, 王行富
血管母细胞瘤(hemangioblastoma)是一种少见的、生长缓慢的中枢神经系统肿瘤,好发于成人,通常发生在小脑、脊髓和脑干;肿瘤界限较清楚,常发生囊性变,在肿瘤组织学上以肿瘤间质细胞和丰富的小血管为特征,髓外造血成分罕见。血管母细胞瘤的世界卫生组织(World Health Organization,WHO)分级为1级,预后通常较好,常为散发或与Von Hippel-Lindau(VHL)综合征有关。肿瘤的组织来源至今仍有争议。本研究回顾性分析176 例血管母细胞瘤病例的临床资料,结合文献探讨其临床病理学特征和免疫组织化学染色特点。
1 对象与方法
1.1 对象 收集2006年6月—2021年7月在笔者医院手术切除且经病理确诊的血管母细胞瘤病例,复阅其临床资料和病理切片,选取176 例临床资料完整、病理诊断一致的病例,其中男性83 例,女性93 例,年龄中位数为45 岁(15~76岁)。经患者知情同意进行电话随访,获得完整的临床资料和随访资料。本研究经笔者医院伦理委员会批准(闽医大附一伦理医技审〔2015〕084-2号)。
1.2 方法 送检标本均经10%中性甲醛固定液固定,进行常规脱水、石蜡包埋,将其全部制成组织芯片,行免疫组织化学染色。采用链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法和二氨基联苯胺(diaminobenzine,DAB)显色。
1.3 检测指标 性别决定区域Y相关的高迁移率族框9(SRY-related high mobility group-box gene 9,SOX9,英国Abcom公司);D2-40、波形蛋白(Vimentin)、S100蛋白、CD117(丹麦Dako公司);CD10(瑞士Roche公司);SOX2(北京中杉公司)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、髓过氧化物酶(myeloperoxidase,MPO)、CD42b、Ki-67(北京中杉公司);a-抑制素(a-inhibin)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ,CA9)、CD56、细胞角蛋白(cytokeratin,CK)、ETS相关基因(ETS related gene,ERG)、E-钙黏附素(E-cadherin,E-CAD)(福州迈新公司)。SOX9、SOX2、S100、ERG、Ki-67呈细胞核阳性表达;D2-40、Vimentin、CD117、CD10、GFAP、MPO、CD42b、a-inhibin、NSE、CA9、CD56呈细胞质阳性表达;CK、E-CAD呈细胞膜阳性表达。
2 结 果
2.1 临床表现 176 例中,130 例位于小脑,19 例位于脑干,17 例位于脊髓,8 例位于幕上,2 例位于桥小脑区。22 例表现为多灶性。4 例伴有髓外造血,其中1 例伴有红细胞增多。6 例临床诊断为VHL综合征患者,分别伴发肾透明细胞癌和肾多发囊肿;肾上腺嗜铬细胞瘤及肾多发囊肿;肾透明细胞癌、脉络膜血管瘤及胰腺、肾多发囊肿;肾上腺嗜铬细胞瘤;胰腺、肾囊肿及眼球血管瘤;眼球血管瘤和胰腺、肾多发囊肿。1 例出现肿瘤—肿瘤转移(肾细胞癌转移至血管母细胞瘤)。血管母细胞瘤的临床症状无明显特异性,主要与肿瘤发生部位相关,位于小脑者多表现为头晕、头痛、呕吐和共济失调等症状;脊髓肿瘤因位置不同而表现为相应节段的感觉或运动障碍。
2.2 肉眼观察 肿物大小0.5~4.5 cm,多呈灰红色,部分呈灰黄色,质地较软,部分可见囊性变。
2.3 镜下表现 肿瘤无包膜,与周围组织界限清楚,呈非浸润性生长(图1A);周围的反应性组织,特别是囊肿壁周围,常见胶质细胞增生和Rosenthal纤维。肿瘤主要由两种特征性成分(图1B)构成:(1)间质细胞成分。最典型和最显著的形态特征是大且呈空泡状,但可显示相当大的细胞学变异,核大小不一,偶有非典型核和深染核,有丝分裂象较为少见。细胞型血管母细胞瘤表现为间质血管较少,主要由上皮样基质细胞呈巢状、小片状分布,胞浆空泡状较少(图1C)。(2)丰富的血管成分。以薄壁血管为主,偶见厚壁血管。肿瘤由于富含血管,常伴瘤内出血。本研究中有4 例病例伴有髓外造血(图1D),其中2 例髓外造血成分呈多灶性、分布较广泛;另外2 例出现小灶髓外造血成分,其形态学与胚胎血岛形成显著相似。虽然在间质中可发现髓外造血成分,但大多数岛屿位于毛细血管内或邻近毛细血管。有1 例病例为肿瘤—肿瘤转移(肾透明细胞癌转移至血管母细胞瘤,图1E),肾透明细胞癌中未见血管母细胞瘤成分,瘤体中央为肾透明细胞癌成分,呈泡巢状结构,由丰富的小薄壁血管构成网状间隔,瘤细胞体积大,胞浆透明,胞膜清楚,伴明显出血囊性变;瘤体外周为典型的血管母细胞瘤形态特征。
2.4 免疫组织化学染色结果 a-inhibin(图1F)、D2-40(图1G)、Vimentin、SOX9(图1H)、SOX2(图1I)、S100、NSE、CA9和CD56等呈阳性表达,阳性率依次为82.95%(146/176)、72.73%(128/176)、100.00%(176/176)、100.00%(176/176)、67.61%(119/176)、77.84%(137/176)、90.91%(160/176)、86.93%(153/176)和96.02%(169/176);而CK、CD10和GFAP等呈阴性表达,Ki-67增殖指数低。血管内皮细胞ERG、D2-40阳性。髓外造血成分CD117、MPO、CD42b和E-CAD散在阳性表达。1 例肿瘤—肿瘤转移(肾透明细胞癌转移至血管母细胞瘤)的病例(图1H),肾透明细胞癌成分CK(图1J)、CD10和Vimentin弥漫阳性表达,NSE、CD56和a-inhibin局灶阳性表达,D2-40阴性;Ki-67增殖指数约10%;血管母细胞瘤成分Vimentin呈弥漫阳性表达,a-inhibin、NSE和CD56局灶阳性表达,而CK、CD10和GFAP阴性表达,Ki-67增殖指数为3%(表1)。
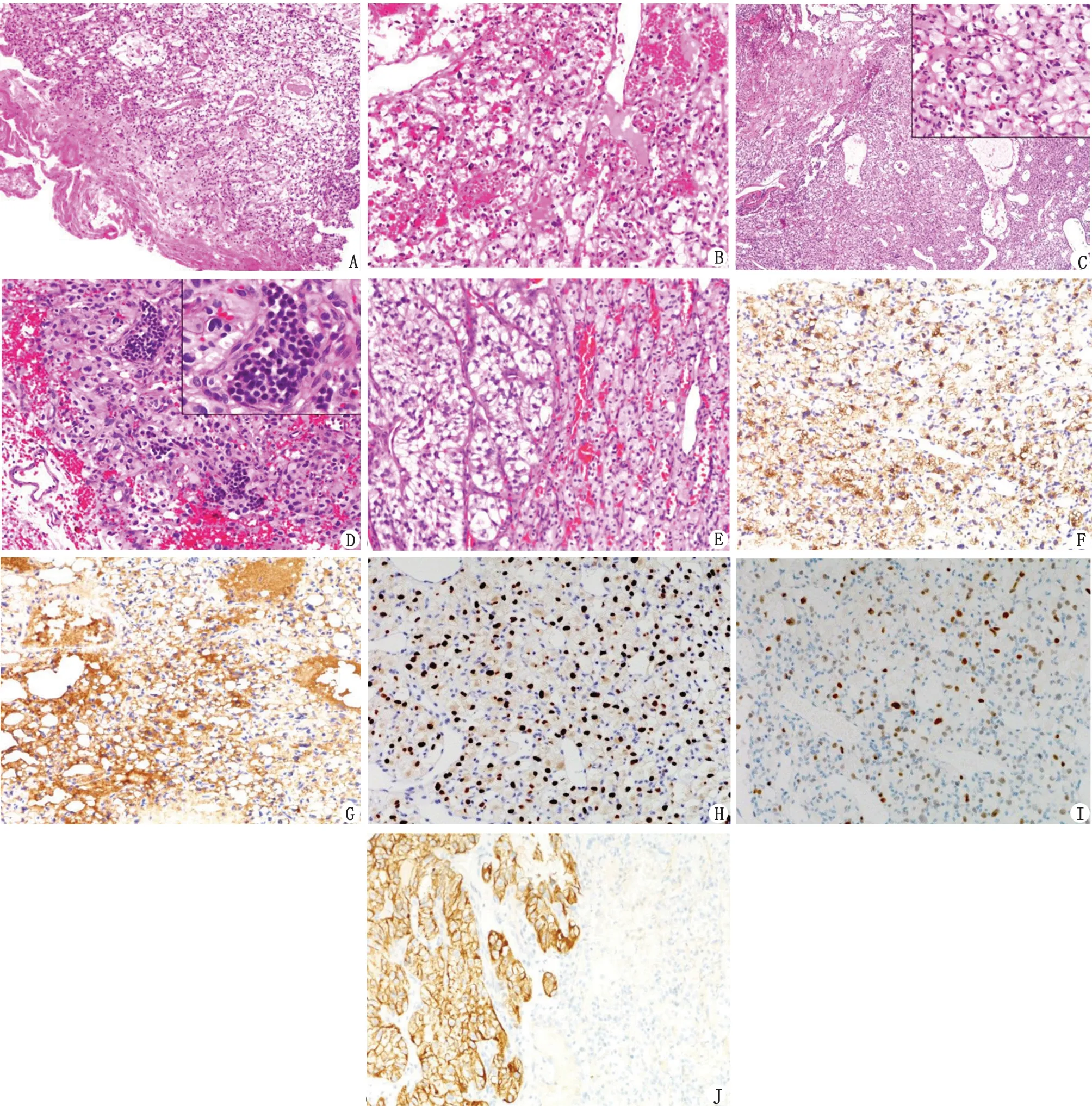
a-inhibin:a-抑制素;SOX:性别决定区域Y 相关的高迁移率族框;CK:细胞角蛋白。A:血管母细胞瘤呈非浸润性生长模式( ×100);B:典型血管母细胞瘤组织学形态( ×200);C:细胞型血管母细胞瘤组织学形态( ×40),插图显示高倍形态( ×200);D:血管母细胞瘤伴髓外造血( ×200),插图显示高倍形态( ×400);E:肾透明细胞癌转移至血管母细胞瘤( ×200);F:a-inhibin在血管母细胞瘤中阳性表达( ×200);G:D2-40在血管母细胞瘤中阳性表达( ×200);H:SOX9在血管母细胞瘤中呈核阳性表达( ×200);I:SOX2在血管母细胞瘤中呈核阳性表达( ×200);J:肾透明细胞癌转移至血管母细胞瘤中,CK在肾透明细胞癌呈弥漫强阳性表达;在血管母细胞瘤中阴性表达( ×200)。

表1 血管母细胞瘤的免疫组织化学染色结果
2.5 随访资料 随访144 例,随访时间为1~288个月,27 例存在复发情况,其余病例均无瘤生存。
3 讨 论
1928年,CUSHING等[1]首次描述血管母细胞瘤。该病是一种来源不确定的WHO 1级的肿瘤,占颅内肿瘤的2.5%[2],多发于成人,男女比例为1∶1,好发于小脑、脑干和脊髓,少见于幕上区[3]、桥小脑区及马尾[4-5]等。血管母细胞瘤的临床症状与肿瘤部位相关,常由肿瘤的占位效应引起。JURCO等[6]认为,该肿瘤是血管源性,因其间质细胞能够高表达血管内皮生长因子(vascular endothelial growth factor,VEGF);而BECKER等[7]认为其可能是一种神经内分泌肿瘤。
血管母细胞瘤临床上分为散发型和VHL综合征相关型,大多数为散发型,发病机制不明。VHL综合征是一种常染色体显性遗传病,由位于染色体3p25-26上的VHL肿瘤抑制基因的种系突变引起,其特征是发生肾透明细胞癌、中枢神经系统和视网膜的血管母细胞瘤、嗜铬细胞瘤、胰腺和内耳肿瘤等。25%~40%的中枢神经系统血管母细胞瘤与VHL综合征有关[2]。本研究中,6 例与VHL综合征有关。VHL相关的中枢神经系统肿瘤由发育停滞的血管母细胞组成,由于VHL缺乏,这些细胞同时表达促红细胞生成素(erythropoietin,Epo)和Epo受体,这可能是肿瘤形成的关键致病步骤[8]。
血管母细胞瘤的CT和MRI检查均有特征性表现[9]。MRI是首选的成像方式,极少数情况下,血管造影能更好地检测隐匿的血管结节。MRI通常显示钆增强肿块,约75%的病例呈囊实性,也可呈单纯囊性或单纯实性。实性成分通常位于小脑半球的外围。由于引流血管的扩大,结节内可见流空效应,通常无钙化。
本研究肉眼观察可见血管母细胞瘤常为囊实性,实性成分由一个附壁结节组成,与脑表面密切相关,血管密度高呈红色;囊性成分由于蛋白质浓度高呈黄色。镜下主要由间质细胞和丰富的毛细血管两种特征性成分构成。间质细胞最典型和最显著的形态特征是胞质丰富、淡染呈空泡状,或嗜酸、细颗粒状,胞核圆形,大小不一,可见非典型核和深染核,核分裂象少见;血管成分以薄壁血管为主,偶见厚壁血管。由于富含血管,常伴瘤内出血。根据间质细胞的丰富程度可分为细胞型和网状型[10]。细胞型血管母细胞瘤的特征为上皮样基质细胞的紧密巢状分布,胞浆空泡状较少,间质毛细血管少,与转移性肾细胞癌形态极为相似。
髓外造血成分在血管母细胞瘤中少见。镜下呈多灶性和广泛性分布或偶见小灶髓外造血成分,形态学与胚胎血岛形成显著相似。ALEXANDER等[8]认为,髓外造血成分与基质细胞和原始血管形成相关,血管母细胞具有多潜能性并能够分化为红细胞,具有原始造血功能。SEDDIGHI等[11]认为,髓外造血与红细胞增多症有关,但其相关性的意义和频率尚不清楚。本研究中,4例伴有髓外造血,其中1例伴有红细胞增多。
血管母细胞瘤间质细胞和毛细血管内皮细胞的免疫组织化学表达模式有显著差异。间质细胞Vimentin、a-inhibin、D2-40、S100、NSE、CA9和CD56等多呈阳性表达,上皮性标记物CK、上皮膜抗原(epithelial membrane antigen,EMA)等阴性;血管内皮细胞标记物ERG、CD34、CD31、血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1)和VEGFR2等阴性;CD10、GFAP等多呈阴性表达。Ki-67增殖指数低。间质细胞也表达多种其他蛋白,包括Brachyury、葡萄糖转运蛋白-1(Glut-1)、CXC趋化因子受体4(C-X-C chemokine receptor type 4,CXCR4)[12]、水通道蛋白-1(aquaporin-1)[13]、几种碳酸酐酶同工酶[14]和表皮生长因子受体(epidermal growth factor receptor,EGFR)。间质细胞可检测缺氧诱导因子-1(hypoxia inducible factor-1A,HIF-1A)和HIF-2A[15],其可能驱动VEGF的表达。
SOX9、SOX2为SOX基因家族成员。SOX9是调控几个关键发育过程的序列特异性转录因子,涉及睾丸、肾、心脏、大脑和骨软骨等重要器官[16]。SOX2在维持干细胞的自我更新、多向分化和重编程中发挥重要作用[17-18]。研究[19-20]表明,SOX2在多种肿瘤中发挥关键作用。CASSANDRA等[21]发现,13例血管母细胞瘤中SOX2未见明显表达,有待增加病例数进一步研究。SOX2及SOX9在血管母细胞瘤中的具体表达模式及与临床病理学特征的关系和意义尚不清楚。本研究发现,SOX9和SOX2在绝大多数血管母细胞瘤中表达,提示其可能有临床病理诊断意义。
血管母细胞瘤需与以下病变鉴别:(1)转移性肾透明细胞癌。二者组织形态学很相似,VHL患者也容易发生肾透明细胞癌,这增加了鉴别诊断的复杂性。本研究有1例肿瘤—肿瘤转移(肾透明细胞癌转移至血管母细胞瘤)的病例,免疫组织化学染色有助于鉴别诊断。肾透明细胞癌对上皮标记如CK、EMA等呈阳性,而血管母细胞瘤呈阴性。CD10在肾透明细胞癌中阳性,但在血管母细胞瘤中通常为阴性。(2)血管瘤型脑膜瘤。影像学表现为实性肿块,有明显的占位效应和瘤周水肿,增强扫描呈明显均匀强化。邻近的脑膜增厚并强化,呈鼠尾状改变,即“脑膜尾征”。镜下肿瘤富含小—中等大血管,常伴玻璃样变,瘤细胞核常呈明显退变。大部分脑膜瘤表达EMA,不表达a-inhibin等。(3)血管畸形。血管大小不等、厚薄不一,常伴充血、出血,管壁可玻璃样变性、钙化,缺乏间质细胞成分。(4)弥漫性胶质瘤。弥漫性胶质瘤呈浸润性生长模式,不同于血管母细胞瘤非浸润性生长模式;其GFAP呈弥漫阳性表达,而血管母细胞瘤GFAP呈阴性或灶状表达。
综上所述,血管母细胞瘤是中枢神经系统少见的肿瘤,为WHO 1级,但其生物学行为并不确定,部分可复发。伴有VHL的患者比散发型患者预后差,因其更倾向于发展为多发性病变且更易复发,需定期随访复查[22]。根治性完全切除是血管母细胞瘤的首选治疗方法。散发型血管母细胞瘤预后好,手术完全切除后一般不复发。若肿瘤无法完全切除,需结合放射治疗。
