母源性表达基因8在糖尿病视网膜病变中的作用
2023-05-13王蓄杨陈王灵
王蓄杨, 陈王灵
糖尿病(diabetes mellitus,DM)是一种由遗传和环境因素相互作用而诱发的慢性疾病,其特征是绝对或相对的胰岛素缺乏及高血糖、血脂异常和神经血管损伤[1]。这种损害可能影响患者体内的每一个器官或系统,并给患者的家庭和经济造成严重负担。DM视网膜病变(diabetic retinopathy,DR)是胰岛素代谢异常而引发的眼部神经及组织血管微循环改变,是1型和2型DM常见的微血管并发症,也是DM患者致盲的重要原因[2]。临床上,根据是否有视网膜新生血管生成,将DR分为非增殖性DR(non-proliferative diabetic retinopathy,NPDR)和增殖性DR(proliferative diabetic retinopathy,PDR)。DR发病机制复杂,病情隐匿且早期临床症状不显著,多数患者出现明显症状时疾病已进入中期甚至更严重的阶段[3]。因此,探究DR的发病机理、寻找有潜力的DR诊断标记物,对临床上DR的有效诊断及治疗十分必要。
长链非编码RNA(long non-coding RNA, lncRNA)是一类长度超过200个核苷酸的转录RNA分子,是转录、分化、侵袭、凋亡等多种生物过程的重要调控因子[4]。lncRNA正发展成为多种人类疾病新的生物标记物和治疗靶点。既往研究[5-7]报道,lncRNA 人类肺腺癌转移相关转录本1(metastasis associated lung adenocarcinoma transcript 1,MALAT1)在DM相关并发症(视网膜病变、动脉粥样硬化及妊娠DM)中发挥促炎和促细胞凋亡的作用,因而具有成为DM相关并发症治疗靶点的潜力。lncRNA母源性表达基因8(maternally expressed gene 8,MEG8)最初被发现在肺癌、胰腺癌、结直肠癌和巨细胞瘤等多种肿瘤中表达失调[8]。近年来,有研究[9]发现,MEG8在DM患者的血清中上调,而在DM肾病患者中进一步上调。另一项研究[10]表明,MEG8在妊娠DM患者血清中表达升高,且高水平的MEG8对妊娠DM具有较高的诊断价值。此外,高水平MEG8患者肾损伤发生率较高[11]。本研究旨在通过临床及细胞水平的实验,探讨MEG8在DR中的表达情况及可能的调控机制。
1 对象与方法
1.1 对象 共纳入 179 例受试者,其中DM 59 例,DR 60 例,健康人群 60 例。DM的诊断依据美国糖尿病协会(American Diabetes Association,ADA)于 2017 年制定的标准[12]。DR的诊断参照ADA颁布的诊断指南[13]。选取同期在笔者医院体检的 60 例无DM病史和其他眼病家族史的健康人作为对照组。所有受试者均排除恶性肿瘤、心血管疾病、自身免疫疾病。本研究获得中山大学中山眼科中心海南眼科医院医学伦理委员会批准,并遵循《赫尔辛基宣言》中关于人体研究的伦理原则,所有受试者均签署知情同意书。
1.2 方法
1.2.1 细胞培养与处理 采集所有受试者静脉血,高速离心后分离血清,保存于-80 ℃冰箱中备用。人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs)购自上海生化与细胞生物学研究所(上海SIBCB公司)。培养条件:DMEM/F12培养基内含10%胎牛血清和内皮生长因子(30 mg/mL),于37 ℃体积分数为0.05的CO2培养箱中孵育。通过高糖诱导HRMECs构建体外增殖型DR细胞模型[14]。DR组采用30.0 mmol/L的高糖诱导细胞24 h,对照组采用5.5 mmol/L的高糖处理细胞24 h。将 2 组细胞置于37 ℃、体积分数为0.05的 CO2潮湿培养箱中培养。
1.2.2 细胞转染 细胞接种到12孔板中,培养过夜。使用Lipofectamine 2000将si-MEG8、si-NC、miR-15a-5p mimic、miR-NC、miR-15a-5p inhibitor和inhibitor-NC转染到HRMECs细胞中。
1.2.3 RNA提取及实时荧光定量PCR(real-time quantitative PCR, qRT-PCR) 采用TRIzol 法提取并纯化血清和HRMECs细胞中的总RNA。采用SuperScript Ⅱ逆转录酶试剂盒和PrimeScript RT试剂盒进行cDNA的合成。利用miScript SYBR Green PCR试剂盒在Applied Biosystems 7900 Real-Time PCR System上进行cDNA的扩增。用GAPDH和U6分别对MEG8和miR-15a-5p进行归一化,并采用2-ΔΔCT计算基因的相对表达量。
1.2.4 CCK-8实验 采用CCK-8法测定细胞活力。将HRMECs细胞以5×104个/孔的密度接种到96孔板中。在每一个预先设定的时间点0、24、48和72 h时,向每孔中加入CCK-8溶液10 μL和新鲜无血清培养液90 μL,暗处孵育2 h后,用酶标仪检测450 nm处的光密度(optical density, OD)值。
1.2.5 Transwell实验 使用Transwell小室进行HRMECs的细胞迁移分析。收集转染完成的细胞,将其分散在200 μL无血清的培养基中,将细胞接种到上腔室。同时在下腔室中加入800 μL含10%胎牛血清的DMEM培养基。将上述Tranwell小室置于37 ℃培养箱中培养24 h后,用甲醇固定迁移至插入物下方的细胞,室温下用0.1%结晶紫染色。在倒置荧光显微镜下随机选取 5 个视野对迁移细胞进行计数。
1.2.6 荧光素酶报告基因 StarBase v2.0在线程序预测到MEG8和miR-15a-5p的3’-UTR区具有互补结合位点,采用荧光素酶报告基因验证MEG8和miR-15a-5p的相互作用。将MEG8的3’-UTR片段克隆到pGL3荧光素酶报告载体中,构建野生型(wild-type, WT)报告载体MEG8 3’-UTR-WT和突变型(mutant-type, MUT)报告载体MEG8 3’-UTR-MUT。根据Lipofectamine 2000的产品说明,将上述载体与miR-15a-5p mimic/inhibitor、mimic/inhibitor-NC共转染HRMECs细胞。转染48 h后,收集细胞并利用双荧光素酶报告系统测定HRMECs细胞的荧光素酶活性。

2 结 果
2.1 人口及临床资料 所有受试人员的基线资料及临床数据均见表1。3 组受试者的性别、年龄、体质量指数(body mass index, BMI)、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、收缩压和舒张压等指标比较,差别无统计学意义(P>0.05)。DM、DR组与对照组的糖化血红蛋白、空腹血糖、胰岛素抵抗指数和DM病程等指标比较,差别有统计学意义(P<0.05)。
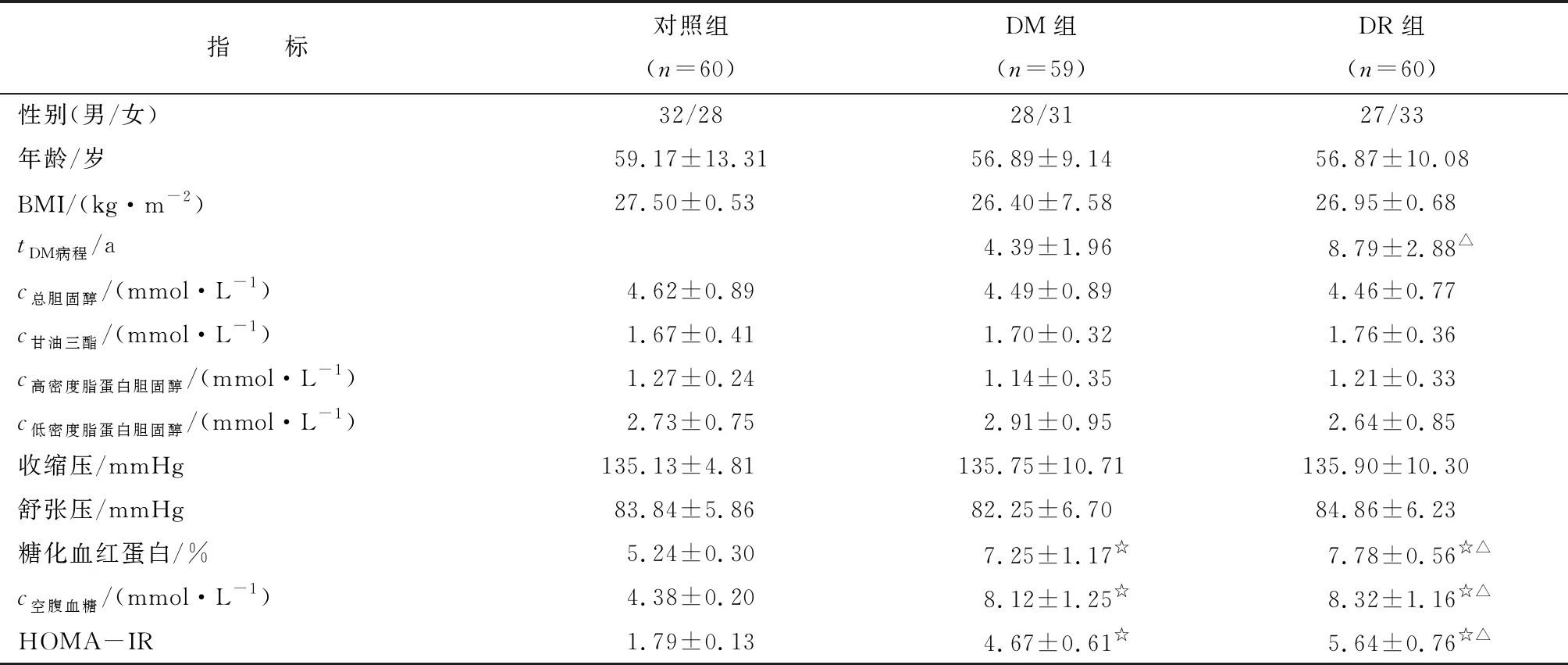
表1 3组受试者的基本信息
2.2MEG8在DM、DR组中的表达水平及对DM和DR的诊断价值分析 采用qRT-PCR检测受试者血清中MEG8的表达水平。与对照组比较,DM组血清MEG8的表达水平明显增高(P<0.001)。DR组的MEG8水平较DM组和对照组更高,差别有统计学意义(P<0.001,图1A)。建立ROC曲线评价MEG8对DM和DR的诊断价值,该曲线的曲线下面积(area under the curve,AUC)为0.862,敏感度为85.5%,特异度为80.0%,初步表明MEG8对DM的诊断准确性较高(图1B)。另外,在DM和DR患者中,血清MEG8同样展现出较高的临床诊断价值,其ROC曲线的AUC为0.918,敏感度和特异度分别为83.3%和80.6%(图1C)。
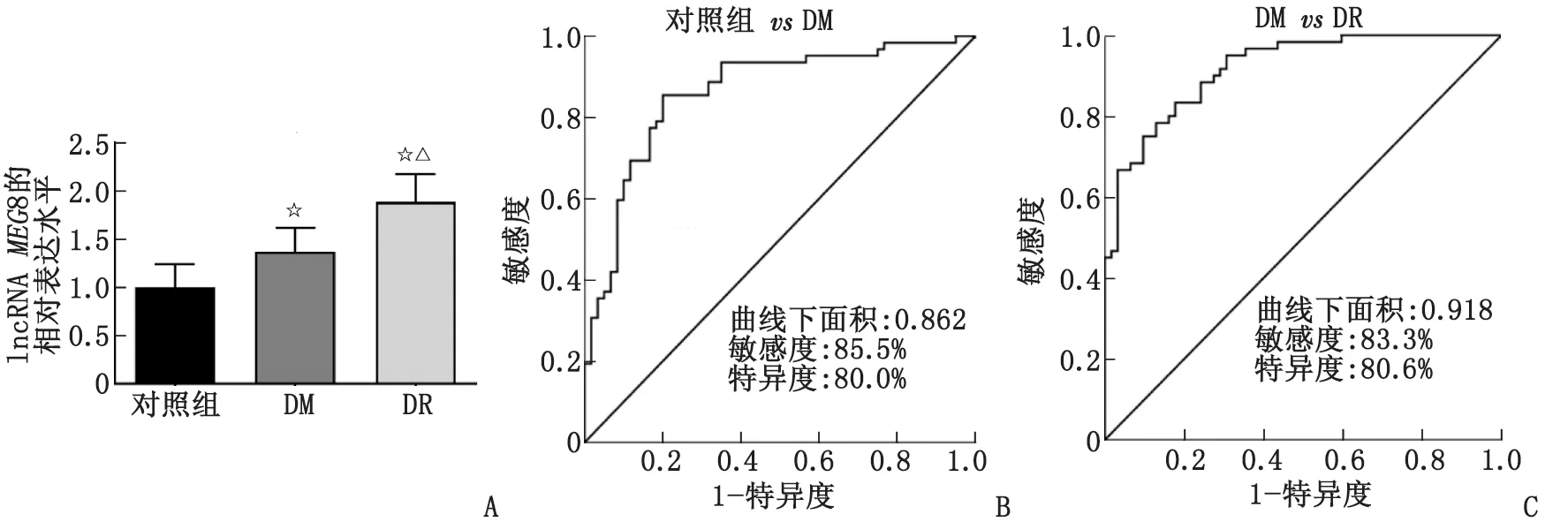
lncRNA:长链非编码RNA;MEG8:母源性表达基因8;DM:糖尿病;DR:糖尿病视网膜病变。A:血清MEG8的表达水平(与对照组比较,☆:P<0.001;与DM组比较,△:P<0.001);B:对照组、DM组MEG8表达水平的ROC曲线;C:DM、DR组MEG8表达水平的ROC曲线。
2.3 血清MEG8水平与临床指标的相关性 为进一步验证MEG8异常表达与DR的关系,采用Pearson相关系数评估MEG8与临床指标的相关性。MEG8水平与患者的病程、糖化血红蛋白水平、空腹血糖水平及胰岛素抵抗指数呈显著正相关(P<0.01,表2)。

表2 lncRNA MEG8与部分临床指标的相关性
2.4MEG8的表达水平对细胞增殖和迁移的影响 本研究采用高糖诱导HRMECs细胞构建体外DR细胞模型。与对照组比较,高糖诱导组细胞的MEG8的表达水平显著上调,而细胞转染MEG8小干扰RNA后明显降低了高糖诱导所致的HRMECs细胞内MEG8升高(P<0.001)。细胞增殖和迁移实验的结果表明,高糖诱导能显著促进HRMECs细胞的增殖和迁移能力,抑制MEG8则可逆转高糖环境对细胞增殖和迁移的促进作用(P<0.001,图2)。

lncRNA:长链非编码RNA;MEG8:母源性表达基因8。A:细胞建模及转染;B:细胞活力;C:细胞迁移。与对照组比较,☆:P<0.001;与高糖组比较,◇:P<0.001。
2.5MEG8直接靶向miR-15a-5p并负调控miR-15a-5p的表达水平 为进一步确定MEG8在DR中的作用机制,采用StarBase v2.0数据库进行生物信息学分析。该数据库预测到miR-15a-5p与MEG8的3’-UTR有结合位点,二者的互补序列见图3A。荧光素酶报告基因结果显示,当细胞转染miR-15a-5p模拟物后,MEG8-3’-UTR-WT组的荧光素酶活性显著降低,而转染miR-15a-5p抑制剂后,MEG8-3’-UTR-WT组的荧光素酶活性增高(P<0.001,图3B)。此外,细胞转染miR-15a-5p模拟物或miR-15a-5p抑制剂均对MEG8-3’-UTR-MUT组的荧光素酶活性无影响。笔者初步确定miR-15a-5p是MEG8的直接靶基因,并受到MEG8的负调控。据此,对临床受试者的血清miR-15a-5p的水平进行检测,结果发现,DM组和DR组患者血清miR-15a-5p的表达与MEG8的表达趋势相反,即DR患者血清miR-15a-5p水平显著低于对照组和DM组,差别具有统计学意义(P<0.001,图3C)。Pearson相关系数提示,miR-15a-5p的表达与MEG8水平呈负相关(P<0.001,图3D)。另外,高糖诱导细胞后胞内miR-15a-5p的表达水平明显降低,而抑制MEG8的表达则相应促进miR-15a-5p的表达水平(P<0.001,图3E)。以上结果进一步证实,MEG8与miR-15a-5p在体外DR细胞模型中的关系。
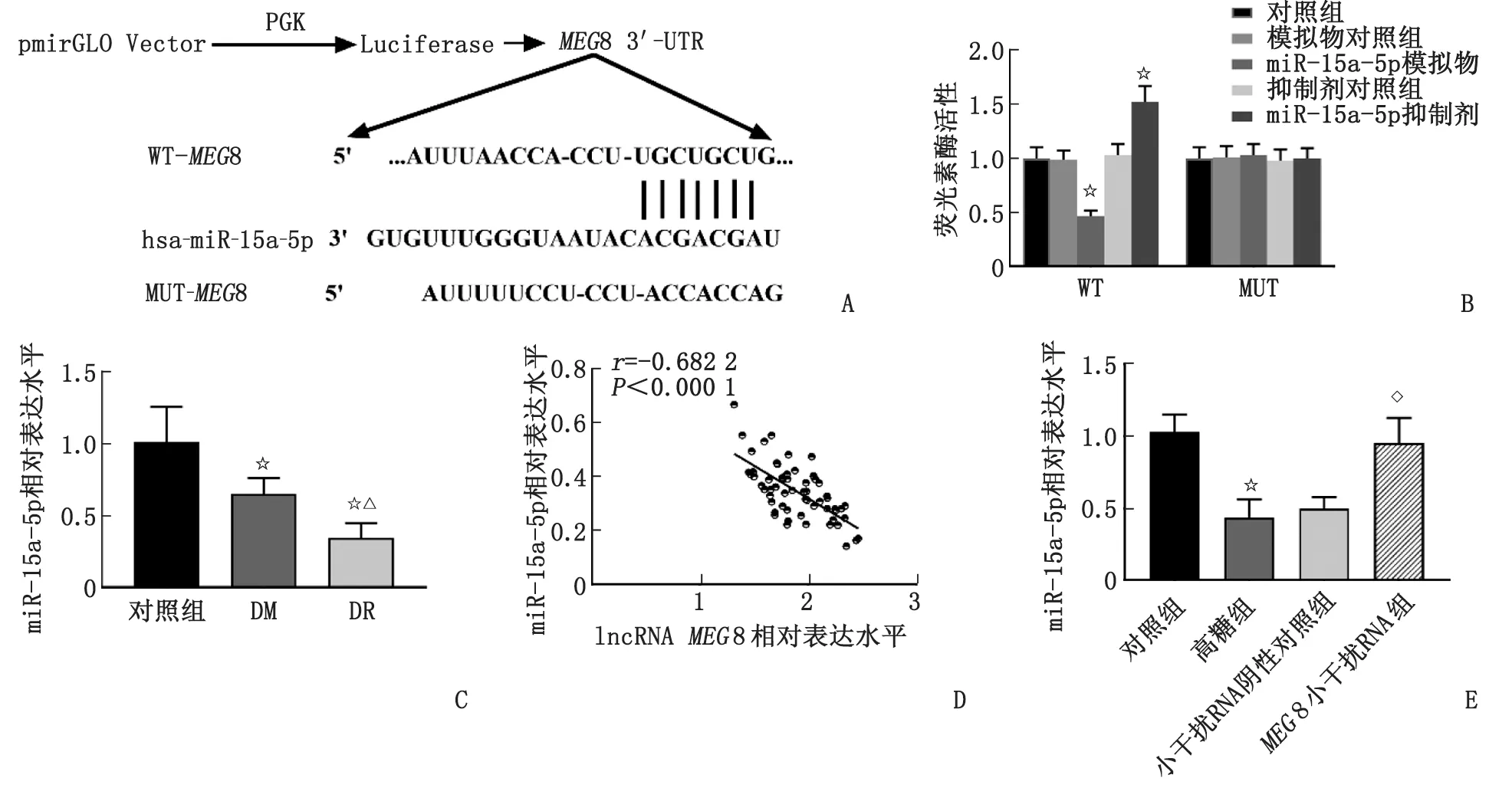
pmirGLO Vector:荧光素酶报告质粒载体;PGK:磷酸甘油酸激酶;Luciferase:荧光素酶;MEG8:母源性表达基因8;3’-UTR:3’-非翻译区;WT:野生型;MUT:突变型;hsa-miR-15a-5p:人源miR-15a-5p;lncRNA:长链非编码RNA。A:MEG8与miR-15a-5p的互补结合位点;B:荧光素酶报告基因实验;C:血清miR-15a-5p的表达水平;D:Pearson相关系数分析;E:细胞模型中miR-15a-5p的水平。与对照组比较,☆:P<0.001;与DM组比较,△:P<0.001;与高糖组比较,◇:P<0.001。
3 讨 论
DR是导致失明的重要眼病之一。在DR发展过程中,可以发现许多特征性的视网膜异常,包括微动脉瘤、印迹出血、棉毛斑和视网膜静脉扩张等,这些被认为是微血管损伤的特征[15]。目前,DR的发病机制尚不完全清楚,一般认为是由于糖代谢紊乱导致视网膜微血管系统受损所致[16]。多年来,DNA、RNA和蛋白质的功能失调被认为是包括DM在内的人类疾病发生和发展的主要因素。lncRNA 在DR中的作用是一个相对新的探索领域,对其在疾病发病过程中改变分子和细胞过程机制的研究至关重要。
lncRNAMEG8位于人类14号染色体上的δ样1 同源脱碘酶-碘甲状腺原氨酸3印记区内,已知该印记区对人类疾病具有重要的调控作用[17]。TERASHIMA等[18]的研究发现,在人肺癌细胞株中,MEG8参与介导上皮间质转化,对肿瘤的发生具有重要意义。ZHANG等[19]发现,在氧化低密度脂蛋白诱导的血管平滑肌细胞中,MEG8通过海绵作用miR-181a-5p促进α-过氧化物酶体增殖物激活受体蛋白的表达,从而调控血管平滑肌细胞的增殖、迁移和凋亡,在动脉粥样硬化中发挥重要作用。本研究发现,MEG8在DM患者血清中表达升高,而在DR患者血清中表达进一步升高。MEG8的表达水平与DR患者的病程等临床指标呈正相关,且MEG8对DR表现出良好的诊断性能。这些结果提示,MEG8可能在DR的发病过程中发挥一定的调控作用。
DR是引起视力损伤及失明的主要原因。大剂量葡萄糖的持续诱导可致HRMECs的凋亡增加,而HRMECs的增殖、迁移及诱导血管新生是DR进展的重要因素[20]。高静等[21]的研究表明,血管内皮生长因子、基质细胞衍生因子-1的表达促进了HRMECs的增殖和迁移能力,并抑制了HRMECs的凋亡水平,因而可能在DM导致的血管病变中发挥促进作用,故本研究通过高糖诱导构建增殖型DR的体外细胞模型。高糖诱导导致HRMECs内MEG8的表达升高。同时,高糖诱导促进了HRMECs的增殖和迁移能力。下调MEG8的水平能明显逆转高糖诱导对细胞增殖和迁移的促进作用。因此,抑制MEG8的表达水平可缓解高糖对HRMECs细胞功能的不利影响。
研究[22]显示,lncRNA对miRNA的调控作用可通过控制miRNA的表达来影响其靶基因的表达量,其与miRNA结合从而阻止miRNA与其靶mRNA结合,作为miRNA的靶点或分子海绵而发挥基因调节的作用。既往的研究[23]表明,心肌梗死相关转录本(myocardial infarction associated transcript, MIAT)作为miR-342-3p的分子海绵,通过与miR-342-3p的靶向结合,调控胱天蛋白酶1的表达,进而诱导人视网膜周细胞(human peripheral retinal cellsh,HRPCs)的焦亡,从而发挥调控DR的作用。本研究中,靶基因预测及荧光素酶报告基因实验证明miR-15a-5p与MEG8具有互补结合位点并且二者为靶标关系。此前,miR-15a-5p(又称为miR-15a)被认为对DM患者的胰岛素抵抗有缓解作用[24]。GONG等[25]的研究发现,高糖培养的视网膜组织细胞中miR-15a-5p的表达水平显著降低,且当HRMECs细胞暴露于高糖环境中时,上调的VEGF通过下调miR-15a-5p促进了高糖对细胞的损伤;而MASTROPASQUA等[26]的研究发现,DM患者无论是否有DR,循环miR-15a-5p水平均明显降低。笔者推测,在高糖处理的HRMECs中,上调的MEG8可能通过下调miR-15a-5p发挥了促进HRMECs增殖和迁移的作用。
本研究的局限性在于:首先,样本量较小,来源单一且均为笔者医院周边的人群,可能存在一些无法完全避免的选择偏差;其次,在DR人群的纳入中,未对这一部分人群进行临床分期,即病情严重与病情轻微的患者均在同组中,这也导致MEG8的表达情况与疾病严重程度的关系不能被直观看到。因此,在后续的研究中,笔者会进一步扩大样本量及样本来源,并针对DR的分期进行基因表达与疾病分期关系的研究。
综上所述,DM患者血清MEG8水平升高,而DR患者血清MEG8水平进一步上升。异常升高的MEG8展现出对DR和DM良好的辨别能力,表明MEG8对DR具有较高的诊断准确性,有成为DR诊断生物标记物的潜力,对于DR的诊断可能具有一定的辅助作用。同时,体外细胞实验表明,MEG8直接靶向miR-15a-5p。在细胞水平上,高表达的MEG8可能通过靶向miR-15a-5p发挥促进高糖诱导HRMECs的增殖和迁移的作用。
