微RNA-205与人食管癌放射治疗抵抗细胞株Eca-109R放射抗性的相关性
2023-05-12赵文玺张晶晶徐广峰吴德平
赵文玺,张晶晶,王 鹏,徐广峰,吴德平
(1.淮安八十二医院〔原东部战区总医院淮安医疗区〕检验科,江苏 淮安 223001;2.淮安鼎卫医学检验所,江苏 淮安 223001;3.淮安市第三人民医院检验科,江苏 淮安 223001)
食管癌是一种对人类健康有严重危害的恶性肿瘤,其发病率在全部肿瘤中居第8位,在肿瘤相关性死亡率排名中居第6位[1-2]。中国是食管癌高发地区,每年发病人数占全球总人数50%以上[3]。食管癌是一种预后较差的恶性肿瘤[4],转移和复发是导致其预后差的主要原因[5]。许多采用根治性放疗的患者在1~2 a复发,5 a生存率仅10%左右[6]。导致复发或转移的原因较多,如肿瘤组织乏氧、对辐射效应的个体差异、放射治疗抵抗等均会导致病灶内残留有活性的癌细胞。如何提高放射治疗敏感性或者降低放射治疗抗性,达到预期效果,是亟待解决的问题。当前,微RNA(microRNA,miRNA)成为研究热点之一,其越来越多的作用和功能被研究人员发现。有研究表明,食管癌患者的癌组织和血液中miRNA的表达水平与健康人群有显著差异[7]。PAN等[8]研究发现,miR-205过表达可以提高食管癌细胞KYSE-30对放射治疗的抵抗性。FEBER等[9]研究发现,miR-205在鳞状细胞癌和腺癌中表达较低。以上研究结果提示,癌细胞中miR-205过表达后可能会导致细胞对放射治疗的抵抗。基于此,本研究通过建立Eca-109放射治疗抵抗细胞株,检测miR-205在放射治疗前后的表达水平,同时检测miR-205 过表达后细胞的增殖变化情况,探讨miR-205与食管癌细胞Eca-109放射治疗抵抗性的相关性。
1 材料与方法
1.1 细胞、主要试剂与仪器人食管鳞状细胞癌细胞株Eca-109购自上海细胞生物研究所;RPMI-l640培养基购自美国Hyclone 公司,胎牛血清购自加拿大 Wisent 公司,RNA 提取试剂盒购自德国Qiagen公司,miR-205 mimics和Lipofectamine 2000转染试剂盒购自广州锐博生物科技有限公司,miRNA反转录试剂盒和反转录聚合酶链式反应 (reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购自美国ABI公司,细胞计数试剂盒-8 (cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司;VARIAN 2300C/D型医用电子直线加速器购自美国Varian Medical Systems公司,OLYMPUS CK40型倒置显微镜购自日本奥林巴斯公司,KHB ST-360生物酶标仪购自上海科华生物工程股份有限公司,微量分光光度计购自南京五义科技有限公司,荧光定量PCR仪购自美国ABI公司,MDF-382E(CN)医用低温冰箱购自大连三洋冷链有限公司。
1.2 细胞培养及放射治疗抵抗模型的建立将Eca-109细胞株复苏后接种于含体积分数10%胎牛血清的RPMI-l640培养基,置于37 ℃、含体积分数5% CO2的培养箱中培养,每2 d换液1次,待细胞铺满培养瓶底90%后扩大培养备用。取部分培养好的Eca-109细胞用直线加速器进行照射,剂量率为 200 cGy·min-1,辐射源到细胞的距离100 cm,照射面积10 cm×10 cm,照射剂量依次为 2 Gy 照射3次、3 Gy照射3次、4 Gy照射5次[10],照射时间=照射剂量/剂量率。每次射线照射后次日更换培养液,清除死亡细胞,传代培养后至细胞铺满培养瓶底90%再进行下一次照射,总剂量达到35 Gy后,存活下来的细胞即为放射治疗抵抗细胞模型,命名为Eca-109R细胞。
1.3 细胞转染取部分培养的Eca-109细胞消化后稀释为1×108L-1的单细胞悬液,每孔3 mL接种到6孔板中培养,待细胞融合度达到50%~70%,按照Lipofectamine 2000转染试剂盒说明书操作步骤,将miR-205 mimics转染入Eca-109细胞(Eca-109 miR-205过表达细胞),继续培养48 h后将细胞消化备用。
1.4 细胞形态观察用倒置显微镜观察Eca-109细胞和Eca-109R细胞贴壁生长状态下的形态。
1.5 CCK-8法检测细胞存活率根据照射剂量将Eca-109细胞、Eca-109 miR-205过表达细胞和Eca-109R细胞分别分为0 Gy组、2 Gy组、4 Gy组、6 Gy组、8 Gy组、10 Gy组,共18组。将3种细胞消化后稀释为2×104L-1的单细胞悬液,每孔100 μL接种到96孔板中,放置于37 ℃、含体积分数5% CO2的培养箱中培养24 h后,按照分组分别给予0、2、4、6、8、10 Gy的剂量进行照射,培养48 h后吸去上清液,并加入90 μL含血清培养液,再加入10 μL的 CCK-8试剂,之后继续培养4 h,使用酶标仪测定每个反应孔在450 nm处的吸光度值,并计算细胞存活率。细胞存活率=(实验孔吸光度值-空白孔吸光度值)/(对照孔吸光度值-空白孔吸光度值)。
1.6 克隆形成实验检测细胞增殖情况Eca-109细胞、Eca-109 miR-205过表达细胞和Eca-109R 细胞的分组同“1.5”。将3种细胞消化后稀释为1×106L-1的单细胞悬液,每孔1 mL接种到6孔板中,再补充2 mL含血清培养基,培养24 h后按照分组分别给予0、2、4、6、8、10 Gy的剂量进行照射,继续培养14 d,期间每3 d更换1次培养液,最后吸走培养液,甲醇固定30 min,吉姆萨染液进行染色,计数>50个细胞的克隆数,并计算克隆形成率。克隆形成率=细胞克隆数/接种细胞数。
1.7 RT-PCR法检测细胞中miR-205相对表达量采用RNA提取试剂盒提取0 Gy剂量照射的Eca-109 细胞、Eca-109 miR-205过表达细胞和Eca-109R细胞中的总RNA,以及用单次4 Gy剂量照射后继续培养48 h的Eca-109细胞和Eca-109R细胞中的总RNA,用微量分光光度计测定RNA浓度和纯度,OD260/280处于1.8~2.0最佳,如果OD260/280<1.8,可能有蛋白质污染;OD260/280>2.0,可能有试剂残存。使用反转录试剂盒,以提取到的RNA为模板,反转录出互补的单链DNA,以U6为内参基因,应用RT-PCR 技术检测miR-205的Ct值,采用2-ΔΔCt法计算miR-205的相对表达量。

2 结果
2.1 Eca-109细胞和Eca-109R细胞的形态结果见图1。Eca-109细胞形态均一,大小一致,大多呈片状或梭状,折光性良好;Eca-109R细胞出现少量多角形细胞,伴有颗粒感,折光性差。异常形态的细胞在后续传代培养过程中逐渐消失,最终获得均一性良好的细胞株Eca-109R。

图1 Eca-109和Eca-109R细胞的形态 (×100)Fig.1 Morphology of Eca-109 and Eca-109R cells (×100)
2.2 Eca-109细胞、Eca-109R细胞、Eca-109 miR-205过表达细胞存活率比较结果见表1。在0 Gy组,Eca-109R细胞、Eca-109 miR-205过表达细胞与Eca-109细胞的存活率比较差异无统计学意义(P>0.05)。在2、4、6 Gy组,Eca-109R细胞、Eca-109 miR-205过表达细胞的存活率显著高于Eca-109细胞,差异有统计学意义(P<0.05)。在8 Gy组,Eca-109R细胞的存活率显著高于Eca-109细胞,差异有统计学意义(P<0.05);Eca-109 miR-205过表达细胞与Eca-109细胞的存活率比较差异无统计学意义(P>0.05)。在10 Gy组,Eca-109R细胞、Eca-109 miR-205过表达细胞与Eca-109细胞的存活率比较差异无统计学意义 (P>0.05)。
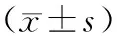
表1 Eca-109细胞、Eca-109R细胞、Eca-109 miR-205过表达细胞存活率比较Tab.1 Comparison of cell survival rates among Eca-109 cells,Eca-109R cells and Eca-109 miR-205 overexpression cells
2.3 Eca-109细胞、Eca-109R细胞、Eca-109 miR-205过表达细胞增殖能力比较结果见表2和图2。在0 Gy 组,Eca-109R细胞、Eca-109 miR-205过表达细胞与Eca-109细胞的增殖能力比较差异无统计学意义 (P>0.05)。在2、4、6 Gy组,Eca-109R细胞、Eca-109 miR-205过表达细胞的增殖能力显著高于Eca-109细胞,差异有统计学意义(P<0.05)。在8 Gy 组,Eca-109R细胞的增殖能力显著高于Eca-109细胞,差异有统计学意义(P<0.05);Eca-109 miR-205 过表达细胞与Eca-109细胞的增殖能力比较差异无统计学意义(P>0.05)。在10 Gy组,Eca-109R细胞、Eca-109 miR-205过表达细胞与Eca-109细胞的增殖能力比较差异无统计学意义 (P>0.05)。
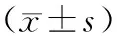
表2 Eca-109细胞、Eca-109R细胞、Eca-109 miR-205过表达细胞增殖能力比较Tab.2 Comparison of cell proliferation ability among Eca-109 cells,Eca-109R cells and Eca-109 miR-205 overexpression cells
2.4 Eca-109细胞、Eca-109R细胞、Eca-109 miR-205过表达细胞中miR-205相对表达量比较在0 Gy组,Eca-109细胞、Eca-109R细胞、Eca-109 miR-205过表达细胞中miR-205的相对表达量分别为0.73±0.04、1.24±0.06、3.91±0.22,Eca-109R细胞、Eca-109 miR-205过表达细胞中miR-205的相对表达量显著高于Eca-109细胞,差异有统计学意义(P<0.05)。在4 Gy组,Eca-109细胞、Eca-109R细胞中miR-205的相对表达量分别为1.33±0.04、3.26±0.06,Eca-109R细胞中miR-205的相对表达量显著高于Eca-109细胞,差异有统计学意义(P<0.05)。4 Gy组的Eca-109细胞中miR-205的相对表达量显著高于0 Gy组的Eca-109细胞,差异有统计学意义(P<0.05);4 Gy组的Eca-109R细胞中miR-205的相对表达量显著高于0 Gy组的Eca-109R细胞,差异有统计学意义(P<0.05)。
3 讨论
在中国,食管癌的发病率居高不下,近年来随着人们健康意识的提升和医疗技术的进步,越来越多的食管癌患者被确诊,其中超过90%的患者为食管鳞状细胞癌,而欧美地区的食管癌以腺癌为主[11]。因此,需要建立符合我国食管癌特征的诊疗流程,制定有效可行的治疗方案和预后评估手段,不断深入探索食管鳞状细胞癌的病因、病程,为该病的检测、诊断和治疗提供更充分的依据。当前,食管癌的治疗以手术为主,由于各种原因无法进行手术的患者会选择放射治疗和化学治疗,随着放射治疗技术的精进,食管癌患者放射治疗后5 a生存率也从最初的低于20%提高到44%左右。但是较高的复发率依然困扰着医生和患者[12],复发的主要原因是癌组织范围难以精准测定,使放射治疗剂量的设定难度加大,以及癌细胞对放射治疗的抵抗性等。对此,多数学者选择使用恶性程度更高的低分化食管癌细胞株来建立放射治疗抵抗模型[13-14];但也有研究表明,无论食管癌分化程度高低,都存在放射治疗抵抗的现象[9]。本研究在查阅大量文献,并进行预实验验证后,最终选择高分化细胞株Eca-109进行造模,该细胞株来源于人食管鳞状细胞癌,细胞特征明显,易于传代培养。本研究采用多次分阶段递增剂量照射的方法建立放射治疗抵抗模型,结果显示,造模完成后,常规培养条件下,Eca-109R细胞的形态特征与Eca-109细胞无明显区别,可以正常传代、贴壁生长。在给予Eca-109、Eca-109R细胞相同剂量射线照射后,Eca-109R细胞的存活率显著高于Eca-109细胞,细胞增殖能力也显著高于Eca-109细胞,与陈鑫等[15]的研究结果一致。
miRNA 是存在于真核生物体内的一类长度不超过25个核苷酸的非编码RNA,在机体内几乎所有的代谢活动和疾病过程都有miRNA的参与[16]。王智[17]研究发现,血清中miRNA水平的改变可以预测化学治疗的效果和预后情况。也有研究表明,在非小细胞肺癌中沉默miR-205后,可以抑制肿瘤细胞的增殖及体外血管的形成[18]。miR-205的主要功能是调控肿瘤细胞的增殖、侵袭及凋亡,但是其在不同的肿瘤组织或细胞中的表达水平却不尽相同。有研究证实,miR-205参与肿瘤细胞增殖和凋亡的过程[8]。本研究对比了miR-205在Eca-109R与Eca-109细胞中的表达水平,以及在接受射线照射后miR-205的表达水平变化情况,结果发现,miR-205 在Eca-109R细胞中的相对表达量显著高于Eca-109细胞,且细胞的存活率和克隆形成率也高于Eca-109细胞,说明细胞的存活和增殖能力的提高与miR-205高表达有关,miR-205可能参与了细胞的放射治疗抵抗。本研究还发现,Eca-109 miR-205 过表达细胞的存活率和克隆形成率均显著高于Eca-109细胞,进一步说明miR-205可以提高Eca-109细胞的增殖能力,达到抵抗射线照射的作用,与细胞的放射治疗抵抗有关,从而推测可以通过抑制miR-205的表达水平来降低Eca-109R细胞的放射治疗抗性。
综上所述,本研究通过建立放射治疗抵抗细胞模型,证实了miR-205与人食管鳞状细胞癌细胞株Eca-109的放射治疗抗性有相关性,为下一步验证调节miR-205表达水平来改变Eca-109和Eca-109R细胞的放射治疗抗性提供了依据,为食管癌放射治疗方法的改进和优化提供了新的理论依据。
