蕾铃脱落对棉花果枝叶光合产物积累及“源”潜力的影响
2023-05-12阚家强刘玉周治国陈兵林赵文青胡伟胡少鸿陈阳王友华
阚家强,刘玉,周治国,陈兵林,赵文青,胡伟,胡少鸿,陈阳,王友华
蕾铃脱落对棉花果枝叶光合产物积累及“源”潜力的影响

南京农业大学农学院/农业农村部作物生理生态与生产管理重点实验室/江苏省现代作物生产协同创新中心,南京 210095
【目的】棉花蕾铃脱落率常超过60%,蕾铃脱落后的果枝叶常作为“辅助源”对其邻位铃的发育起重要作用。探明棉花果枝叶在其对位蕾铃脱落后作为“辅助源”的潜力及其变化趋势,丰富棉花产量形成的“源-库”调控理论,为棉花补偿性生长的栽培管理提供理论依据。【方法】以中棉425为材料于2021年分2个播期(5月10日、6月1日)在江苏南京(118°50′E,32°02′N)南京农业大学牌楼试验站开展田间试验,研究果枝韧皮部阻断条件下,去库(化学法阻断第四、五、六果枝第一果节“蕾-对位叶”系统与主茎连接的韧皮部,同时去除该系统蕾/花,模拟蕾铃脱落条件)后棉花果枝叶形态特征、气体交换参数、碳氮物质及内源激素含量等叶片源能力相关指标的变化。【结果】(1)去库处理显著增加了果枝叶中果糖、蔗糖、淀粉、纤维素含量,却显著降低了其葡萄糖含量。随着时间的推延,去库后1 d,淀粉的增幅最大,纤维素增幅则主要在去库后3 d明显变大;去库后5 d,蔗糖、纤维素、淀粉的增幅较大。(2)去库后,糖分更多地以非还原性糖形式积累;光合产物更多地向淀粉形式分配;多聚糖/低聚糖呈先降低后升高的趋势,而果枝叶C/N则呈现先升高后下降的趋势。(3)去库处理显著降低了果枝叶净光合速率和叶绿素含量。(4)果枝叶局部呈现紫红色且花青素含量较对照升高了约2倍。(5)去库后,果枝叶中ABA含量呈上升趋势且显著高于对照,IAA含量呈先上升后下降的趋势;GA3含量在去库处理后显著低于对照,而JA与SA含量则显著高于对照。(6)果枝叶内源激素动态平衡在去库后改变,ABA/IAA、JA/IAA呈现先减小后增大的趋势,而ABA/GA3、JA/GA3则不断增大。【结论】蕾铃脱落后,果枝叶中糖分积累和分配形式及内源激素信号发生显著改变,并对其叶源能力产生显著影响。短期内(1—3 d),果枝叶中糖类物质整体含量增加,尤其是非还原性糖累积幅度较大,源能力快速增强;但随着时间推移,源能力增强幅度下降,同时叶片有早衰趋势,叶绿素降解加速。即蕾铃脱落后,脱落蕾铃的果枝叶对其邻位铃的“辅助源”功能短期内(3 d左右)快速上升,之后快速下降,后期其对邻位铃发育的贡献很小。
棉花;蕾铃脱落;果枝韧皮部阻断;糖;激素
0 引言
【研究意义】蕾铃脱落是棉花的一个生物学特性,一般蕾铃脱落率占总果节数的70%,严重时可达80%以上,而成铃仅占总果节数的30%[1]。早期的蕾铃脱落改变了棉花光合产物运输分配状态,促使棉花果枝上产生更多节位的蕾铃,而脱落蕾铃的对位叶则成为“辅助源”对相邻节位蕾铃(邻位蕾铃)的发育起到重要作用[2]。接收“辅助源”光合产物的蕾铃常被称为“补偿库”,其成铃率的增加和铃重的上升一定程度上弥补了先前蕾铃脱落导致的产量损失[3-4]。因此,棉花果枝叶在其对位蕾铃脱落后源能力的研究对于揭示棉花自身调节能力及其补偿性生长具有重要意义。【前人研究进展】放射性同位素试验表明,棉花果枝结铃后,果枝叶产生的光合产物大部分转运至同果枝蕾铃中,向其对位铃输送占85.6%,向其邻位蕾铃输送占12.2%[5-6]。而蕾铃脱落后,其邻位蕾铃将接收到果枝叶更多的光合产物[7],其成铃率以及铃重也将大大增加[8]。Kerby等[9]发现果枝第一果节花蕾脱落后,第二果节的成铃率增长了17%—33%;Constable[10]认为第一果节铃的脱落促使第二或三果节铃增大。前人通过早期去蕾和去花发现,棉铃更多地在顶端以及果枝远端产生,但棉花单株铃数和产量与对照相比无明显差异[11-12]。国外的此类研究多集中于群体和整株水平上的“铃-叶”关系分析,对于更为精细的基于独立的“单铃(蕾)-对位叶”及蕾铃脱落后源能力动态变化等精细生理层面上的研究几无报道。国内有少量关于无铃果枝叶的生理学研究,但有限的报道中对无铃果枝叶作为“辅助源”的功能及其源能力的变化趋势及存在较大分歧。陈源等[6]认为,无铃果枝叶中可溶性糖含量比有铃果枝叶要高,且其光合生产效率和光合产物转运速率要比无铃对位叶更低,源能力很低;孙红春等[13]则认为,减库处理造成果枝叶中可溶性糖、淀粉含量增加,但单个棉铃的库容相对增大,说明无铃果枝叶“辅助源”功能显著。【本研究切入点】目前许多研究都发现,蕾铃脱落后其对位果枝叶对其邻位蕾铃的生长发育具有积极作用,但蕾铃脱落后无铃果枝叶源能力变化特征及原因尚不明确。【拟解决的关键问题】本研究为减少多源多库间复杂的物质传递、信息串扰对研究结果产生的影响,在采用韧皮部化学阻断[14-15]独立出“同果枝铃(蕾)-叶系统”的条件下,通过人工去库来模拟蕾铃脱落,分析了蕾铃脱落后果枝叶碳水化合物积累及内源激素变化对叶源能力产生的影响,探讨了无铃果枝叶作为“辅助源”的源能力变化特征及其调节机制,为丰富棉花蕾铃脱落调控理论和棉花补偿性调控栽培技术研发提供理论依据。
1 材料与方法
1.1 试验设计
试验于2021年在江苏南京(118°50′E,32°02′N)南京农业大学牌楼试验站进行。该区域土壤属于黄棕壤土,呈弱酸性(pH=6.7),0—20 cm土层的基础土壤数据分别为速效氮15.16 mg·kg-1、速效磷17.55 mg·kg-1、速效钾138.45 mg·kg-1,有机质11.12 g·kg-1,全氮0.91 g·kg-1。
供试品种为中棉425,分别于2021年5月10日、6月1日,在试验区田间进行直播,田间管理按高产栽培要求进行。当棉株第四果枝第一果节开花时对四、五、六果枝进行果枝韧皮部阻断及去库处理,韧皮部阻断采用的试剂为15%三氯乙酸,将试剂均匀滴在棉片上,用棉片包裹住果枝40—60 min后取下棉片。试验处理如图1所示,以果枝韧皮部阻断处理(留蕾/花)的对位叶片作对照(CK),去库(defruiting,DF)处理为果枝韧皮部阻断+去蕾/花。果枝韧皮部阻断旨在将果枝与其他植物器官有效隔离,形成独立的“同果枝铃(蕾)-叶系统”以减少不可控因素对本研究结果产生的干扰。

图1 试验处理示意图
1.2 测定内容与方法
1.2.1 气象资料 图2为棉花生长季试验地气象资料(气象数据来源于南京市气象站),播期1和2棉花的第四果枝第一果节开花时间分别为2021年7月19日和8月3日。播期1和2棉花的取样时间分别为2021年7月19日—7月24日和8月3日—8月8日。
1.2.2 棉花对位叶比叶重的测定 分别于处理后0、1、3和5 d取长势一致且有代表性棉株的对位叶,每个处理各果枝对位叶均取3片,并将取得的叶片放入冰盒中,立即带回实验室,进行清洗、分样。去除叶片主叶脉后,一半叶片放入-80℃冰箱,用于后续指标测定,另一半叶片,放入Li-3100叶面积仪(Li-Cor 公司,美国)中进行叶面积测量,测量结束后放入105℃烘箱杀青0.5 h,并于70℃烘干至恒重。烘干后计算比叶重(specific leaf weight,SLW),公式如下:
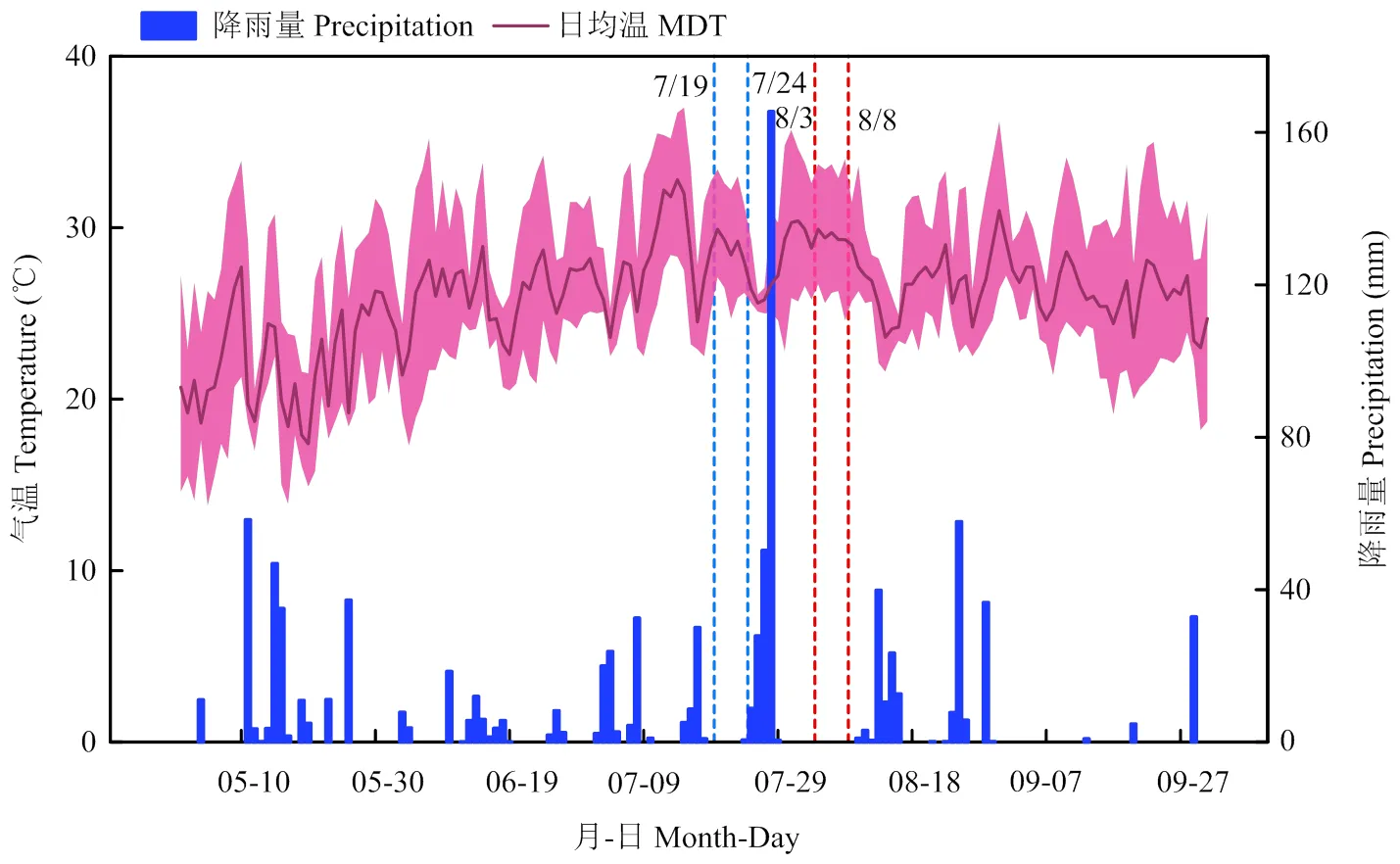
蓝色和红色虚线分别表示播期1和2棉花的取样时间
比叶重(g/cm2)=干重/叶面积。
1.2.3 气体交换参数的测定 采用Li-6400XT(Li-Cor 公司,美国)便携式光合仪进行叶片气体交换参数的测定。使用开放式气路,仪器参数设定为:光合有效辐射(PAR)1 500 μmol·m-2·s-1,流速为300 μmol·s-1。记录净光合速率(n)、气孔导度(s)、蒸腾速率(r)等参数。
1.2.4 叶绿素及花青素含量的测定 叶绿素含量测定参照Arnon[16]的方法,采用丙酮和无水乙醇的混合液(体积比1﹕1)于黑暗中浸提至叶片完全变白。用紫外可见分光光度计测定663 nm及645 nm吸光值,并按照公式计算叶绿素浓度。
花青素含量测定参照袁明等[17]的方法,以1%盐酸甲醇作为提取液,用紫外可见分光光度计测定652 nm及530 nm吸光值,计算公式为A=A530-0.25A652,其中A为花青素相对含量(色素单位)。
1.2.5 碳水化合物及游离氨基酸含量测定 采用蒽酮比色法[18]测定可溶性糖、淀粉含量;间苯二酚比色法[19]测定果糖、蔗糖含量;酶制剂法[19]测定葡萄糖含量;半微量法[20]定纤维素含量;采用茚三酮比色法[21]测定叶片游离氨基酸含量。
1.2.6 内源激素含量测定 参照Pan等[22]的方法使用液相色谱串联质谱仪测定ABA(脱落酸)、生长素(IAA)、赤霉素(GA3)、茉莉酸(JA)、水杨酸(SA)含量。
1.3 数据统计与分析方法
采用Excel 2019进行相关指标的计算,SPSS 25.0进行差异显著性分析(LSD法),Origin 2021进行线性回归分析及图表的绘制。
2 结果
2.1 去库果枝叶叶色及比叶重变化
去库处理5 d后,对照组叶片并未见明显叶色变化,去库组叶片则出现明显的花青素积累,局部呈现紫红色且主要位于叶片边缘位置(图3-A)。通过对叶片中花青素含量测定后发现,去库后对位叶花青素含量较对照提高了约2倍(图3-C)。说明糖积累显著促进了叶片中次生代谢物质的合成。
去库处理引起的糖积累显著增加了对位叶的比叶重,且随着处理天数的增加比叶重的增幅逐渐增大,两播期趋势相一致。播期1、2对位叶的比叶重较对照的最大增幅分别为53.8%、43.6%(图3-B)。说明去库后果枝叶中的干物质不断累积。
2.2 去库果枝叶气体交换参数变化
如图4所示,去库处理引起的糖积累显著降低了对位叶的净光合速率、气孔导度及蒸腾速率,两播期结果一致,但降低程度略有不同,播期1、2对位叶的上述3种指标较对照的最大降幅分别为81.4%、76.3%、68.6%和89.2%、95.2%、92.0%。说明库强减弱导致的光合产物积累反馈抑制了叶片的净光合速率,降低了光合产物的合成能力。

*表示不同处理在0.05水平上差异显著;**表示线性回归方程在0.01水平上显著。下同

图4 糖积累后果枝叶气体交换参数的变幅
2.3 去库果枝叶叶绿素含量变化
如图5所示,去库处理引起的糖分积累显著降低了对位叶总叶绿素、叶绿素a及叶绿素b含量,且随着处理天数的增加,总叶绿素、叶绿素a及叶绿素b含量的降幅不断变大,两播期上述3种指标较对照的最大降幅分别为41.8%、44.7%、34.2%和25.4%、25.8%、27.8%。说明糖分积累的同时会减少叶片中的叶绿素含量,影响叶片对于光能的捕获、利用。

图5 糖积累后果枝叶叶绿素的变幅
2.4 去库果枝叶碳水化合物含量的变化
去库处理后果枝叶中果糖、蔗糖、淀粉、纤维素含量显著增加,葡萄糖含量却显著下降。去库后1 d,以淀粉含量的增幅为最大,纤维素含量增幅则在去库3 d后明显变大,两播期结果一致。去库后5 d,蔗糖、纤维素、淀粉含量的增幅较大,而果糖与可溶性糖的增幅相对较小,两播期趋势相同。此外,去库后播期1对位叶蔗糖、淀粉、纤维素含量较对照的增幅呈先升高后下降的趋势,并于去库后3 d达到极大值(图6-B-1);播期2对位叶蔗糖、淀粉、纤维素含量的增幅则在去库后5 d内不断增大(图6-B-2)。这可能由播期1对位叶中糖累积速率要大于播期2导致,进而造成播期1对位叶的比叶重增幅大于播期2。
2.5 去库果枝叶物质分配形式的变化
去库处理后,对位叶的糖类物质分配形式发生了显著变化(图7)。去库组对位叶的还原性糖/非还原性糖较对照不断减小,表明糖分的积累以非还原性糖为主;蔗糖/可溶性糖不断增加,说明蔗糖含量的增加是可溶性糖含量升高的主要原因,同时可溶性糖也在向淀粉不断转化;淀粉/蔗糖呈上升趋势,说明去库后更多的光合产物向淀粉方向分配;多聚糖/低聚糖呈先减后增的趋势,去库前期(3 d内)多聚糖/低聚糖略小于对照,而3 d后,多聚糖/低聚糖较对照迅速增加,说明此阶段低聚糖快速向多聚糖转化。去库组对位叶C/N则呈现先增后减的趋势,去库3 d内C/N增加,而3 d后C/N较对照减小。
2.6 去库果枝叶蔗糖、淀粉与净光合速率的相关性
对位叶中的淀粉、蔗糖分别作为光合产物主要的储存、运输形式与光合作用关系密切,在去库处理导致光合产物积累的条件下,将淀粉、蔗糖与净光合速率进行相关性分析后发现,淀粉、蔗糖与对位叶净光合速率呈显著负相关(表1),表明净光合速率的降低另一方面是由光合产物的负反馈调节所致。

图6 果枝叶碳水化合物含量的变幅

图7 糖积累后果枝叶碳、氮物质比值的变幅

表1 果枝叶蔗糖、淀粉与净光合速率的相关性分析
*表示2个指标在0.05水平上显著相关(n=8,R0.05=0.707,R0.01=0.834)
* indicates that the two indicators are significantly correlated at 0.05 probability level (n=8, R0.05=0.707, R0.01=0.834)
2.7 去库果枝叶内源激素含量及平衡关系的变化
去库处理后,对位叶中ABA含量呈上升趋势且显著高于对照;IAA含量则呈先升后降的趋势,去库后短时间(3 d)内显著高于对照,3 d后则显著低于对照;GA3含量在去库处理后也显著低于对照,而SA与JA含量则在去库后5 d显著高于对照(图8)。
叶片内源激素的动态平衡在去库后被打破。ABA/IAA、JA/IAA呈现先减后增的趋势,在去库前期(3 d内)减小,3 d后增大,ABA/GA3、JA/GA3则持续增大。去库后5 d对位叶ABA/IAA、JA/IAA、 ABA/GA3、JA/GA3较对照的增幅分别为207.2%、175.1%、345.3%、297.9%(图9)。
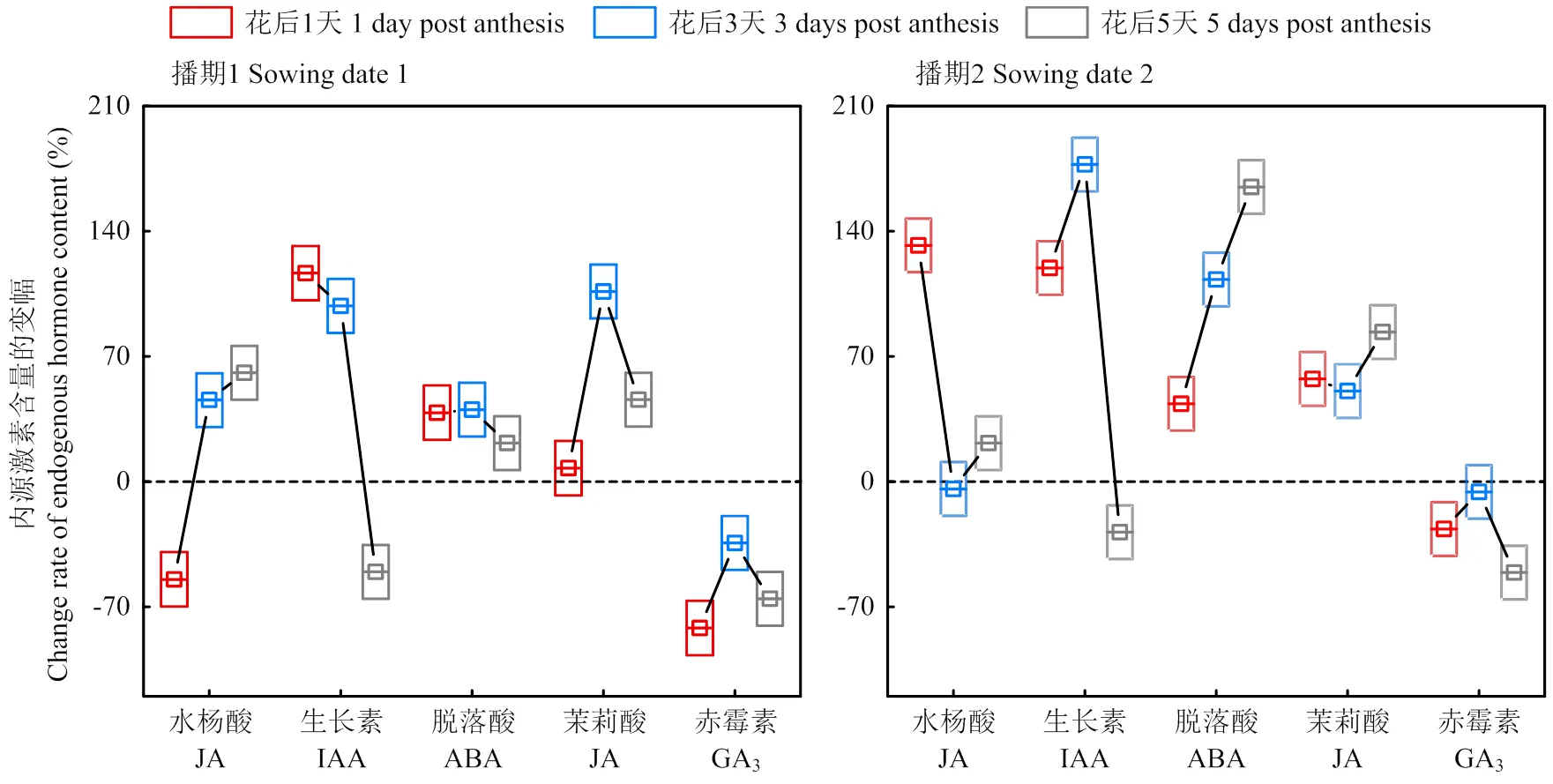
图8 糖积累时果枝叶内源激素含量的变幅

图9 糖积累时果枝叶内源激素比值的变幅
3 讨论
3.1 无铃果枝叶碳、氮代谢改变对源能力的影响
源器官合成的光合产物是作物生长和产量、质量形成的物质基础[23],许多研究表明,库强对源器官的糖分累积、同化物运输与分配具有调动作用,蕾铃脱落会引起植物源叶中碳水化合物积累,同时伴随光合速率降低,从而造成源能力的下降[24-26]。本研究中,蕾铃脱落(库强减弱)后,淀粉在无铃果枝叶中优先积累,蔗糖也大量累积,可溶性糖含量的升高主要归因于蔗糖含量的升高。葡萄糖则是维持叶片生长代谢主要消耗的能源物质。植物细胞壁也能够作为“库”在一定程度上影响库强度[27],本研究中,非结构性碳水化合物积累到一定水平后,结构性碳水化合物(如纤维素)开始大量合成,说明此时叶肉细胞壁充当了“库”的角色,接收了部分冗余的糖分。从叶中糖分配形式来看,蕾铃脱落后非还原性糖是糖分积累的主要形式,光合产物更多地向淀粉分配;当低聚糖累积一定量后,其快速向多聚糖转化;叶片中先升后降的可溶性糖/可溶性氨基酸(C/N)也与糖分配形式的变化有关。
糖类物质(淀粉、蔗糖、纤维素)的积累造成叶片单位面积干物重显著增加。于岩等[28]的去果及枝条环剥试验表明去果显著降低了叶片的净光合速率,增加了可溶性糖含量,蔡贵芳等[29]的研究发现去果降低库强,减少光合产物向果实的运输与分配后,叶片中淀粉含量显著提高。本研究结果与其相似,但本研究进一步阐明了无铃果枝叶光合速率下降的原因及果实脱落后其光合能力、源能力的动态变化趋势。
叶片净光合速率的显著降低一方面是由叶绿素的部分降解引起,另一方面是由光合产物的反馈抑制导致,大量淀粉在叶绿体内累积会导致叶绿体变形,降低光化学反应的光子数量和叶肉导度,进而造成净光合速率降低[30],无铃果枝叶合成光合产物的能力减弱,辅助源能力下降。此外,对位叶花青素的显现也是糖分积累过度的一种表现。
棉铃干物质的积累与同果枝叶的碳氮代谢关系密切,而C/N是果枝叶碳氮代谢状况的直观体现,其对棉铃干物质积累起到重要作用[31-32]。本研究中,当低聚糖积累时(蕾铃脱落后1—3 d),无铃果枝叶中C/N较高,碳代谢较为旺盛,叶片中蔗糖含量的短期升高能够促进光合产物的输出[33],改善辅助源能力,提高邻位铃干物质积累能力及成铃率;而当糖分的过度累积尤其是多聚糖大量合成时(脱落3 d后),C/N降低,蛋白质与氨基酸平衡向氨基酸方向移动,蛋白质整体有降解趋势,低聚态氮含量增加,将降低光合产物的转运势能,使得光合产物向库器官分配受抑制,辅助源能力下降,对邻位铃铃重增加的贡献快速下降。
此外,叶片中的糖类物质还是影响叶片衰老启动及衰老进程的重要信号因子。蔗糖通常在叶片衰老早期不断增加[34],而叶片中淀粉累积能为成熟、衰老的启动提供能量,其他糖类物质则更多的是在衰老进程中发挥作用,如葡萄糖和果糖在叶片衰老起始后含量增加[35],因而在衰老启动前叶片中蔗糖和淀粉含量一般呈上升趋势。本研究发现,脱落后无铃果枝叶蔗糖和淀粉含量持续增加且增幅均相对较大,蔗糖、淀粉的大量积累诱导了叶片的早衰,减弱了棉花产量补偿与自我调节能力。
3.2 无铃果枝叶内源激素平衡变化对源能力的影响
蕾铃脱落后,源库关系的改变对叶片发育及功能发挥产生重要影响,内源激素在叶片同化物转运、器官发育进程中发挥着不可忽视的作用[36-37]。有研究认为,在一定浓度范围内,IAA能够促进叶片中蔗糖合成并向韧皮部装载,ABA则有利于同化物输出及其向生殖器官分配[27, 38]。Setter等[39]的试验表明去果或叶柄环剥使得源叶中ABA含量增加,光合能力下降,本研究结果与其相一致。本研究中,蕾铃脱落后1—3 d,即无铃果枝叶中低聚糖积累,碳代谢旺盛时,光合产物积累导致ABA和IAA含量均升高,同时ABA/IAA较对照降低,此时能促进叶片光合产物向韧皮部中的装载,叶片有着较高的同化物转运潜力,有利于辅助源能力的短期提高,促进光合产物向“补偿库”分配;而脱落3 d后,即叶片中低聚糖向多聚糖快速转化时,ABA含量持续增加,但IAA含量开始降低,导致ABA/IAA大幅升高,不利于光合产物的装载与运输,辅助源能力有减弱的趋势。
在叶片衰老启动后,ABA含量不断增加;衰老的保卫细胞和叶肉细胞中衰老相关蛋白NAP和SAG113都受到ABA的调控[40-41],这都说明ABA能够促进叶片衰老;而JA可以通过诱导衰老特异性基因的表达以及抑制Rubisco活化酶的转录翻译来促进叶片衰老[42];外源GAs的应用能够有效抑制叶片中叶绿素及相关蛋白的降解,降低氧自由基含量,从而显著抑制植株地上部衰老[43]。本研究中,蕾铃脱落后5 d,无铃果枝叶中ABA、JA含量较对照显著增加,而GA3含量较对照显著降低,同时ABA/GA3、JA/ GA3较对照大幅上升,造成叶绿素降解加快,加剧了叶片的早衰,进一步缩短了“辅助源”功能期。
基于上述研究结果,在棉田发生蕾铃大量脱落的初期,应充分发挥无铃果枝叶“辅助源”功能,采用水肥管理或化学调控等措施减少脱落,促进蕾花发育,增加库容。蕾铃大量脱落15 d左右后,应采用化控等手段延缓功能叶早衰,延长果枝叶功能期,为邻位铃的生长发育提供良好的物质基础,增加邻位铃的成铃率及铃重,弥补脱落造成的产量损失。而对于脱落较久(约30 d以上)的无铃果枝叶可去除,来提高冠层通风透光性。
4 结论
蕾铃脱落后的初期,果枝叶中糖分快速累积且主要以不活跃、可运输的非还原性糖(淀粉、蔗糖)形式累积,同时C/N的增加、ABA/IAA的减小也有利于同化物的外运,此时,其“辅助源”活性很强。随着蕾铃等库器官脱落天数的增加,无铃叶片中光合产物的累积不仅反馈抑制其光合能力,同时光合产物向不可往外转运的多聚糖(淀粉、纤维素)形式分配比例升高,源活力不断下降;此外,累积的糖还作为衰老信号诱导叶片叶绿素降解,降低维持叶片活力的GA3、IAA含量,加速衰老相关物质(花青素、低聚态氮有机物、ABA、JA)的形成,不仅导致其“辅助源”能力持续下降,而且缩短其功能期。综上,无铃/蕾果枝叶衰老加速、功能期缩短,仅可在蕾铃脱落后的较短时间内发挥着较强的“辅助源”作用。
[1] 中国农业科学院棉花研究所. 中国棉花栽培学. 上海: 上海科学技术出版社, 2019: 236-238.
Instituteof Cotton Researchof Chinese Academy of Agricultural Sciences. Cotton Cultivation in China. Shanghai: Shanghai Scientific & Technical Press, 2019: 236-238. (in Chinese)
[2] KAUL A, DEOL J, BRAR A S. Within-plant yield distribution in Bt cotton following fruiting form removal. Journal of Crop and Weed, 2017, 13(2): 73-78.
[3] SADRAS V O. Compensatory growth in cotton after loss of reproductive organs. Field Crops Research, 1995, 40(1): 1-18.
[4] DALE J E. Some effects of the continuous removal of floral buds on the growth of the cotton plant. Annals of Botany, 1959, 23(4): 636-649.
[5] ASHLEY D A.14C-labelled photosynthate translocation and utilization in cotton plants. Crop Science, 1972, 12(1): 69-74.
[6] 陈源, 顾万荣, 王汝利, 陈德华, 王余龙, 吴云康. 棉花叶系质量划分及叶层配置的研究. 棉花学报, 2004, 16(5): 313-318.
CHEN Y, GU W R, WANG R L, CHEN D H, WANG Y L, WU Y K. Studies on classification of the leaf systematic quality and leaf area distribution in cotton. Acta Gossypii Sinica, 2004, 16(5): 313-318. (in Chinese)
[7] GUINN G. Abscission of cotton floral buds and bolls as influenced by factors affecting photosynthesis and respiration. Crop Science, 1974, 14(2): 291-293.
[8] KLETTER E, WALLACH D. Effects of fruiting form removal on cotton reproductive development. Field Crops Research, 1982, 5: 69-84.
[9] KERBY T A, BUXTON D R. Competition between adjacent fruiting forms in cotton. Agronomy Journal, 1981, 73(5): 867-871.
[10] CONSTABLE G A. Mapping the production and survival of fruit on field-grown cotton. Agronomy Journal, 1991, 83(2): 374-378.
[11] JONES M A, WELLS R, GUTHRIE D S. Cotton response to seasonal patterns of flower removal: II. Growth and dry matter allocation. Crop Science, 1996, 36(3): 639-645.
[12] BEDNARZ C W, ROBERTS P M. Spatial yield distribution in cotton following early-season floral bud removal. Crop Science, 2001, 41(6): 1800-1808.
[13] 孙红春, 李存东, 张月辰, 路文静. 棉花源库比对中、下部果枝叶生理活性及铃重的影响. 作物学报, 2008, 34(8): 1459-1463.
SUN H C, LI C D, ZHANG Y C, LU W J. Effects of source/sink ratio on boll weight and physiological activities of leaves at middle and lower fruiting branches in cotton. Acta Agronomica Sinica, 2008, 34(8): 1459-1463. (in Chinese)
[14] 黄劭理, 周冀衡, 邱尧, 李爽. 韧皮部化学损伤对烤烟生长及烟碱、钾素积累的影响. 湖南农业科学, 2015(9): 79-82.
HUANG S L, ZHOU J H, QIU Y, LI S. Effects of phloem chemical damage on tobacco growth, nicotine and K accumulation. Hunan Agricultural Sciences, 2015(9): 79-82. (in Chinese)
[15] 徐文正. 不同热敏感性棉花品种棉铃对位叶源能力对花铃期短期高温胁迫的响应差异[D]. 南京: 南京农业大学, 2019.
XU W Z. Response of subtending leaf source capability of cotton cultivars to shortterm high temperature stress during flowering and boll-forminging stage[D]. Nanjing: Nanjing Agricultural University, 2019. (in Chinese)
[16] Arnon D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in beta vulgaris. Plant physiology, 1949, 24(1): 1-15.
[17] 袁明, 万兴智, 杜蕾, 袁澍, 林宏辉. 红花檵木叶色变化机理的初步研究. 园艺学报, 2010, 37(6): 949-956.
YUAN M, WAN X Z, DU L, YUAN S, LIN H H. Mechanism on leaf color transformation ofolive var.. Acta Horticulturae Sinica, 2010, 37(6): 949-956. (in Chinese)
[18] LIU J R, MA Y N, LV F J, CHEN J, ZHOU Z G, WANG Y H, ABUDUREZIKE A, OOSTERHUIS D M. Changes of sucrose metabolism in leaf subtending to cotton boll under cool temperature due to late planting. Field Crops Research, 2013, 144: 200-211.
[19] 张志良, 瞿伟菁, 李小方. 植物生理学实验指导. 4版. 北京: 高等教育出版社, 2009: 106-108.
ZHANG Z L, QU W J, LI X F. Experimental Instruction of Plant Physiology. 4th ed. Beijing: Higher Education Press, 2009: 106-108. (in Chinese)
[20] UPDEGRAFF D M. Semimicro determination of cellulose inbiological materials. Analytical Biochemistry, 1969, 32(3): 420-424.
[21] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 192-197.
LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment. Beijing: Higher Education Press, 2000: 192-197. (in Chinese)
[22] PAN X Q, WELTI R, WANG X M. Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatography-mass spectrometry. Nature Protocols, 2010, 5(6): 986-992.
[23] 陈年来. 作物库源关系研究进展. 甘肃农业大学学报, 2019, 54(1): 1-10.
CHEN N L. Research advances on source-sink interaction of the crops. Journal of Gansu Agricultural University, 2019, 54(1): 1-10.(in Chinese)
[24] FOYER C. Feedback inhibition of photosynthesis through source- sink regulation in leaves. Plant Physiology and Biochemistry, 1988, 26: 483-492.
[25] FABRE D, YIN X Y, DINGKUHN M, CLÉMENT-VIDAL A, ROQUES S, ROUAN L, SOUTIRAS A, LUQUET D. Is triose phosphate utilization involved in the feedback inhibition of photosynthesis in rice under conditions of sink limitation? Journal of Experimental Botany, 2019, 70(20): 5773-5785.
[26] 张国伟, 李凯, 李思嘉, 王晓婧, 杨长琴, 刘瑞显. 减库对大豆叶片碳代谢的影响. 作物学报, 2022, 48(2): 529-537.
ZHANG G W, LI K, LI S J, WANG X J, YANG C Q, LIU R X. Effects of sink-limiting treatments on leaf carbon metabolism in soybean. Acta Agronomica Sinica, 2022, 48(2): 529-537. (in Chinese)
[27] KUMAR R, BISHOP E, BRIDGES W C, THARAYIL N, SEKHON R S. Sugar partitioning and source-sink interaction are key determinants of leaf senescence in maize. Plant, Cell & Environment, 2019, 42(9): 2597-2611.
[28] 于岩, 孙秀波, 车远远, 辛秀琛. 去果、枝条环剥和新梢套袋后桃树叶片可溶性糖含量的变化对光合作用的影响. 西北农业学报, 2011, 20(3): 168-174, 179.
YU Y, SUN X B, CHE Y Y, XIN X C. Effects of fruit removal, shoot girdling and new shoot bagging on leaf soluble sugar content and photosynthesis of peach leaves. Acta Agriculturae Boreali-occidentalis Sinica, 2011, 20(3): 168-174, 179. (in Chinese)
[29] 蔡贵芳, 刘艳, 白立华, 杜瑞霞, 陈聪. 去果河套蜜瓜源叶碳水化合物及其相关酶昼夜变化特征. 西北植物学报, 2012, 32(9): 1774-1780.
CAI G F, LIU Y, BAI L H, DU R X, CHEN C. Day and night variations of carbohydrate contents and activities of related enzymes in source leaves of defruitingL. cv. Hetao. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(9): 1774-1780. (in Chinese)
[30] GRUB A, MACHLER F. Photosynthesis and light activation of ribulose 1,5-bisphosphate carboxylase in the presence of starch. Journal of Experimental Botany, 1990, 41(10): 1293-1301.
[31] MOLL R H, JACKSON W A, MIKKELSEN R L. Recurrent selection for maize grain yield: Dry matter and nitrogen accumulation and partitioning changes. Crop Science, 1994, 34(4): 874-881.
[32] 胡宏标, 张文静, 陈兵林, 王友华, 束红梅, 周治国. 棉铃对位叶C/N的变化及其与棉铃干物质积累和分配的关系. 作物学报, 2008, 34(2): 254-260.
HU H B, ZHANG W J, CHEN B L, WANG Y H, SHU H M, ZHOU Z G. Changes of C/N ratio in the subtending leaf of cotton boll and its relationship to cotton boll dry matter accumulation and distribution. Acta Agronomica Sinica, 2008, 34(2): 254-260. (in Chinese)
[33] 贺明荣, 王振林, 曹鸿鸣. 源库关系改变对小麦灌浆期植株光合速率及14C同化物运转分配的影响. 西北植物学报, 1998, 18(4): 555-560.
He M R, Wang Z L, Cao H M. Effect of source sink manipulation on photosynthetic rate and partitioning of14C assimilate during grain filling in winter wheat plant. Acta Botanica Boreali-Occidentalia Sinica, 1998, 18(4): 555-560. (in Chinese)
[34] WINGLER A, PURDY S, MACLEAN J A, POURTAU N. The role of sugars in integrating environmental signals during the regulation of leaf senescence. Journal of Experimental Botany, 2006, 57(2): 391-399.
[35] KIM J. Sugar metabolism as input signals and fuel for leaf senescence. Genes & Genomics, 2019, 41(7): 737-746.
[36] GUINN G, DUNLAP J R, BRUMMETT D L. Influence of water deficits on the abscisic acid and indole-3-acetic acid contents of cotton flower buds and flowers. Plant Physiology, 1990, 93(3): 1117-1120.
[37] 段留生, 何钟佩. 源库关系改变对棉叶内源激素的影响. 西北植物学报, 1999, 19(6): 116-121.
DUAN L S, HE Z P. Effect of alteration of source-sink relationship on endogenous hormones in cotton leaves. Acta Botanica Boreali- Occidentalia Sinica, 1999, 19(6): 116-121. (in Chinese)
[38] Davies P J. Plant Hormones: Physiology, Biochemistry and Molecular Biology. Dordrecht Netherlands: Kluwer Academic Publishers, 1995: 39-45.
[39] Setter T L, Brun W A, Brenner M L. Effect of obstructed translocation on leaf abscisic Acid, and associated stomatal closure and photosynthesis decline. Plant Physiology, 1980, 65(6): 1111-1115.
[40] ZHANG K W, GAN S S. An abscisic acid-AtNAP transcription factor-SAG113 protein phosphatase 2C regulatory chain for controlling dehydration in senescingleaves. Plant Physiology, 2012, 158(2): 961-969.
[41] ZHANG K W, XIA X Y, ZHANG Y Y, GAN S S. An ABA-regulated and Golgi-localized protein phosphatase controls water loss during leaf senescence in. The Plant Journal, 2012, 69(4): 667-678.
[42] HU Y R, JIANG Y J, HAN X, WANG H P, PAN J J, YU D Q. Jasmonate regulates leaf senescence and tolerance to cold stress: crosstalk with other phytohormones. Journal of Experimental Botany, 2017, 68(6): 1361-1369.
[43] YU K, WEI J R, MA Q, YU D, LI J R. Senescence of aerial parts is impeded by exogenous gibberellic acid in herbaceous perennial Paris polyphylla. Journal of Plant Physiology, 2009, 166(8): 819-830.
Effects of Squares and Bolls Abscission on Photosynthate Accumulation and Its Strength as an Auxiliary Source of Cotton Sympodial Leaves

College of Agriculture, Nanjing Agricultural University/Key Laboratory of Crop Ecophysiology and Management, Ministry of Agriculture and Rural Affairs/Jiangsu Collaborative Innovation Center for Modern Crop Production (JCIC-MCP), Nanjing 210095
【Objective】The abscission rate of squares and bolls is often more than 60%, and the sympodial leaves after squares and bolls shedding are often used as “auxiliary sources” to play an important role in the development of adjacent bolls. In order to enrich the “source-sink” regulation theory and provide theoretical basis for the regulation of cotton yield compensatory development, the activity changing characters of the “auxiliary sources” was explored after the shedding of their squares or bolls.【Method】In this study, two sowing dates (May 10 and June 1, 2021) of Zhongmian 425 were used to carry out a field experiment at the Pailou Experimental Station of Nanjing Agricultural University in Nanjing, Jiangsu province (118° 50′ E, 32° 02′ N). Under the conditions of fruiting branch phloem blocking, the changes of related indicators of leaf source capacity, such as cotton sympodial leaves morphological characteristics, gas exchange parameters, carbon and nitrogen substances and endogenous hormone content, were studied after defruiting (isolate the “source-sink” system on the first node at the fourth, fifth or sixth fruiting branches by chemical blocked the phloem, and then simulated the boll abscission condition by manual remove the bud or young bolls of the system) .【Result】(1) the defruiting treatment significantly increased the content of fructose, sucrose, starch and cellulose in sympodial leaves, but significantly decreased the glucose content. With the extension of time, the increase of starch was the largest at 1 day after treatment (DAT), while that of cellulose was significantly larger at 3 DAT and that of sucrose, cellulose and starch was relatively larger at 5 DAT. (2) After treatment, carbohydrates accumulated more in the form of non-reducing sugars; photosynthates were more distributed to starch; polysaccharides/oligosaccharides decreased at first and then increased; while the C/N of sympodial leaves increased at first and then decreased. (3) The defruiting treatment significantly decreased the net photosynthetic rate and chlorophyll content of sympodial leaves. (4) The sympodial leaves showed purplish red locally, and compared with the control, the anthocyanin content increased by about 2 times. (5) After treatment, the content of ABA, JA, SA in sympodial leaves significantly increased compared with the control, and the content of IAA increased at first and then decreased, while the content of GA3was significantly lower than the control. (6) The dynamic balance of endogenous hormones in sympodial leaves changed after treatment: ABA/IAA and JA/IAA decreased at first and then increased, while ABA/GA3and JA/GA3increased continuously. 【Conclusion】After squares and bolls shedding, the forms of sugar accumulation and distribution as well as endogenous hormone signals in sympodial leaves changed significantly and had a significant effect on source capacity. In a short period of time (1-3 days), the overall content of sugars in sympodial leaves increased, especially the accumulation of non-reducing sugars, and the source capacity strengthen rapidly. However, with the passage of time, the enhancement of source capacity diminished, and the leaves had a tendency of senescence, while chlorophyll degradation accelerated. That was, after abscission, the “auxiliary source” function of the sympodial leaves increased rapidly in a short period of time (about 3 days), then decreased rapidly, and made limited contribution to the development of the adjacent bolls in the later stage.
cotton; squares and bolls shedding; phloem blocking; sugar; hormone
:2022-08-08;
2022-10-12
国家自然科学基金(31871574)
阚家强,E-mail:906308697@qq.com。通信作者王友华,E-mail:w_youhua@njau.edu.cn
10.3864/j.issn.0578-1752.2023.09.004
(责任编辑 杨鑫浩,李莉)
