黄河三角洲盐碱地土壤性质与微生物对石油污染的响应
2023-05-12荆少东刘忠祝威谷梅霞吴磊
荆少东,刘忠,祝威,谷梅霞*,吴磊
黄河三角洲盐碱地土壤性质与微生物对石油污染的响应
荆少东1,2,刘忠2,祝威1,2,谷梅霞1,2*,吴磊1,2
1.中石化石油工程设计有限公司, 山东 东营 257200 2.中国石油化工股份有限公司工程部, 山东 东营 257200
土壤理化性质与微生物组的变化是田间土壤污染风险评估和修复的重要指标。然而,土壤理化性质及微生物组如何响应石油污染尚不清楚。本研究以山东省某油田为研究对象,从运行中和长期废弃的油井附近采集石油污染土壤。研究了土壤理化性质、微生物组和土壤微生物共现网络变化。结果表明,土壤总石油烃、总碳、总氮、总硫和总磷的含量因石油污染而增加。相比对照,两种石油污染持续时间都会降低土壤pH值。另外,石油污染还降低了细菌和真菌的多样性。同时,细菌多样性与土壤总石油烃含量和电导率呈负相关,而真菌多样性仅与土壤电导率呈负相关。此外,石油污染增加了土壤中变形菌门、子囊菌门、油杆菌属和镰刀菌属的相对丰度。最后,石油污染土壤微生物网络的节点数、连接数和模块化系数均下降。短期的重度石油污染会导致土壤理化性质和微生物组发生变化,并驱动形成低复杂程度和脆弱的土壤微生物网络。且自然恢复很难还原土壤性质和微生物网络结构。
盐碱土;土壤微生物; 石油污染
随着全球人口增长和石油产品的大量使用,石化产业不断发展,而在石油生产、运输、使用和泄漏过程中将会造成海洋和陆地环境污染[1]。由于石油烃的成分复杂、生物毒性大、生物可利用性低等特点,其泄露将对土壤、地下水和区域生态环境造成严重危害[2,3]。
土壤微生物在物质循环和能量流动中起至关重要的作用,如碳、氮和磷的生物地球化学循环。此外,当土壤受到污染时,微生物群落会产生响应。目前,许多研究针对石油烃或有机污染物影响的土壤、水和沉积物中的微生物群落[4,5]。例如,Paisse S等[6]发现,湖泊沉积物细菌群落的结构组成与湖泊中的石油污染梯度相关。且石油烃降解菌丰度不随污染物含量的增加而提升。相反,一项基于国内石油污染场地微生物群落的研究发现,污染土壤中的石油降解微生物比清洁土壤中的石油降解微生物多[7]。然而,很少有研究关注石油污染对土壤微生物群落的长期或短期影响。
微生物并非独立存在于土壤中,而是形成一个复杂的生态相互作用矩阵。除环境因素外,群落相互作用也会影响微生物行为,例如原核生物和真核生物之间的相互作用。当细菌和真菌共存于同一环境中,它们之间必然存在物质和能量交换[8]。最近,部分基于自然环境样本的研究针对性的描述了细菌和真菌群落共存的状态[9,10]。一项基于限制性片段长度多态性数据的网络研究表明,网络中模块显示细菌和真菌群落与土壤特性是紧密相关的[11]。与简单的异质性和结构指数相比,网络模式研究解释了对微生物组合的更丰富的见解。此外,它们填补了我们对微生物群落之间或群落与环境参数(如土壤污染)之间相互作用的知识面空白。然而,目前为止很少有针对石油污染下的土壤微生物互作网络的研究,尤其是在不同污染持续时间下。
本研究以我国山东省某油田为研究对象,探究不同石油污染年限下土壤的理化性质、微生物群落多样性与组成变化,以及微生物共现网络模式。初步探明了土壤理化指标及微生物群落对不同年限石油污染的响应。本研究旨在为土壤石油污染风险提供微生物指示,并为进一步修复工作提供新视野。
1 材料与方法
1.1 土样采集和场地描述
土壤样品采集自山东省东营市河口区某油田的两个油场。在每个场地中,用五点采样法采集了以下三组表层土壤样本(0~20 cm):工作中抽油机一米半径范围内的短期污染土壤(PS),废置抽油机一米半径范围内的长期污染土壤(OS,场地Ⅰ弃置8年,场地Ⅱ弃置10年),以及油田附近的未污染对照土壤(CT)。每组设五个平行,每个平行由五个土芯完全均匀混合而组成。因此,共采集得30个土壤样本(2个场地×3个分组×5个平行)。采集后的土壤样品置于冰上,尽快运送至实验室。过4 mm筛后,部分土壤样品风干,用于测定理化性质。剩余土壤样本储存于-80 ℃等待分子生物学分析。
1.2 土壤理化性质测定
土壤总石油烃(TPH)含量使用超声索氏提取重量法测定[12]。土壤pH值使用pH计测定(土水比1:2.5)。土壤总碳(TC),总氮(TN),及总硫(TS)含量使用元素分析仪测定。土壤总磷(TP)含量在250℃下用H2SO4-HClO4溶液消解后用钼蓝比色法进行测定[13]。土壤电导率(EC)用电导率仪测定。
1.3 土壤微生物群落分析
土壤基因组DNA采用十六烷基三甲基溴化铵(CTAB)法提取。细菌16s rDNA V4-V5高变区用带标签的特异性引物组515F/926R扩增,真菌内部转录间隔2区(ITS2)片段使用引物组ITS7/ITS4扩增。所有聚合酶链反应均使用15 μL体系的Phusion®高保真PCR专用MIX,2 μM正向与反向引物以及约10 ng DNA模板进行。反应程序包括在95 ℃下60 s的初始变性,然后在95 ℃下进行27次10 s循环,57 ℃下持续30ss,72 ℃下进行30 s的延伸,最后在72 ℃下延长10 min。将相同量的1倍TAE缓冲液与PCR产物混合,在2%琼脂糖凝胶上进行电泳检测。然后,使用DNA纯化试剂盒提纯PCR产物。随后,DNA样本在低温下运送至深圳微生态公司进行Illumina双端测序。
1.4 数据处理与分析
在验证了本研究数据集的正态性分布与方差齐性后,利用单因素方差分析与最小差异性检验(LSD)获得了组间土壤理化性质与微生物多样性指数的差异(<0.05)。基于扩增序列变体(ASVs)水平的土壤微生物群落主成分分析(PCA),微生物群落多样性指数与土壤性质间的相关性分析均使用软件版本3.5.1中的vegan包进行。
运用分子生态网络分析来揭示细菌和真菌分类群(相对丰度>0.1%)之间的关系。首先使用R软件(v.3.5.1)中的psych包计算成对微生物间的Spearman相关系数(<0.05),再使用Gephi软件(v.0.9.2)对微生物网络进行可视化。网络中每个节点代表一个微生物分类单元,红线或蓝线分别代表强的正相关或负相关。
2 结果与分析
2.1 土壤理化性质
结果显示,不同石油污染持续时长下土壤理化性质存在显著差异(表1)。与对照相比,石油污染土壤中总石油烃、总碳、总氮、总硫和全磷含量均有提升(<0.05),而土壤pH值则显著降低。对土壤电导率而言,PS土壤显著低于OS土壤,而采样点Ⅰ对照土壤的电导率远高于污染土壤,这与采样点Ⅱ的情况完全相反。
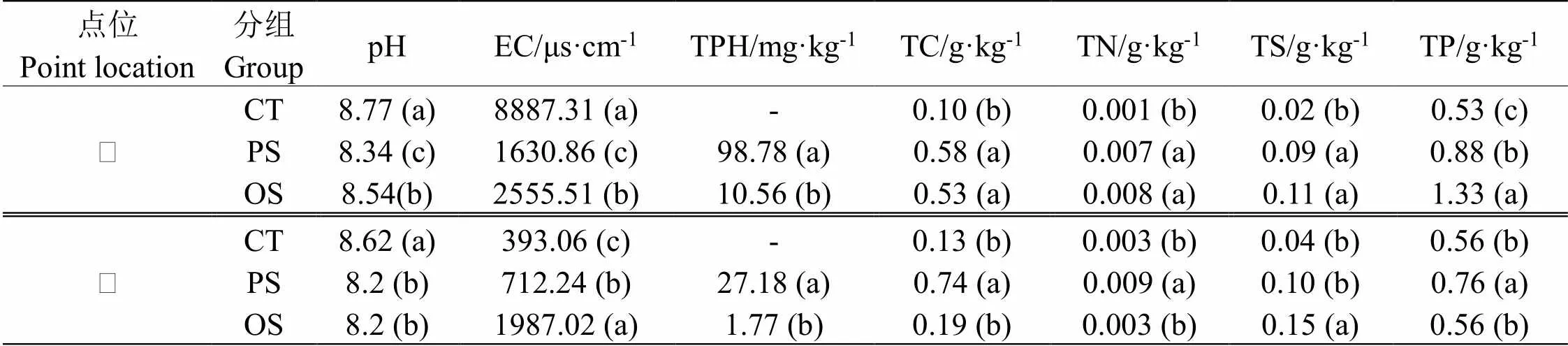
表 1 两个点位下的不同石油污染程度土壤理化性质
注: 数字后不同字母代表组间存在显著性差异(<0.05)。
Note: Different letters after the numbers represent significant differences between groups (<0.05).
2.2 土壤微生物多样性
测序结果表明,三组土壤中细菌和真菌多样性存在显著差异(图1)。在点位Ⅰ,相比于对照,短期石油污染导致土壤细菌多样性显著降低(<0.05),长期污染却无显著影响。点位Ⅱ中,无论长期或短期石油污染均显著降低土壤细菌多样性。对于真菌而言,无论点位Ⅰ或是Ⅱ,长期和短期石油污染均显著降低了土壤真菌多样性。
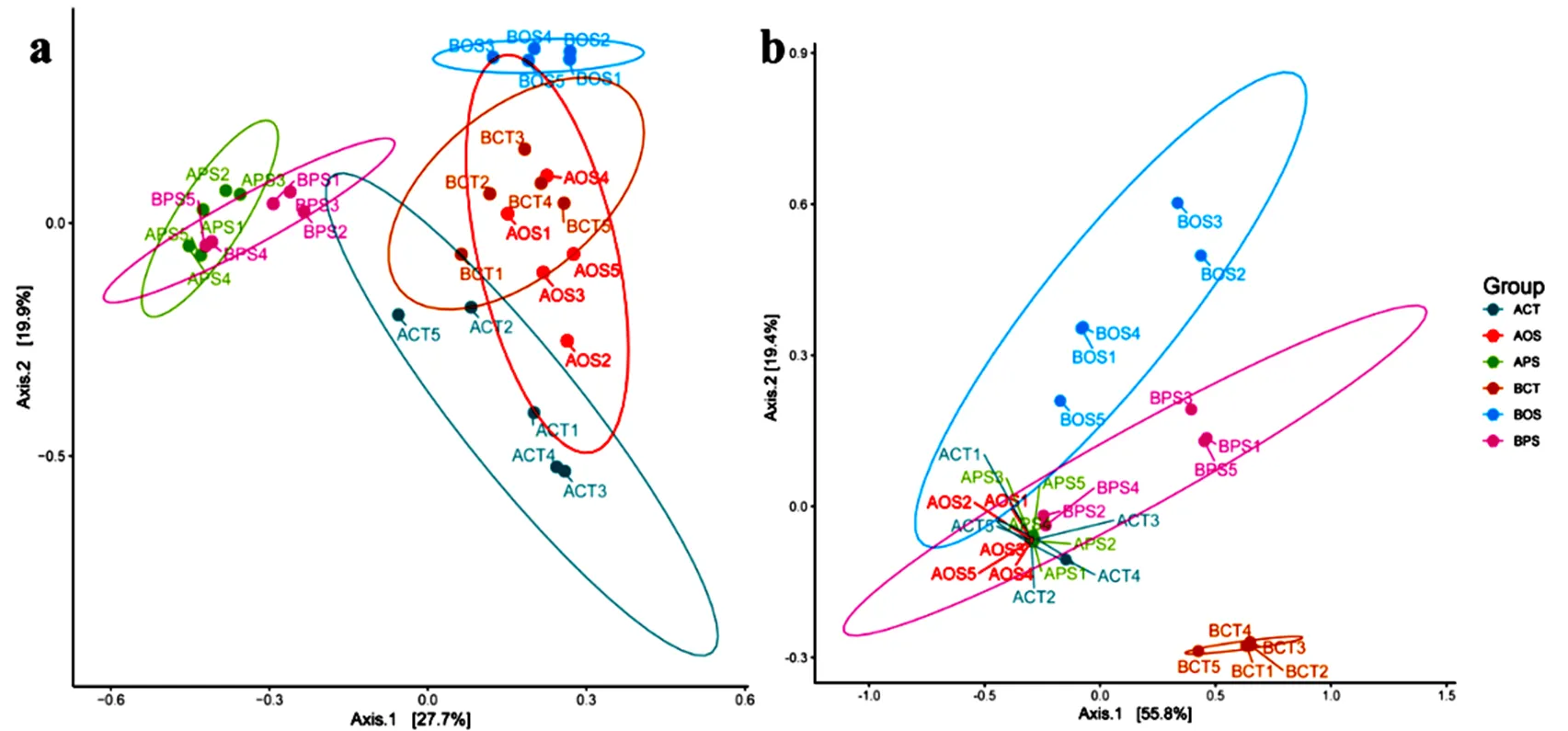
图 1 两个点位下三种土壤的细菌与真菌多样性
主成分分析结果显示(图2),不同组间的土壤微生物群落被显著分隔开。对细菌群落而言,短期污染组与其他组土壤间显著分离,一轴和二轴共解释了47.6%的群落变异。对真菌群落而言,一轴和二轴共解释了75.2%的群落变异。
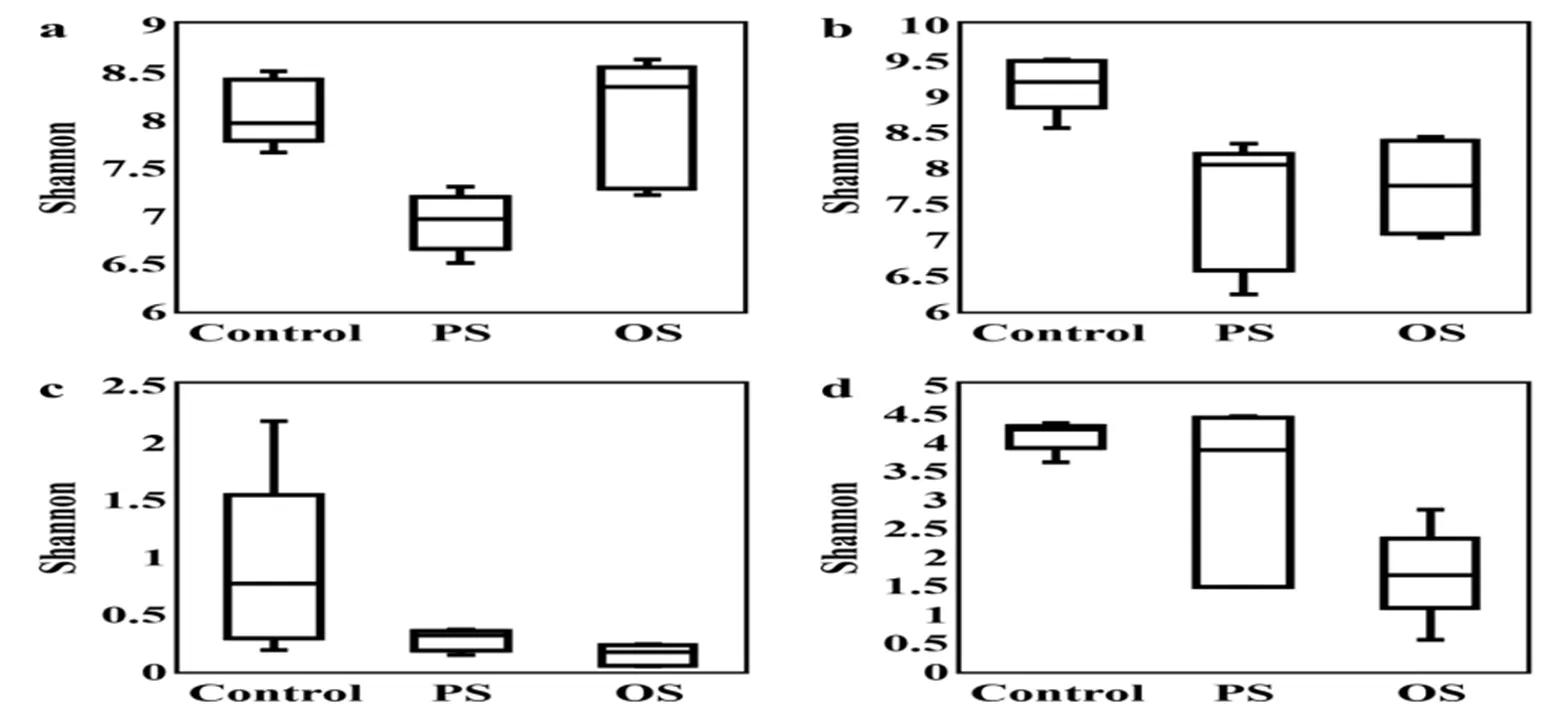
图 2 基于OTU水平的微生物群落结构主成分分析
相关性分析结果表明(表2),细菌的Chao1指数与土壤总石油烃含量和电导率呈负相关(<0.05)。而真菌的Chao1指数与土壤电导率呈负相关(<0.001)。

表 2 土壤理化性质与细菌和真菌群落α多样性指数的相关性分析
2.3 土壤微生物群落组成
测序结果表明,本研究从30个土壤样品中得到了1947305个细菌序列和2631038个真菌序列,它们分别被归类为17295个细菌OTU和1681个真菌OTU。对细菌序列而言,每个样本中98.11%的16s序列被归类为细菌,仅有1.89%的序列被归类为古细菌。另外,变形菌门在所有样品中所占比例最高,平均占总量的77.79%。其他优势细菌包括拟杆菌门(5.02%)、放线菌门(3.95%)、厚壁菌门(3.04%)和芽单胞菌门(2.15%)。对真菌序列而言,100%鉴定为真菌。子囊菌门占优势,平均占总序列的82.58%。其他主要门有被孢霉门(10.61%)和担子菌门(1.88%)。
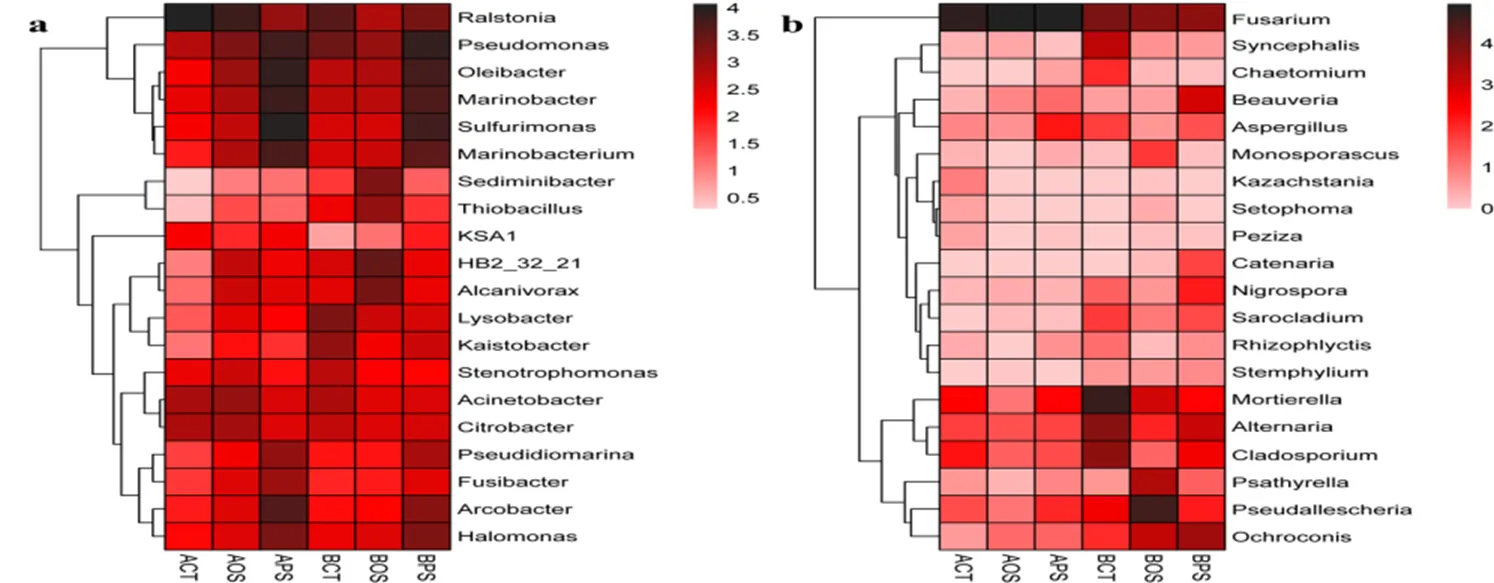
图 3 两个采样点位下不同污染时长土壤中细菌与真菌门水平微生物相对丰度
在门水平上(图3),与对照相比,石油污染土壤中变形菌门的相对丰度增加,而芽单胞菌门和拟杆菌门的相对丰度减少。在真菌群落中,子囊菌门和壶菌门的相对丰度增加。相反地是,与对照组相比,短期石油污染后担子菌门、被孢霉门和捕虫霉亚门的相对丰度降低(<0.05)。此外,长期石油污染后,土壤中子囊菌门的相对丰度有所提高,而壶菌门和捕虫霉亚门的相对丰度有所下降(<0.05)。
在前20个已确定的细菌属中(图4),罗尔斯通氏菌、假单胞菌、硫单胞菌、油杆菌和海杆菌为主导菌属。与对照组相比,PS样品中罗尔斯通氏菌、寡养单胞菌、不动杆菌、柠檬酸杆菌的相对丰度显著降低。相反,假单胞菌、油杆菌、海杆菌、硫单胞菌、海小杆菌、假海源杆菌、梭杆菌、弓形菌和嗜盐单胞菌的相对丰度增加(<0.05)。在OS样本中,罗尔斯通氏菌、不动杆菌和柠檬酸杆菌的相对丰度显著降低,相反,油杆菌、海杆菌、硫单胞菌、海小杆菌、、硫杆状菌、HB2_32_21、食烷菌的相对丰度增加(<0.05)。

图 4 两个采样点位下不同污染时长土壤中细菌与真菌属水平相对丰度热图
对真菌而言,镰刀菌、被孢霉、假丝孢菌、链格孢菌和赭孢菌最为丰富的菌属。与对照相比,PS样品中被孢霉菌、链格孢菌、枝孢菌、合头菌的相对丰度降低。相反,镰刀菌、赭孢菌和黑孢菌的相对丰度增加(<0.05)。另外,在OS样品中,被孢霉、链格孢菌、枝孢菌、合头菌和曲霉的相对丰度降低,而镰刀菌和赭孢菌的相对丰度增加(<0.05)。
2.4 土壤微生物网络与拓扑学性质
为了探究土壤微生物群落间的互作模式,研究基于细菌和真菌属水平(相对丰度>0.1%)之间的斯皮尔曼相关系数(<0.05)构建了三组土壤中的微生物共现网络(图5)。结果显示(表3),与对照组相比,PS和OS网络中的点数、连接数、正连接数比例和平均度均逐渐减少。有趣的是,PS网络拥有最高的网络模块化系数,其次是OS,Control网络模块化系数最低。此外,在PS网络中,正连接的比例显著下降至53.6%,而在OS网络中,正连接的数量反弹至61.4%。

图 5 三种污染(a:对照,b:PS,c:OS)状况下土壤微生物共现网络模式
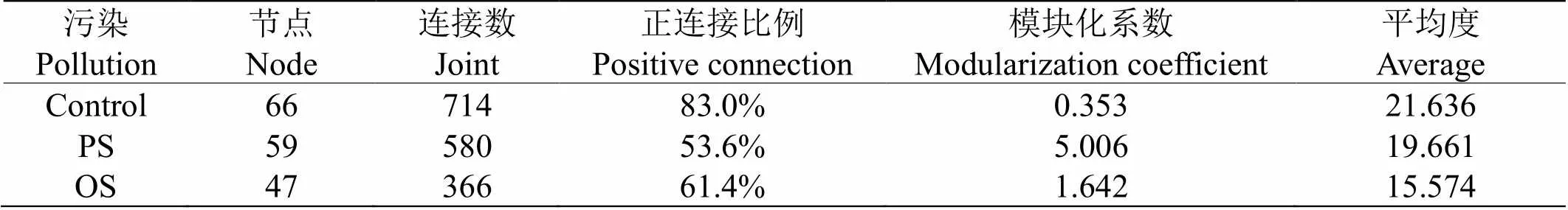
表 3 土壤微生物共现网络部分拓扑学性质
3 讨 论
目前,土壤石油污染被认为是最严重的环境问题之一。这类污染会降低或破坏土壤肥力,改变土壤和水循环的元素组成,导致生态系统遭受破坏,进而造成空气和地下水的二次污染,同时抑制或杀死土壤生物,如动植物或微生物等[14-16]。
本研究发现土壤碳、氮、硫含量显著增加。同时,石油污染后土壤pH显著降低(表1),这与前人的报道一致[17]。这主要是由于石油中含有大量的碳、氮和硫元素,从而造成元素累积。并且,当硫元素进入土壤时,可能形成硫氧化物从而降低土壤pH值。
此前的研究发现,石油污染会导致土壤微生物群落发生改变[18,19]。本研究对不同石油污染时长土壤微生物组进行了测序,结果表明(图1),石油污染显著降低了土壤细菌和真菌α多样性,并塑造了微生物群落(图4)。Cheema S等[18]发现农业土壤中的细菌多样性明显高于石油烃污染的土壤。此外,Wang HH等[19]发现石油污染物的毒理作用显著降低了土壤真菌的多样性。
在这项研究中,石油污染增加了变形菌门和子囊菌门的相对丰度(图3)。此前的一项研究表明,变形菌被证明是石油污染土壤中最容易培养的细菌[20]。另外,部分变形菌可以降解石油污染土壤中的石油烃或多环芳烃(PAHs)[20,21]。Kim等富集了土壤中产生物表面活性剂的微生物,这些生物表面活性剂具有降解石油污染土壤中碳氢化合物的潜力,更重要的是,其中变形菌的相对丰度最高。此外,研究证明子囊菌是已知最主要的石油降解真菌门[22]。结果还显示,油杆菌和镰刀菌的相对丰度在PS和OS组样品中均显著增加。油杆菌先前被证明是一种高性能碳氢化合物降解菌[23],而镰刀菌[24]也被用于石油降解处理。
微生物共现网络分析可以解释微生物群落的结构和功能,随着土壤微生物群落组成的变化,微生物共现网络也随之发生变化。本研究发现相比于对照,网络节点、连接数以及正连接数的比例在PS和OS组中均显著降低。受到石油污染的土壤样品中较少的微生物网络连接表明土壤微生物之间的相互作用受到抑制。这可能是由于石油污染导致土壤中微生物活性下降所致[25,26]。此外,PS组土壤中网络正连接的比例低于OS组。这说明土壤微生物在短期内受到石油污染后微生物群落之间的相互作用更具竞争性或拮抗性。随后,经过长期的自然恢复,土壤微生物之间的相互作用模式逐渐向协同或共生转变。
研究表明,功能性合作行为普遍存在于土壤微生物群落中[27]。微生物共现网络分析确定了具有合作或相互依赖关系的微生物类群,通常代表一个模块,表明它们具有类似的功能[28]。网络中的模块具有最小化环境紊乱影响的功能[29]。因此,OS和PS组微生物网络中的模块性升高,表明土壤微生物正在形成相似的模块以应对石油污染物的干扰。
[1] 吴亚星.石油工业实践中的环境伦理[J].天津化工,2022,36(5):119-121
[2] Ai-Jawhari HFI. Ability of some soil fungi in biodegradation of petroleum hydrocarbon [J]. Journal of Applied and Environmental Microbiology, 2014,2:46-52
[3] Dariush MT, Shahriari MH, Gholamareza SF,. Effect of light crude oil-contaminated soil on growth and germination of[J]. Journal of Applied Sciences, 2007,7(18):2623-2628
[4] 潘林,曹瑞,焦德志.石油污染对芦苇根际细菌群落组成和多样性的影响[J].中国水土保持科学(中英文),2022,20(2):131-138
[5] Hamdan HZ, Salam DA. Microbial community evolution during the aerobic biodegradation of petroleum hydrocarbons in marine sediment microcosms: Effect of biostimulation and seasonal variations [J]. Environmental Pollution, 2020,265:114858
[6] Paisse S, Coulon F, Goni-Urriza M,. Structure of bacterial communities along a hydrocarbon contamination gradient in a coastal sediment [J]. FEMS Microbiology Ecology, 2008,66:295-305
[7] Liu R, Zhang Y, Ding R,. Comparison of archaeal and bacterial community structures in heavily oil-contaminated and pristine soils [J]. Journal of Bioscience and Bioengineering, 2009,108:400-407
[8] 周丽霞,丁明懋.土壤微生物学特性对土壤健康的指示作用[J].生物多样性,2007(2):162-171
[9] Michalska-Smith M, Song ZW, Spawn-Lee SA,. Network structure of resource use and niche overlap within the endophytic microbiome [J]. ISME Journal, 2021,16(2):613
[10] Qiu L, Zhang Q, Zhu HS,. Erosion reduces soil microbial diversity, network complexity and multifunctionality [J]. ISME Journal, 2021,15:2474-2489
[11] De Menezes AB, Prendergast-Miller MT, Richardson AE,. Network analysis reveals that bacteria and fungi form modules that correlate independently with soil parameters [J]. Environmental Microbiology, 2015,17:2677-2689
[12] 焦硕.微生物群落构建和演替对石油污染物的响应研究[D].杨凌:西北农林科技大学,2017
[13] 刘喆.有机肥施用对土壤微生物区系及作物生长影响研究[D].杨凌:西北农林科技大学,2020
[14] Haritash AK, Kaushik CP. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): A review [J]. Journal of Hazardous Materials, 2009,169:1-15
[15] Hu G, Li J, Zeng G. Recent development in the treatment of oily sludge from petroleum industry: A review [J]. Journal of Hazardous Materials, 2013,261:470-490
[16] Koshlaf E, Ball S. Soil bioremediation approaches for petroleum hydrocarbon polluted environments [J]. AIMS Microbiology, 2017,3:25-49
[17] 孙清,陆秀君,梁成华.土壤的石油污染研究进展[J].沈阳农业大学学报,2002(5):390-393
[18] Cheema S, Lavania M, Lal B. Impact of petroleum hydrocarbon contamination on the indigenous soil microbial community [J]. Annals of Microbiology, 2015,65:359-369
[19] Wang HH, Kuang SP, Lang QL,. Effects of aged oil sludge on soil physicochemical properties and fungal diversity revealed by high-throughput sequencing analysis [J]. Archaea, 2018,8:9264259
[20] Zhang DC, Mörtelmaier C, Margesin R. Characterization of the bacterial archaeal diversity in ydrocarbon-contaminated soil [J]. Science of the Total Environment, 2012,421-422:184-196
[21] 韩平,郑立,崔志松,等.胜利油田滩涂区石油降解菌的筛选、鉴定及其多样性分析[J].应用生态学报,2009,20(5):1202-1208
[22] 王帅,刘利,解庆林,等.广西涠洲终端采油废水活性污泥中真菌种群的分析[J].北京农业,2014(9):238-240
[23] Catania V, Santisi S, Signa G,. Intrinsic bioremediation potential of a chronically polluted marine coastal area [J]. Marine Pollution Bulletin, 2015,99:138-149
[24] Azin E, Moghimi H, Heidarytabar R. Petroleum degradation, biosurfactant and laccase production byRH-10: A microcosm study [J]. Soil and Sediment Contamination, 2018,27(4):329-342
[25] Guo H, Yao J, Cai M,. Effects of petroleum contamination on soil microbial numbers, metabolic activity and urease activity [J]. Chemosphere, 2012,87(11):1273-1280
[26] Labud V, Garcia C, Hernandez T. Effect of hydrocarbon pollution on the microbial properties of a sandy and a clay soil [J]. Chemosphere, 2007,66(10):1863-1871
[27] Cremer J, Melbinger A, Wienand K,. Cooperation in microbial populations: Theory and experimental model systems [J]. Journal of Molecular Biology, 2019,431(23):4599-4644
[28] Deshpande R, VanderSluis B, Myers CL. Comparison of profile similarity measures for genetic interaction networks [J]. PLoS One, 2013,8(7):e68664
[29] Kitano H. Biological robustness [J]. Nature Reviews Genetics, 2004,5:826-837
Soil Properties and Microbial Community Responses to Oil Pollution in Saline-alkali Soil in the Yellow River Delta
JING Shao-dong1,2, LIU Zhong2, ZHU Wei1,2, GU Mei-xia1,2*, WU Lei1,2
1.257200,2.257200,
Shifts in soil physicochemical properties and microbiome are important indicators for field soil pollution risk assessment and remediation. However, it is still unclear how soil physicochemical properties and microbiome respond to oil contamination. In this study, oil-contaminated soil samples were collected from working and long-term abandoned oil wells in an oil field located in Shandong Province. In the meanwhile, we investigated the impact of oil contamination on soil physicochemical properties, microbiome, and microbial co-occurrence network patterns. Results showed that oil contamination increased the concentration of soil total petroleum hydrocarbons, total carbon, total nitrogen, total sulfur, and total phosphorus, while decreasing soil pH. Oil contamination also reduced the-diversity of soil bacteria and fungi, which were negatively correlated with soil total petroleum hydrocarbon content and electrical conductivity. Moreover, oil contamination increased the relative abundance of Proteobacteria, Ascomycota,, andin soil. Furthermore, oil contamination decreased the number of nodes, edges, and modularity values of microbial networks in soil, indicating the construction of low-complexity and fragile microbial networks. Our findings suggest that short-term severe oil contamination can alter soil physicochemical properties, microbiome and drive the construction of unstable soil microbial networks, which are difficult to restore through natural restoration.
Saline-alkali soil; soil microbial community; oil pollution
S154.36
A
1000-2324(2023)02-0267-07
10.3969/j.issn.1000-2324.2023.02.015
2022-08-12
2022-09-08
矿区土壤生态修复与大宗固废高值利用关键技术及工程示范(2020CXGC011403)
荆少东(1972-),男,博士研究生,教授级高级工程师,研究方向:岩土工程勘察,地质工程与能源环保. E-mail:1318315178@qq.com
Author for correspondence. E-mail:sxxnl163@163.com
