上颌窦底提升术成骨机制与临床术式选择
2023-05-10许舒宇王佐林
许舒宇, 范 震, 王佐林
(上海牙组织修复与再生工程技术研究中心,同济大学附属口腔医院口腔种植科,上海 200072)
上颌窦是位于上颌骨内的重要解剖结构,窦腔骨壁覆盖施耐德膜(Schneiderian membrane),又称上颌窦膜。 上颌后牙缺失时,易发生上颌窦气化和牙槽骨吸收,导致上颌后牙区可用骨量不足,难以完成种植牙修复治疗[1]。经典的上颌窦底提升术是解决该区域骨量不足最常用的治疗方法[2],其方法为通过提升Schneiderian膜,在膜与上颌窦底壁间形成的空间内置入骨替代材料作为支架,以引导提升区域新骨生成。
近年来,随着学者们对上颌窦底提升术式疗效的总结和分析,对经牙槽嵴顶上颌窦底提升术中缺牙区可用骨高度的要求逐渐降低[3]。加之上颌窦底提升手术工具的改良,种植体形态设计、材料、表面处理方式的改进,越来越多的临床医生为患者选择经牙槽嵴顶上颌窦底提升术同期种植。而对于上颌窦内成骨相关细胞的来源是骨壁还是上颌窦黏膜、上颌窦底提升疗效是否与年龄或性别相关、同期种植的时机、余留骨高度(RBH)的影响、是否需要置入骨替代材料[4-5]等问题,至今仍有争议。本文就上颌窦内成骨机制的研究成果,结合本院口腔种植科10余年上颌窦底提升术的治疗效果,总结临床操作的方法与技巧,提出手术创伤小、并发症少、简单易行、更安全可靠的上颌窦底提升术的方案与理念。
1 上颌窦底提升术中的成骨机制
上颌窦底提升后窦腔内新生骨来源的相关研究较多,主要认为是上颌窦骨壁、牙槽骨及Schneiderian膜单独或联合作用引导新骨生成。虽然已有研究[6-10]证实Schneiderian膜内存在骨祖细胞,但目前能够证明Schneiderian膜参与成骨过程的直接证据依旧不足。
与长骨、躯干骨及其他口腔颌面部骨创伤修复后成骨不同,上颌窦底提升术骨组织新生并非在受创伤的骨组织内,而是位于提升后的膜及上颌窦底壁之间。本团队对2010年1月至2020年12月间于同济大学附属口腔医院口腔种植科就诊的1 210例行经牙槽嵴顶上颌窦底提升术同期种植患者的治疗效果进行分析,结果显示,上颌窦底提升术的成骨效果与患者年龄、性别等因素无显著相关性,而与提升膜的高度密切相关,提示该区域可能存在特殊的骨再生机制[11]。本团队建立模拟临床上颌窦底提升小鼠模型,利用单细胞测序、Cre-Dre双重组酶报告小鼠体内标记、体内双示踪及慢病毒转染等技术,发现并鉴定了来源于上皮组织、具有上皮和间充质双重功能属性和骨祖细胞转录本特征、拥有强大成骨能力的Krt14+Ctsk+细胞亚群,其在上颌窦底提升术后成骨过程中发挥非常重要的作用 (图1),该研究成果于2022年以独立通信作者发表于Cell Research[11]。文章发表同期,美国康奈尔大学威尔康奈尔医学院知名骨科研究专家Matthew Greenblatt教授以“塑形上颌窦:一种新型Krt14+Ctsk+细胞谱系亚群驱动再生骨的形成”为题,在Cell Research上发表配图述评,该述评重点指出,Krt14+Ctsk+类群细胞的发现对于经典的成骨细胞分类理论提出了挑战,提示上皮结构可以为成骨提供重要的细胞来源(图 2)[12]。

图1 上颌窦底提升术后成骨过程中发挥重要作用的,具有上皮和间充质双重功能属性和骨祖细胞转录本特征的Krt14+Ctsk+细胞亚群Figure 1 The Krt14+Ctsk+ cell subpopulation plays an important role in the osteogenesis process after maxillary sinus floor elevation surgery,with dual properties of epithelial and mesenchymal functions and transcriptional characteristics of bone precursor cells

图2 美国康奈尔大学Matthew Greenblatt教授在Cell Research上发表配图述评[12]Figure 2 Professor Matthew Greenblatt from Cornell University commented on Cell Research through illustrations[12]
2 经牙槽嵴顶上颌窦底提升术的新技术与理念
2.1 经牙槽嵴顶上颌窦底提升术的临床操作与技巧
临床常用的几种安全有效的窦底膜提升方法[13]包括种植体植入提升窦底膜(旋磨法)、超声骨刀提升法及骨凿法提升窦底膜(图3)。

图3 经牙槽嵴顶上颌窦底提升术病例Figure 3 Cases of TSFE
2.1.1 种植体植入提升窦底膜(旋磨法) 方法为应用扩孔钻逐级备孔至近窦底1 mm处,换用球钻磨除窦底骨至有落空感时停止。在种植位点根方放置浓缩生长因子(CGF),植入种植体,利用种植体挤压抬升窦底膜。其优点是避免了采用Summers骨凿冲顶窦底给患者带来的头部振荡感,手术快速且损伤小。操作时需注意,近窦底骨时,应减慢球钻转速,防止突然的骨壁穿通导致窦底膜穿孔。该方法具有较高的技术敏感性,需由有经验的临床医生完成操作。
2.1.2 超声骨刀提升法 方法为应用扩孔钻逐级备孔至近窦底1 mm处,使用超声骨刀工作端磨除窦底骨组织至阻力突然减小,表明所有残留骨已被磨除;再使用黏膜剥离器在上颌窦底分离窦膜。超声骨刀工作时喷出的水和汽可以辅助窦底膜的抬升,也可避免使用敲击骨凿冲顶给患者带来的不适,降低膜穿孔的风险,其能切割余留硬组织而不损伤软组织,具有创伤小、出血少的优点。本团队于2012年曾发表相关研究[14],结果表明,超声骨刀用于窦底膜的抬高,简化了窦底膜提升的操作程序,并减少了窦底膜穿孔发生的可能性。
2.1.3 骨凿法提升窦底膜 方法为应用扩孔钻逐级扩孔时,依次用相应直径的骨凿逐级敲击使窦底骨壁发生骨折,并将窦底骨壁及窦膜提升至预计高度。随后于种植窝底部放置CGF,完成种植体植入。应注意当敲击时的阻力过大时,需利用锥形束CT(cone-beam computed tomography, CBCT) 检查骨组织形态、位置、厚度、密度及是否有间隔阻挡。若窦底骨壁呈斜坡状或骨密度较高,建议改用其他提升方法,防止一侧窝洞基底部骨过厚致使提升困难,而另一侧已经进入上颌窦底导致穿孔。
经牙槽嵴顶提升上颌窦底时,窦底骨质穿通后,首先进行鼻通气试验进行膜完整性的检测。将CGF膜置入窦底后,捏住患者鼻尖部,嘱患者用鼻腔吸气,再嘱患者用鼻腔呼气,使上颌窦底膜向下与CGF膜更加贴合,反复几次来检测上颌窦底膜的完整性。确认鼻通气试验阴性后,同期植入种植体,利用种植体的缓慢旋转来提升膜所需的高度,一次性完成上颌窦底提升术。
传统观念认为,上颌后牙区的RBH会影响上颌窦底提升术后的种植体存留率。2011年,Chen等[15]在指南中建议,窦底RBH≥5 mm 时,建议使用经牙槽嵴顶上颌窦底提升术。2017年,Lundgren等[16]提出,应根据上颌后牙区 RBH 来选择不同的骨增量方案:当RBH≥5 mm时,应选择经牙槽嵴顶上颌窦底提升术+同期种植;当5 mm>RBH≥3 mm时,应选择经前外侧壁开窗上颌窦底提升术+同期种植;当RBH<3 mm时,应选择经前外侧壁开窗上颌窦底提升术+延期种植。在2018年中华口腔医学会口腔种植专业委员会共识会议[4]中,专家们通过对各自单位的临床病例进行回顾分析和总结,他们认为,当RBH≥4 mm时,应用经牙槽嵴顶上颌窦底提升术的临床效果是可预期的。但也有学者[17]认为,经前外侧壁开窗的上颌窦底提升术手术创伤大、治疗费用高及有增加术中、术后并发症的风险。本团队曾报道微创的经前外侧壁“小开窗”上颌窦底提升术[17](图4),文中报道的方法大大减小了传统侧壁开窗上颌窦底提升手术的创伤,但与经牙槽嵴顶上颌窦底提升术相比,侧壁开窗上颌窦底提升术需要颊侧附加切口,会更大范围地剥离颊侧黏膜瓣,造成除种植窝外的额外骨创伤,因此,仍有创伤大、术后疼痛、水肿严重的问题。

图4 左侧上颌窦行经牙槽嵴顶上颌窦底提升术,右侧上颌窦行经前外侧壁开窗上颌窦底提升术的病例Figure 4 Left side showing a case of TSFE, and the right side showing a case of maxillary sinus floor elevation through the lateral wall approach
我们对2013年5月至2022年12月于同济大学附属口腔医院口腔种植科行经牙槽嵴顶上颌窦底提升术同期种植的1 707例患者的治疗效果进行统计学分析,结果显示,RBH≥5 mm组与RBH<5 mm组相比,成骨效率差异无统计学意义;RBH<5 mm组行经牙槽嵴顶上颌窦底提升术后可以获得与RBH≥5 mm组相当的成骨效果。
2.2 经牙槽嵴顶上颌窦底提升术中CGF的应用
自2013年起,我们在进行上颌窦底提升术中常规应用CGF。CGF应用方法为将CGF压制成膜,于上颌窦底膜提升后置入CGF膜,或将CGF包裹于种植体尖端,随种植体同期植入。CGF的主要作用:在种植体植入的过程中,柔软且有一定韧性的CGF可以有效缓冲种植体尖端对抬升的上颌窦膜的压力,防止上颌窦底膜穿孔;CGF中富含免疫因子,有良好的抗感染作用;其内含丰富的生长因子,能促进新骨生成及改建[18];即使有小的上颌窦底膜穿孔,CGF也能发挥封闭及抗感染的作用[19],同时促进上颌窦底膜的愈合(图5)。本团队对经牙槽嵴顶上颌窦底提升术同期种植中使用CGF病例的窦内成骨效果进行了统计学分析,结果显示,术中使用CGF减少了上颌窦底膜穿孔的可能性,CGF占据上颌窦膜提升空间有利于窦内成骨,其成骨效率与使用骨替代材料组相当。

图5 经牙槽嵴顶上颌窦底提升术同期植入种植体中CGF的应用Figure 5 The application of CGF in implants placed imultaneously with TSFE
2.3 不使用骨替代材料仍可获得良好的成骨效果
本团队的临床数据显示,采用经牙槽嵴顶上颌窦底提升术同期种植,不置入骨替代材料组(仅置入CGF膜)与置入骨替代材料组,术后6个月与术后当日相比,提升高度有所下降,但2组在术后6个月均能获得良好的成骨效果,成果效率差异无统计学意义。分析其可能原因:经牙槽嵴顶上颌窦底提升术同期植入种植体时,种植体的尖端稳定了抬升的上颌窦底膜,以对抗上颌窦膜所受到的重力和上颌窦内流动的空气所产生的剪切力,与CGF一起为上颌窦提升区域提供了稳定的成骨空间。该空间由上颌窦底壁作为基底,空间内由膜提升及种植窝洞制备后渗出的血液所充满,同时上颌窦底骨壁及Schneiderian膜为骨再生提供了成骨细胞来源,具备了稳定的成骨空间,拥有了成骨细胞来源,以及血液和CGF中的生长因子,三者共同为上颌窦内成骨提供基础和保证。
3 讨论
3.1 上颌窦底提升术的成骨机制
有关上颌窦底提升后窦腔内新生骨的来源一直存在争议。2009年,Srouji等[6]将人上颌窦膜的上皮层、固有层和骨膜样层分离,并将其与无机物材料混合后异位植入小鼠皮下组织,发现与上颌窦膜细胞混合后,无机物颗粒的周围出现成骨现象,免疫组织化学染色结果也证实有上颌窦膜诱导产生与成骨分化相关的碱性磷酸酶、骨钙素等成分。Berbéri等[7]对人类离体上颌窦膜进行细胞分离、培养,证实人类上颌窦膜细胞(human maxillary sinus mucosal cells,hMSMCs)不仅在镜下呈现间充质干细胞的形态,也存在成骨标志物的转录表达,因此认为hMSMCs 含有能够分化成骨的间充质干细胞。与其他牙髓间充质干细胞相比,hMSMCs 的成骨潜能更高。Rong等[8]在犬上设计了3种侧壁开窗上颌窦底提升模型:一种是正常的上颌窦底提升同期置入骨替代材料的模型,另外2种分别采用超薄钛膜阻隔了上颌窦底骨壁和上颌窦膜;结果发现,在正常上颌窦底提升模型中,窦底骨壁有大量新生骨与骨增量材料完成骨愈合,上颌窦底膜处有少量新生骨,无论是阻隔上颌窦底膜还是阻隔上颌窦底骨壁,只要被钛膜阻隔则不会有新生骨生成。该实验证实了上颌窦底骨壁和Schneiderian膜均是窦腔内新生骨的来源。Graziano等[9]发现,人上颌窦膜中存在干细胞因子受体 CD117阳性表达的细胞,这种CD117阳性的未分化祖细胞已被证实具备无须诱导的自我成骨分化的潜能。Lie等[10]在牙列缺失患者的上颌后牙区行不置入骨替代材料的上颌窦底提升术,术后6个月的免疫组织化学结果显示,在保证窦底提升空间稳定的前提下,即使不置入骨替代材料,上颌窦内仍然能够有显著的新骨形成。上述研究间接证实了Schneiderian膜能够提供成骨细胞来源,但缺少直接的细胞来源证据证明这一观点。
本团队为此建立模拟临床上颌窦底提升小鼠模型,利用单细胞测序、Cre-Dre双重组酶报告小鼠体内标记、体内双示踪及慢病毒转染等技术,创新性发现并鉴定了来源于上皮组织、具有上皮和间充质双重功能属性和骨祖细胞转录本特征的Krt14+Ctsk+细胞亚群,其在上颌窦底提升术后成骨过程中发挥非常重要的作用[11]。该发现突破了引导骨再生成骨细胞来源稀缺这一世界医学难题,揭示了在国际口腔医学领域被重点关注、并用传统骨再生理论无法解释的上颌窦内骨再生新机制。
3.2 年龄和性别对上颌窦底提升术成骨效果的影响
2014年,Gonzalez等[20]对102例经牙槽嵴顶上颌窦底提升术的患者进行了平均29.7 个月(6~100个月)的术后随访,发现种植体成功率与年龄、性别无关。本团队对经牙槽嵴顶上颌窦底提升术同期种植病例进行统计学分析的结果也显示,性别及年龄对上颌窦底提升成骨效率无显著影响,成骨效率与膜的提升高度密切相关[11]。不同年龄阶段或不同性别的患者,在窦底膜提升并稳定后,均能获得良好的成骨效果。
3.3 余留骨高度与术式选择:侧壁开窗与经牙槽嵴顶入路
2011年,Bernardello等[21]进行了一项多中心临床研究,对来自6个不同治疗中心的117例上颌窦底RBH<5 mm的患者(134颗种植体)进行了平均48.2个月的随访,结果显示,种植体存留率为96.3%,骨增量平均高度为(6.48±2.38)mm,该研究认为RBH并不是影响上颌窦内成骨效果及种植体存留率的唯一因素。Qian等[22]将 RBH 划分为3组(2~4 mm 组、4~6 mm 组、6~8 mm 组),观察经牙槽嵴顶上颌窦底提升术后RBH与种植体稳定性的关系,结果显示,术后20周内,各组种植体稳定性系数(implant stability quotient, ISQ)值变化趋势相同,并且不同RBH之间的ISQ值并无显著差异,说明窦底RBH不是影响种植体稳定性的决定性因素。
因此,在上颌窦底提升术中,RBH不是术式选择考虑的唯一因素,种植体与抬升的上颌窦膜维持稳定的成骨空间,即可获得良好的成骨效果。当拟进行上颌窦底提升的区域牙槽嵴顶骨皮质线及上颌窦底皮质线清晰且完整,无上颌窦囊肿、上颌窦间隔等不利因素时,在能保证种植体初期稳定性的情况下,采用经牙槽嵴顶上颌窦底提升术既能减小手术创伤、降低并发症风险、减少手术费用,还可以实现维持稳定的膜位置,以及稳定窦内成骨空间的作用,从而获得良好且长期稳定的骨再生效果(图6)。
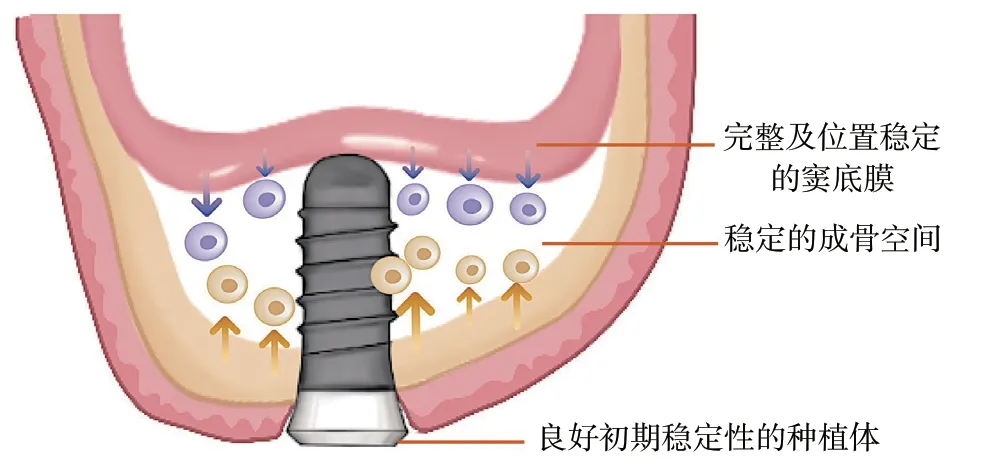
图6 获得上颌窦底提升术长期良好成骨效果的影响因素Figure 6 Factors influencing the long-term favourable osteogenic effect of maxillary sinus floor elevation
3.4 骨替代材料及生长因子的应用
目前上颌窦底提升术中置入的多为低替代率的骨增量材料,其应用的利弊尚无明确定论。材料的低替代率保证了上颌窦内及种植体周围的骨体积,能够在新骨形成期间,乃至更长时间内保持稳定,为新骨形成提供更大的空间[23],但也造成了移植骨区始终为新生骨和骨替代材料的复合物,其结构与自体骨始终存在差异,可能存在妨碍新生骨附着于种植体表面的问题。残留的骨增量材料是否会影响种植体骨结合率及种植体的长期留存率尚不清楚。
Nedir等[24]为上颌窦底提升患者植入25颗10 mm长的种植体,术中不置入骨替代材料,术后当日种植体进入上颌窦内的平均长度为4.9 mm,5年后的影像学检查结果显示,种植体在上颌窦内的平均高度降低至1.5 mm,该结果提示种植体进入上颌窦内的部分有3.4 mm(70%)的新生骨生成。Chen等[25]于2022年发表文章比较了经牙槽嵴顶上颌窦底提升术联合CGF同期种植(置入或不置入骨替代材料)的临床效果,其中拟种植区域RBH为4~6 mm。该回顾性研究共纳入了44名患者,他们接受了经牙槽嵴顶上颌窦底提升术联合应用CGF并同时放置了60颗种植体,随后进行了24个月的临床观察;结果显示,使用骨替代材料组与仅使用CGF组间提升高度差异无统计学意义(P=0.360),24个月时的垂直骨吸收差异无统计学意义(P=0.097),边缘骨丧失差异无统计学意义(前12个月边缘骨丧失为0.707 mm,第13~24个月边缘骨丧失为0.922 mm),无论是否进行骨移植,种植体成功率均为100%。因此,得出结论:当RBH为4~6 mm 时,经牙槽嵴顶上颌窦底提升术联合CGF时无论术中是否使用骨替代材料,都是安全可靠的。这与本团队的临床数据结果一致,说明上颌窦底提升术中不使用骨替代材料也可以获得良好的成骨效果。
2015年,本团队对比了行经牙槽嵴顶上颌窦底提升术时置入或不置入骨替代材料的临床效果,纳入了2013年1月至2014年9月间于同济大学附属口腔医院口腔种植科行经牙槽嵴顶上颌窦底提升术并同期植入种植体的患者57例,共73颗种植体,其中23例患者(34颗种植体)置入了骨替代材料,34例患者(39颗种植体)未置入骨替代材料,分别在术后第3天、第10天、义齿负载后6~18个月时进行随访,通过临床观察和CBCT影像学检查对患者种植术后软硬组织进行评估,结果表明,2组的种植义齿周围软组织探诊深度及种植体周骨组织吸收量的差异均无统计学意义[26]。与我们的研究结果类似的是,Ghasemirad等[27]于2023年进行了一项双盲临床试验,以检查CGF对上颌窦底提升术疗效的影响,该研究纳入了30~80岁的9名患者,行双侧侧壁开窗上颌窦底提升术,一侧置入异种骨替代材料,另一侧置入CGF,茜素红染色结果显示,CGF组的骨形成率显著高于对照组(P<0.05),6个月后,对照组的残余骨替代材料量显著高于CGF组(P<0.05)。这些发现表明,在侧壁开窗上颌窦底提升术中使用CGF对于窦内成骨是有利的。
3.5 经牙槽嵴顶上颌窦底提升术同期植入种植体
Moraschini等[28]对经上颌窦底提升术同期种植不置入骨替代材料的研究进行了荟萃分析,共纳入发表于2005年至2016年的18篇文章,分析结果表明,在不置入骨移植材料的情况下,上颌窦底提升术同期种植平均39.4个月后,可观察到窦内骨高度平均增加4.7 mm,种植体累计平均存留率为97%。本团队对行经牙槽嵴顶上颌窦底提升术同期种植的患者进行疗效分析,研究结果也表明,当拟种植区域余留牙槽骨能够为种植体提供良好的初期稳定性,提升处抬高的Schneiderian膜能够提供稳定的成骨空间时,同期种植也可以获得高的种植体存留率。
RBH较低时,为保证植入的种植体仍能获得良好的初期稳定性,需要临床医生正确判断术前拟种植区的骨质及骨量。影像学检查中拟种植区域牙槽骨嵴顶骨皮质线如清晰且完整,种植体植入后颈部区域可以获得良好的“卡抱”效果,如同时上颌窦底皮质骨线清晰且完整,则种植体可以获得双皮质固位,从而保证种植体植入时具有良好的初期稳定性;如皮质骨线不清晰或不完整,或RBH小于2 mm,甚至牙槽骨嵴顶皮质和上颌窦底皮质影像重叠,发生“融合”时,则应分阶段种植,防止种植体因周围骨改建或上颌窦内压力变化而发生位移或脱落。
4 总结
综上所述,我们基于上颌窦底提升术成骨机制的研究结果,发展了经牙槽嵴顶上颌窦底提升术的新技术和理念,实现了“Bedside to Bench back to Bedside”临床转化——暨经牙槽嵴顶上颌窦底提升术同时置入CGF膜,并同期植入种植体的临床治疗方法,该手术方法创伤小、并发症少、简单易行、安全可靠。
① 上颌窦底提升术中先置入CGF膜,用种植体旋入提升上颌窦底膜并保持上颌窦膜的稳定性;
② 上颌窦底提升同期种植的预期成骨效果稳定且不受年龄和性别影响;
③ 使用或不使用骨替代材料,窦内成骨效果无显著性统计学差异;
④ 术中应用CGF有利于维持膜的完整性及稳定性,并有利于窦内骨组织的再生。
