重组人源肿瘤坏死因子受体融合蛋白对大鼠下颌骨缺损的干预效果
2023-05-10康献刚牛军强赵冬霞
康献刚, 牛军强, 赵冬霞, 霍 霁
(1.邢台医学高等专科学校第二附属医院骨一科, 河北 邢台 054000;2.邢台市第一医院骨科,河北 邢台 054001;3.邢台市第一医院超声室, 河北 邢台 054001)
目前由外伤或者其他因素导致的骨缺损或骨折是临床实践中经常遇到的骨损伤类型,尽管人体本身具有潜在的骨损伤修复能力,但受损严重的骨缺损很难被完全修复。随着生物技术的发展,自体骨移植生物材料由于具有生物相容性好、免疫排斥少、起效作用快等特点,近年来常被用于骨损伤修复。但该类材料也存在数量有限、容易发生早期吸收等问题[1]。因此,骨移植技术及引导骨再生技术成为了骨缺损修复的新途径。近些年,利用骨生长因子促进骨愈合的方法越来越受到人们的关注。重组人源肿瘤坏死因子受体融合蛋白(rhTNFR:Fc)是竞争性肿瘤坏死因子-α(TNF-α)抑制剂,既往研究[2]提示TNF-α能诱导软骨细胞凋亡,单次或者多次局部使用rhTNFR:FC均能有效缓解大鼠胶原诱导性关节炎,但是该治疗对下颌骨缺损大鼠骨修复的影响尚不清楚。因此,本研究将进一步探讨局部注射rhTNFR:FC对下颌骨缺损大鼠骨修复的影响。Janus激酶/信号转导与转录激活因子(JAK-STAT)通路属于机体内一类至关重要的信号转导通路家族,它的激活或抑制与细胞凋亡、细胞损伤、氧化应激、炎症反应等密切相关[2]。已有研究[3]表明,JAK-STAT通路可以调节成骨细胞和骨组织再生,促进血管生成。本实验利用rhTNFR:Fc治疗大鼠下颌骨缺损模型,通过组织形态定量分析和分子生物学实验探讨该干预疗法发挥作用的潜在机制。
1 材料和方法
1.1 实验动物、所用试剂和仪器
实验动物为7~8周龄SPF级的健康SD大鼠,雌雄各半,体质量为200~220 g(中国科学院动物研究所实验动物中心,中国);rhTNFR:Fc(三生国健药业有限公司,中国);Bio-Oss骨和Bio-Gide可吸收双层生物胶原膜(欧司海斯公司,美国);抗Bcl-2抗体、抗Bax抗体、抗JAK2抗体、抗STAT3抗体、抗βactin抗体(Abcam公司,美国);Western blotting电泳仪(Bio-Rad公司,美国);高频钼靶X射线机(Planmed Sophie公司,芬兰);医用净化工作台(苏州金燕净化设备有限公司,中国);Image-Pro Plus(IPP)图像处理分析软件(Media Cybernetics公司,美国)。
1.2 模型制备、分组及给药
选取SD大鼠70只,饲养1周,将大鼠随机分为3组,空白组10只,对照组和实验组各30只。制备大鼠颌骨缺损模型[4]。首先对大鼠进行常规麻醉(腹腔注射10%水合氯醛),将大鼠固定于试验台,常规消毒。然后对大鼠的下颌骨进行解剖处理,使用牙科电钻切割大鼠下颌角骨板,形成一个直径约4 mm的缺损区域。实验组:于大鼠下颌骨缺损处注入25 μL含rhTNFR:Fc的Bio-Oss骨颗粒,其上覆盖Bio-Gide胶原膜;对照组:于大鼠下颌骨缺损处注入含25 μL 0.9%氯化钠溶液的Bio-Oss骨颗粒,同样覆盖Bio-Gide胶原膜;最后再依次将切开的组织进行缝合,其后保证大鼠正常饮食,缝合处任其自然脱落。用健康的SD大鼠作为空白组。
1.3 实验动物处死及取材
术后定期观察大鼠生活状态,按照实验设定,分别于术后3、6、9周时在3%戊巴比妥钠(2 μL/g)作用下对大鼠行腹腔注射麻醉,将对照组(n=10)和实验组(n=10)的实验大鼠处死,然后分离获得下颌骨,以用于计算下颌骨缺损面积。
1.4 钼靶软X线扫描检查
各组下颌骨标本拍摄软X射线片(电压28 kV,电流28 mA,曝光时间0.3 s),观察并记录。
1.5 酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)测定大鼠下颌骨组织中IL-6和TNF-α浓度
按照试剂盒说明书操作,利用ELISA检测冻存的下颌骨组织中IL-6及TNF-α浓度水平。
1.6 大鼠组织Bcl-2、Bax及p-JAK2、p-STAT3蛋白水平的检测
通过Western blotting检测大鼠组织中Bcl-2、Bax、p-JAK2、p-STAT3 蛋 白 的 表 达 水 平。 用 等量的蛋白质加样,然后通过变性聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis, PAGE)将不同分子量大小的蛋白分开,并将分离开的蛋白转膜至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,转膜完成后用5%牛血清白蛋白(bovine serum albumin, BSA)封闭蛋白,完成封闭后加入最佳稀释浓度的一抗(按1∶1 000稀释),将样本置于4 ℃摇床上孵育过夜。用TBST缓冲液洗膜2次,然后加相对应二抗进行孵育,用TBST缓冲液再洗膜2次。最后使用增强化学发光(enhanced chemiluminescence,ECL)显色液进行显色发光,将样本置入曝光机器中观察,记录结果并导出所有图像结果用于后续分析。
1.7 统计学分析
利用IPP图像处理软件分析X射线图片,并计算不同组别下颌骨的骨缺损面积值。利用R语言软件包对不同组间骨缺损面积数据作组间方差分析,数据用均数±标准差()表示,采用单因素方差分析比较多个组间的差异,P<0.05认为差异具有统计学意义。
2 结果
2.1 动物实验结果
2.1.1 实验模型构建成功 手术及后期实验顺利,大鼠缺损符合预定要求,术后大鼠行为正常。按照实验设定时间点进行取材和收集实验数据。
2.1.2 钼靶软X射线机测量结果 用IPP软件进行测量,发现实验组下颌骨缺损面积显著小于对照组,差异有统计学意义(P<0.05,表1)。实验组在术后3周时,大鼠植骨区已出现新生骨板,并长出了新的成骨细胞和毛细血管;术后6周时,新生骨板数量已明显增多,而且出现骨互相连接现象(图1)。
表1 不同组别大鼠的下颌骨缺损面积(mm2, )Table 1 The mandibular defect area in different groups of rats(mm2, )
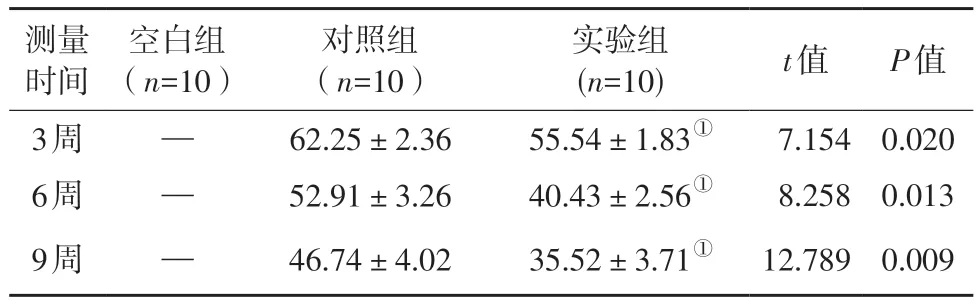
表1 不同组别大鼠的下颌骨缺损面积(mm2, )Table 1 The mandibular defect area in different groups of rats(mm2, )
—表示未测量;①表示P<0.05,与对照组比较。
测量时间空白组(n=10)对照组(n=10)实验组(n=10) t值 P值3周 — 62.25±2.36 55.54±1.83① 7.154 0.020 6周 — 52.91±3.26 40.43±2.56① 8.258 0.013 9周 — 46.74±4.02 35.52±3.71① 12.789 0.009
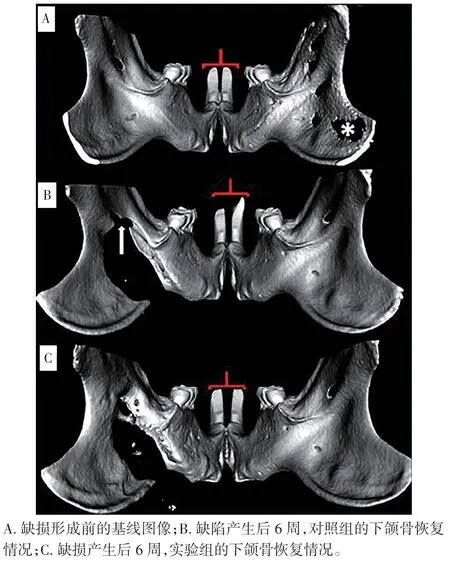
图1 下颌骨缺损的CT图像Figure 1 CT images of mandibular defects
2.2 各组大鼠组织中IL-6、TNF-α浓度的测定
治疗9周后,检测各组大鼠IL-6和TNF-α的浓度。与空白组比较,对照组IL-6和TNF-α的浓度显著上升,差异具有统计学意义(P<0.05);与对照组比较,实验组IL-6和TNF-α的浓度明显降低,差异具有统计学意义(P<0.05)。详见表2。
表2 不同组别大鼠组织中IL-6和TNF-α浓度的比较()Table 2 Comparison of IL-6 and TNF-α levels in different groups of rat tissues()

表2 不同组别大鼠组织中IL-6和TNF-α浓度的比较()Table 2 Comparison of IL-6 and TNF-α levels in different groups of rat tissues()
①表示P<0.05,与空白组比较;②表示P<0.05,与对照组比较。
组别 空白组(n=10)对照组(n=30)实验组(n=30) F值 P值IL-6 /(pg·mg-1) 58.46±3.39153.30±10.17① 93.78±4.06② 17.7860.003 TNF-α/(pg·mg-1)52.44±2.78155.43±10.64① 112.69±5.37② 7.5940.016
2.3 各组大鼠组织中Bcl-2、Bax、p-JAK2及p-STAT3蛋白水平的检测
相比空白组,对照组中Bax蛋白表达明显上升,同时Bcl-2蛋白表达降低,差异具有统计学意义(P<0.05);实验组Bax蛋白表达相比对照组明显下降,而Bcl-2蛋白表达水平显著上升,差异具有统计学意义(P<0.05)。相比空白组,对照组和实验组的p-JAK2和p-STAT3蛋白表达上调,差异具有统计学意义(P<0.05);相比对照组,实验组的p-JAK2和p-STAT3蛋白表达水平降低,差异具有统计学意义(P<0.05)。详见图 2。

图2 各组大鼠组织Bcl-2、Bax、p-JAK2和p-STAT3蛋白表达情况Figure 2 The protein expression of Bcl-2, Bax, p-JAK2 and p-STAT3 in three groups
3 讨论
外伤、感染和肿瘤等各种因素导致的骨缺损是临床上的常见疾病,而通过骨生长因子以骨诱导的方式促进骨愈合的方法越来越受到人们的关注[5]。研究报道,注射用rhTNFR:Fc主要用于治疗类风湿关节炎[6]、银屑病[7]和强直性脊柱炎[8]。TNF-α阻断剂通过中和TNF-α表达发挥抗炎作用[9],从而缓解多种炎症性疾病,并显著改善预后[10]。此外,在FcγRIIB-/-小鼠中,血清 TNF-α 水平升高,TNF-α阻断剂改善了该模型的下颌骨损伤[11]。TNF-α阻断剂是预防包括自身免疫性疾病相关下颌骨丢失的一种非常有前景的方法[12]。此外,局部注射减少了全身对TNF-α阻断剂的吸收,也一定程度上降低了不良反应的发生风险[13]。目前,利用rhTNFR:Fc行局部注射的方法对大鼠下颌骨缺损修复的研究机制尚不清楚。本研究通过定量下颌骨缺损面积来评估SD大鼠缺损恢复情况,同时阐明rhTNFR:Fc给药对下颌骨及软骨组织炎症及其调控信号通路的影响,最终发现局部注射rhTNFR:Fc能够有效修复下颌骨的缺损,并降低组织部位炎症因子IL-6、TNF-α的浓度。
本实验在给大鼠下颌骨缺损处注入内源性骨颗粒的同时,加入外源性rhTNFR:Fc,结果发现实验组在注入3周时,大鼠植骨区已出现新生骨板,并长出新的成骨细胞和毛细血管;术后6周时,新生骨板数量已明显增多,而且出现骨互相连接现象;9周时,骨颗粒附近已出现大量新生骨板,并已渐近成熟。然而对照组在手术后6周时偶见少量骨板,直到术后9周时,骨板才逐渐增多,意味着相互连接才刚刚出现,明显滞后于实验组的修复。这个现象说明rhTNFR:Fc提高了下颌骨缺损后骨愈合的速度。已有研究[14-15]表明,JAK-STAT信号通路可以调节成骨细胞的功能和骨组织再生,促进血管生成,同时在成骨细胞和破骨细胞的增殖、分化和迁移中发挥重要作用。JAK-STAT信号通路介导的信号转导负责50多种细胞因子、生长因子和激素的信号转导,并受到多个水平的调控[3]。一些细胞因子、生长因子和激素已被证明能通过JAK和/或STAT蛋白调节骨稳态[16]。骨细胞和骨重塑过程经常受到许多细胞因子的影响,这些细胞因子是骨形成和骨吸收的强刺激因子[17]。新的证据[3,18-19]表明,JAK-STAT 信号通路在骨发育、骨代谢和骨愈合中发挥重要作用。本实验结果显示,与空白组比较,对照组中Bax、p-JAK2、p-STAT3蛋白表达水平显著上升,而Bcl-2蛋白的表达显著下降,说明JAK2-STAT3信号通路与下颌骨缺损存在显著正相关。更为重要的是,与对照组比较,实验组Bax蛋白的表达出现明显下降,炎症因子IL-6及TNF-α浓度显著降低,而Bcl-2表达显著上调,说明实验组很可能是通过促进细胞凋亡来修复下颌骨缺损后的损伤。进一步的研究表明,经过局部注射rhTNFR:Fc处理的大鼠与对照组相比,骨组织中p-JAK2和p-STAT3的表达明显下降,说明该治疗潜在地通过抑制JAK2-STAT3信号通路来修复和再生受损骨组织。
综上所述,本研究通过多次皮下局部注射rhTNFR:Fc干预大鼠下颌骨缺损模型,发现该治疗对骨缺损具有一定修复和促进愈合的作用,能够抑制细胞发生凋亡。进一步的实验发现,该修复作用是通过抑制JAK2-STAT3信号来完成的。同时,本研究只发现局部注射rhTNFR:Fc能够修复受损大鼠下颌骨,促进骨的再生,但还缺少进一步深入机制的研究,具体如何作用JAK2-STAT3信号通路还有待进一步深入探究。
