沉默Salusin-β对糖尿病大鼠内皮功能障碍的影响及机制研究
2023-05-08左宪宏张婷婷李月琴赵佳琪
左宪宏,张婷婷△,李月琴,赵佳琪
糖尿病(DM)是一种常见的慢性疾病,其特征是高血糖和内皮功能受损[1]。内皮功能障碍是DM 心血管并发症发病的关键和起始因素[2-3]。因此,了解DM引起的内皮功能障碍发生机制,改善或增强内皮功能对于预防DM心血管并发症有重要意义。心血管调节肽(Salusin-β)是一种内源性生物活性肽。研究显示,DM患者血清中Salusin-β水平升高,且与其心血管病变有关[4]。Salusin-β可加速血管内皮细胞的炎症反应,并增加血管平滑肌细胞氧化应激反应,加速高葡萄糖诱导的内皮细胞凋亡[5-6]。Salusin-β沉默可提高DM 主动脉内皮依赖性血管舒张功能,降低氧化应激和炎症反应,改善内皮功能障碍[7]。然而,Salusin-β在DM中的具体作用机制尚不明确。本研究旨在探讨Salusin-β在DM大鼠内皮功能障碍中的作用及其潜在的分子作用机制。
1 材料与方法
1.1 材料 SPF 级8 周龄雄性SD 大鼠52 只,体质量208~240 g,由河北北方学院实验动物中心提供,动物生产许可证号:SCXK(冀)2020-0009,在标准化条件下饲养。链脲佐菌素(STZ)购自美国Sigma-Aldrich公司;编码Salusin-β短发夹RNA(shRNA)的腺病毒载体(Ad-Salusin-β shRNA)及其阴性对照腺病毒空载体(Ad-scramble shRNA)由上海吉满生物科技有限公司构建;大鼠Salusin-β、白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)、超氧化物歧化酶(SOD)、丙二醛(MDA)酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技有限公司;二氢乙锭(DHE)超氧化物阴离子荧光探针、PCR试剂盒购自上海懋康生物科技有限公司;苏木精-伊红(HE)染色试剂、细胞核和细胞质蛋白提取试剂盒购自美国Thermo Scientific公司;兔源还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NOX2)、核因子κB p65(NF-κB p65)、核纤层蛋白B1(Lamin B1)、甘油醛-3-磷酸脱氢酶(GAPDH)一抗以及羊抗兔二抗购自武汉菲恩生物科技有限公司。Accu-Chek Active 型血糖仪、iMark680 型酶标仪、DMT 620M 型离体微血管张力测定仪购自上海怡耀科学仪器有限公司;DM2500 型荧光显微镜、7500 型荧光定量PCR(RT-qPCR)仪、Omega Fluor 型凝胶成像仪购自上海西唐生物科技有限公司。
1.2 研究方法
1.2.1 DM模型制备及分组干预 将大鼠按照随机数字表法分为正常对照(NC)组12只和造模组40只。造模组大鼠使用高糖高脂饲料(熟猪油15%、蔗糖20%、基础饲料65%)适应性喂养1 个月后,禁食12 h,一次性腹腔注射STZ(60 mg/kg)构建DM 模型[8];NC 组大鼠给予普通饲料喂养,并在禁食12 h 后腹腔注射等量柠檬酸盐缓冲液。注射STZ 后3 d 使用血糖仪测定空腹血糖(FBG)水平,选择连续3 d FBG≥16.7 mmol/L的36只大鼠进行后续实验(其余4只大鼠FBG水平不符合造模成功条件)。造模成功1周后,将36只DM大鼠按随机数字表法分为DM组、Ad-Scr shRNA组和Ad-Salusin-β shRNA 组,每组12只;Ad-Scr shRNA 组大鼠尾静脉注射Adscramble shRNA,Ad-Salusin-β shRNA 组大鼠尾静脉注射Ad-Salusin-β shRNA,剂量均为2.0×1010pfu/mL,NC 组和DM组大鼠尾静脉注射等量生理盐水。2周后重复注射1次,第2次注射后2周进行取材和相关指标检测。本研究经张家口学院伦理委员会批准(ZJKXY-2021LS-109)。
1.2.2 大鼠FBG 和血清Salusin-β 水平检测 干预结束后,禁食12 h,尾部采血1 mL,血糖仪检测大鼠FBG水平。用5%的戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,腹主动脉取血3 mL,4 ℃、3 000 r/min离心10 min分离血清,ELISA检测血清Salusin-β水平。
1.2.3 大鼠胸主动脉血管舒张功能检测 给药结束后,颈椎脱臼法处死大鼠,分离其胸主动脉,从每个主动脉切下2个长度为2~3 mm 的血管环,放入含氧和预冷的Krebs-Henseleit溶液的培养皿中。使用离体微血管张力测定仪进行实验,在实验开始之前,动脉环在最佳初始张力下平衡1 h,去氧肾上腺素(1µmol/L)收缩主动脉环,添加内皮依赖性血管舒张激活剂乙酰胆碱(Ach,浓度依次为1×10-8、1×10-7、1×10-6、1×10-5及1×10-4mol/L)或内皮非依赖性血管舒张激活剂硝普钠(SNP,浓度依次为1×10-9、1×10-8、1×10-7、1×10-6、1×10-5mol/L)刺激主动脉环舒张,主动脉舒张功能以Ach或SNP引起的血管舒张张力占去氧肾上腺素引起的血管收缩张力的百分比表示。
1.2.4 ELISA 法检测大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA 及SOD 水平 取大鼠部分胸主动脉,加9 倍质量的生理盐水研磨制备10%的组织匀浆,然后4 ℃、5 200 r/min离心5 min,取上清液,参照试剂盒说明书,ELISA法检测胸主动脉匀浆中TNF-α、IL-6、IL-1β、MDA、SOD水平。
1.2.5 DHE 染色检测胸主动脉中活性氧(ROS)水平 取大鼠部分胸主动脉,包埋在最佳切割温度化合物中,将组织切成25µm 厚的切片,与DHE(10µmol/L)一起在37 ℃下避光孵育5 min,DHE在与超氧化物反应后被氧化成溴化乙锭,后者与细胞核中的DNA结合。在荧光显微镜下观察荧光,并用Image J软件分析相对荧光强度。
1.2.6 HE染色观察大鼠胸主动脉组织病理学变化 将大鼠部分胸主动脉组织用4%多聚甲醛固定、脱水并包埋在石蜡中。石蜡包埋切片(厚度5µm)经烘烤、二甲苯脱蜡、梯度乙醇脱水,苏木精染色5 min,伊红染色2 min。在光学显微镜下观察,并用Image J软件定量评估胸主动脉内膜-中膜厚度。
1.2.7 RT-qPCR 检测大鼠胸主动脉Salusin-β 和NOX2 mRNA水平 大鼠胸主动脉总RNA用TRIzol试剂分离,通过分光光度计来评估RNA 浓度和纯度,然后将总RNA 逆转录为cDNA,将所得cDNA 用作qPCR 模板进行扩增。反应条件:95 ℃预变性5 min;95 ℃15 s,60 ℃20 s,72 ℃30 s,进行40 个循环。内参为GAPDH,引物序列见表1。2-ΔΔCt法计算Salusin-β和NOX2 mRNA的相对表达水平。
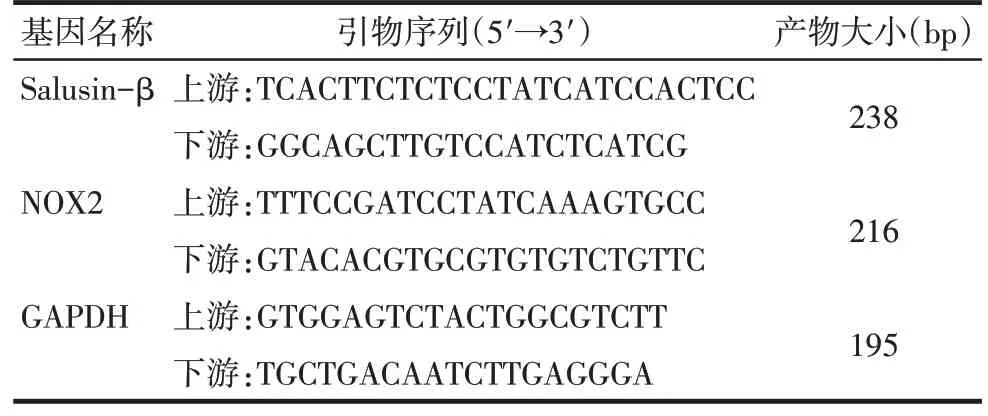
Tab.1 Primer sequences表1 引物序列
1.2.8 Western blot 法检测大鼠胸主动脉NOX2、NF-κB p65蛋白相对表达水平 取部分大鼠胸主动脉,液氮中充分研磨,采用细胞核和细胞质蛋白提取试剂盒提取蛋白。4 ℃,12 000×g离心5 min 收集上清液,并使用BCA 蛋白质测定试剂盒测定蛋白质浓度,通过电泳分离等量的蛋白质(20µg)并转移至PVDF 膜,用5%牛血清白蛋白封闭2 h 后,将膜与一抗NOX2(1∶500)、NF-κB p65(1∶500)、Lamin B1(1∶1 000)、GAPDH(1∶1 000)在4 ℃下孵育过夜。将膜与羊抗兔二抗(1∶5 000)在室温下孵育1 h,使用ECL 化学发光试剂可视化蛋白质条带,细胞核NF-κB p65 以Lamin B1 为内参蛋白,NOX2 和细胞质NF-κB p65 以GAPDH 为内参蛋白,使用Image J软件进行分析。
1.3 统计学方法 采用SPSS 25.0 统计软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠FBG 和血清Salusin-β 水平比较 与NC组比较,DM组大鼠FBG和血清Salusin-β水平升高(P<0.05)。DM 组和Ad-Scr shRNA 组大鼠FBG和血清Salusin-β 水平差异无统计学意义(P>0.05)。与DM 组 和Ad-Scr shRNA 组 比 较,Ad-Salusin-β shRNA 组大鼠FBG 和血清Salusin-β 水平降低(P<0.05),见表2。
2.2 各组大鼠胸主动脉血管舒张功能比较 与NC组比较,DM 组大鼠在不同浓度Ach(1×10-7、1×10-6、1×10-5、1×10-4mol/L)诱发条件下的内皮依赖性血管舒张功能降低(P<0.05)。DM 组和Ad-Scr shRNA组大鼠不同浓度Ach(1×10-8、1×10-7、1×10-6、1×10-5、1×10-4mol/L)诱发条件下的内皮依赖性血管舒张功能差异无统计学意义(P>0.05);与DM 组和Ad-Scr shRNA 组比较,Ad-Salusin-β shRNA 组大鼠在不同浓度Ach(1×10-7、1×10-6、1×10-5、1×10-4mol/L)诱发条件下的内皮依赖性血管舒张功能升高(P<0.05);而SNP干预后4组大鼠内皮非依赖性血管舒张功能比较差异无统计学意义(P>0.05),见表3、4。
Tab.2 Comparison of FBG and serum Salusin-β levels between the four groups of rats表2 各组大鼠FBG和血清Salusin-β水平比较(n=12,±s)

Tab.2 Comparison of FBG and serum Salusin-β levels between the four groups of rats表2 各组大鼠FBG和血清Salusin-β水平比较(n=12,±s)
**P<0.01;a与NC组比较,b与DM组比较,c与Ad-Scr shRNA组比较,P<0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F FBG(mmol/L)5.74±1.08 26.03±3.15a 27.85±3.24a 15.29±2.36abc 186.794**Salusin-β(µg/L)0.62±0.11 1.35±0.20a 1.44±0.18a 0.73±0.12bc 85.501**
Tab.3 Comparison of endothelium-dependent vasodilation function induced by Ach between the four groups of rats表3 各组大鼠Ach诱发的内皮依赖性血管舒张功能比较 (n=12,%,±s)

Tab.3 Comparison of endothelium-dependent vasodilation function induced by Ach between the four groups of rats表3 各组大鼠Ach诱发的内皮依赖性血管舒张功能比较 (n=12,%,±s)
**P<0.01;a与NC组比较,b与DM组比较,c与Ad-Scr shRNA组比较,P<0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F Ach浓度1×10-8 mol/L 5.15±0.60 5.09±0.55 5.11±0.57 5.14±0.52 0.029 1×10-7 mol/L 24.38±2.59 12.57±2.06a 11.48±2.15 19.25±2.32bc 83.675**1×10-6 mol/L 61.42±7.30 40.29±5.42a 37.68±6.04 51.33±7.15bc 33.542**1×10-5 mol/L 85.09±9.62 53.18±7.15a 51.36±6.90 68.45±8.74bc 44.256**1×10-4 mol/L 90.41±9.75 57.62±8.31a 54.53±7.42 73.86±9.50bc 42.445**
Tab.4 Comparison of endothelium independent vasodilation function induced by SNP between the four groups of rats表4 各组大鼠SNP诱发的内皮非依赖性血管舒张功能比较 (n=12,%,±s)

Tab.4 Comparison of endothelium independent vasodilation function induced by SNP between the four groups of rats表4 各组大鼠SNP诱发的内皮非依赖性血管舒张功能比较 (n=12,%,±s)
均P>0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F SNP浓度1×10-9 mol/L 10.20±1.14 10.15±1.29 9.87±1.05 10.13±1.21 0.190 1×10-8 mol/L 24.16±2.74 21.82±2.53 22.30±2.46 24.11±2.80 2.545 1×10-7 mol/L 64.48±8.20 59.31±7.45 60.27±8.16 62.54±7.93 1.027 1×10-6 mol/L 87.50±10.31 82.36±9.24 84.02±11.37 85.75±9.68 0.568 1×10-5 mol/L 94.25±12.18 89.82±10.56 91.40±10.29 93.37±11.44 0.383
Tab.5 Comparison of TNF-α,IL-6,IL-1β,MDA and SOD levels in thoracic aorta tissue between the four groups of rats表5 各组大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA、SOD水平比较 (n=12,±s)

Tab.5 Comparison of TNF-α,IL-6,IL-1β,MDA and SOD levels in thoracic aorta tissue between the four groups of rats表5 各组大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA、SOD水平比较 (n=12,±s)
**P<0.01;a与NC组比较,b与DM组比较,c与Ad-Scr shRNA组比较,P<0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F TNF-α(ng/g)82.45±11.03 275.26±32.58a 280.31±35.27 143.19±24.65bc 153.271**IL-6(ng/g)34.76±5.62 156.35±20.13a 164.49±21.58 82.51±14.07bc 167.687**IL-1β(ng/g)15.22±2.41 61.68±7.53a 63.19±6.82 34.04±5.39bc 186.272**MDA(µmol/g)3.24±0.50 9.57±0.76a 9.63±0.81 5.80±0.64bc 245.793**SOD(kU/g)54.06±6.39 21.83±3.65a 22.12±4.08 40.35±5.54bc 115.173**
2.3 各组大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA、SOD 水平比较 与NC 组比较,DM 组大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA 水平升高,SOD 水平降低(P<0.05);DM 组和Ad-Scr shRNA 组大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA、SOD水平差异无统计学意义(P>0.05);与DM 组和Ad-Scr shRNA组比较,Ad-Salusin-β shRNA组大鼠胸主动脉组织TNF-α、IL-6、IL-1β、MDA 水平降低,SOD水平升高(P<0.05),见表5。
2.4 各组大鼠胸主动脉ROS水平比较 与NC组比较,DM 组大鼠胸主动脉ROS 水平升高(P<0.05);DM组和Ad-Scr shRNA组大鼠胸主动脉ROS水平差异无统计学意义(P>0.05);与DM 组和Ad-Scr shRNA 组比较,Ad-Salusin-β shRNA 组大鼠胸主动脉ROS水平降低(P<0.05);见图1、表6。
2.5 各组大鼠胸主动脉组织病理学变化 NC 组大鼠的胸主动脉内皮光滑、结构完整,DM组和Ad-Scr shRNA组血管壁上的内皮细胞脱落,胸主动脉内膜-中膜厚度较NC 组增加(P<0.05);与DM 组和Ad-Scr shRNA组比较,Ad-Salusin-β shRNA组大鼠内皮相对光滑完整,主动脉内皮结构的损伤减轻,胸主动脉内膜-中膜厚度变薄(P<0.05),见图2、表6。

Fig.1 ROS levels in thoracic aorta of rats in each group(DHE fluorescence method,×200)图1 各组大鼠胸主动脉ROS水平(DHE荧光法,×200)

Fig.2 HE staining of thoracic aorta tissue of rats in each group(×200)图2 各组大鼠胸主动脉组织HE染色图(×200)
2.6 各组大鼠胸主动脉Salusin-β 和NOX2 mRNA水平比较 与NC 组比较,DM 组大鼠胸主动脉Salusin-β 和NOX2 mRNA 表达水平升高(P<0.05);DM 组和Ad-Scr shRNA 组大鼠胸主动脉Salusin-β和NOX2 mRNA 表达水平差异无统计学意义(P>0.05);与DM 组 和Ad-Scr shRNA 组 比 较,Ad-Salusin-β shRNA 组 大 鼠 胸 主 动 脉Salusin-β 和NOX2 mRNA表达水平降低(P<0.05),见表7。
2.7 各组大鼠胸主动脉NOX2和NF-κB p65蛋白表达水平比较 与NC 组比较,DM 组大鼠胸主动脉NOX2和细胞核NF-κB p65蛋表达白水平升高,细胞质NF-κB p65 蛋白表达水平降低(P<0.05);DM 组和Ad-Scr shRNA 组大鼠胸主动脉NOX2、细胞核NF-κB p65、细胞质NF-κB p65 蛋白表达水平差异无统计学意义(P>0.05);与DM组和Ad-Scr shRNA组比较,Ad-Salusin-β shRNA 组大鼠胸主动脉NOX2和细胞核NF-κB p65蛋白表达水平降低,细胞质NF-κB p65 蛋白表达水平升高(P<0.05),见图3、表8。
Tab.6 Comparison of ROS levels and intima-media thickness of thoracic aorta between the four groups of rats表6 各组大鼠胸主动脉ROS水平和内膜-中膜厚度比较(n=12,±s)

Tab.6 Comparison of ROS levels and intima-media thickness of thoracic aorta between the four groups of rats表6 各组大鼠胸主动脉ROS水平和内膜-中膜厚度比较(n=12,±s)
**P<0.01;a与NC组比较,b与DM组比较,c与Ad-Scr shRNA组比较,P<0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F ROS 1.00±0.00 3.58±0.37a 3.64±0.42 1.76±0.23bc 229.973**胸主动脉内膜-中膜厚度(µm)45.18±5.26 82.37±9.41a 84.20±9.33 63.56±7.68bc 61.418**
Tab.7 Comparison of Salusin-β and NOX2 mRNA levels in thoracic aorta of rats between the four groups表7 各组大鼠胸主动脉Salusin-β和NOX2 mRNA水平比较 (n=12,±s)

Tab.7 Comparison of Salusin-β and NOX2 mRNA levels in thoracic aorta of rats between the four groups表7 各组大鼠胸主动脉Salusin-β和NOX2 mRNA水平比较 (n=12,±s)
**P<0.01;a与NC组比较,b与DM组比较,c与Ad-Scr shRNA组比较,P<0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F Salusin-β mRNA 1.00±0.00 2.58±0.31a 2.63±0.35 1.41±0.22bc 122.565**NOX2 mRNA 1.00±0.00 2.12±0.23a 2.17±0.28 1.56±0.20bc 84.649**
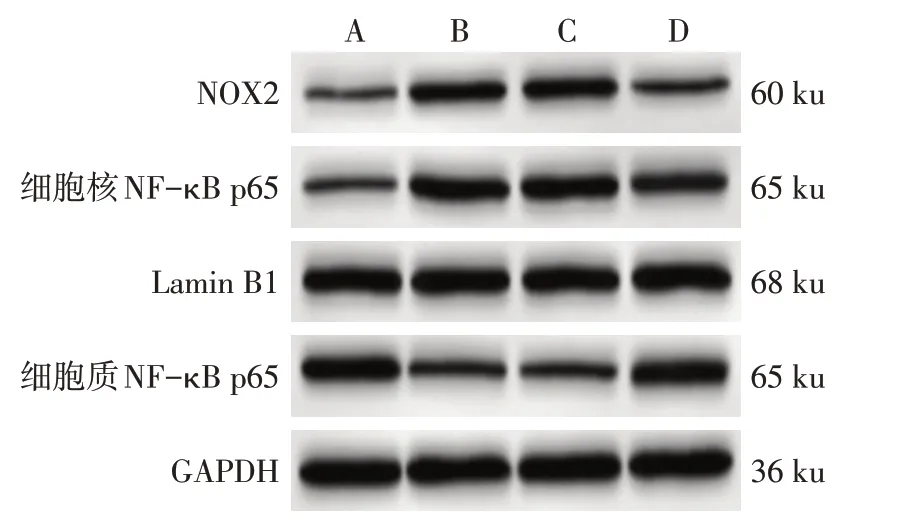
Fig.3 Western blot assay of NOX2,nuclear NF-κB p65 and cytoplasmic NF-κB p65 in thoracic aorta of rats in each group图3 各组大鼠胸主动脉NOX2、细胞核NF-κB p65、细胞质NF-κB p65蛋白印迹图
Tab.8 Comparison of NOX2,nuclear NF-κB p65 and cytoplasmic NF-κB p65 protein levels in thoracic aorta of rats between the four groups表8 各组大鼠胸主动脉NOX2、细胞核NF-κB p65、细胞质NF-κB p65蛋白水平比较 (n=12,±s)

Tab.8 Comparison of NOX2,nuclear NF-κB p65 and cytoplasmic NF-κB p65 protein levels in thoracic aorta of rats between the four groups表8 各组大鼠胸主动脉NOX2、细胞核NF-κB p65、细胞质NF-κB p65蛋白水平比较 (n=12,±s)
**P<0.01;a与NC组比较,b与DM组比较,c与Ad-Scr shRNA组比较,P<0.05。
组别NC组DM组Ad-Scr shRNA组Ad-Salusin-β shRNA组F NOX2/GAPDH 0.34±0.05 0.82±0.09a 0.85±0.07 0.49±0.06bc 157.571**细胞核NF-κB p65/Lamin B1 0.45±0.07 0.90±0.10a 0.92±0.11 0.63±0.08bc 73.437**细胞质NF-κB p65/GAPDH 0.86±0.09 0.41±0.05a 0.39±0.06 0.72±0.08bc 125.903**
3 讨论
慢性并发症是DM 死亡和致残的主要原因,DM大血管病变是其主要并发症,严重威胁患者生命健康。内皮功能障碍是大多数心血管疾病预后不良的早期独立预测因子,也是DM 相关的心血管疾病初始病理改变之一[9-10]。因此,改善内皮功能障碍被认为是DM治疗的有效策略之一。
Salusin-β是重要的血管活性肽,是心肌细胞[6]、血管平滑肌细胞[11]、内皮细胞[7]和肾细胞[12]中的潜在促氧化剂,与高血压[13]、冠状动脉粥样硬化[14]等心血管疾病关系密切。DM患者血清Salusin-β水平升高[4],并且在DM 大鼠的心肌中也可见Salusin-β表达上调[6]。此外,在DM 肾损伤中,高糖以剂量和时间依赖性上调Salusin-β蛋白表达,引发肾小管细胞损伤[15]。本研究发现,STZ 联合高糖高脂饮食诱导的DM 大鼠血清Salusin-β 和胸主动脉中Salusinβ mRNA 水平均增加,这与既往的研究结果一致[13-14],表明高血糖可促进Salusin-β 高表达。此外,在本研究中,Salusin-β 的过度表达伴随着胸主动脉内皮细胞出现氧化应激、炎症反应、细胞内过量的ROS 和NOX2 生成以及内皮依赖性血管舒张障碍,而沉默Salusin-β 的表达通过抑制胸主动脉中NOX2和ROS上调,改善了DM大鼠胸主动脉环的内皮依赖性血管舒张,阻止了DM 介导的内皮损伤。这与Salusin-β的促氧化活性一致[7],提示Salusin-β可能在DM 的内皮功能中起作用,Salusin-β 沉默对DM的内皮功能障碍发挥保护作用。
高血糖引起的内皮细胞损伤与ROS的过量生成有关,因为高血糖引发的ROS会诱导内皮细胞凋亡、一氧化氮生物活性降低和内皮依赖性血管舒张障碍[16-17]。ROS由还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶产生,并被内源性抗氧化剂SOD清除。沉默Salusin-β 表达能有效降低血管内ROS 的产生[18]。Salusin-β可通过激活NADPH 氧化酶衍生的ROS 生成和抑制内皮型一氧化氮合酶激活及NO释放,减弱内皮依赖性血管舒张活性[13]。NF-κB 是一种转录因子,可被细胞因子、ROS、细菌或病毒产物等多种刺激物激活。激活的NF-κB 易位到细胞核中并刺激相关基因表达,在DM 的发展中具有关键作用,内皮细胞的炎症反应也参与了DM 血管并发症的发病过程[19]。已有研究显示,Salusin-β可通过诱导NOX2衍生的ROS产生和NF-κB p65的核易位,加重糖尿病心肌病的心脏炎症反应[6],并通过激活NF-κB 信号传导促进人脐静脉内皮细胞的炎症反应[7]。本研究结果亦显示,DM 大鼠胸主动脉IL-1β、TNF-α 和IL-6 水平均较NC 组上调,并且DM 大鼠细胞核NF-κB p65蛋白水平较NC组增加,细胞质NF-κB p65 蛋白水平较NC 组减少,沉默Salusin-β的表达后这些指标水平逆转,表明Salusin-β可通过激活NF-κB信号传导诱导炎症反应。Sun等[18]在体外细胞实验中研究显示,在高糖处理的H9c2细胞中加入NADPH 氧化酶抑制剂或NF-κB抑制剂可阻止Salusin-β 诱导的炎症和NF-κB p65 的核易位,进而减轻H9c2 细胞氧化应激和炎症反应。Zhao 等[6]发现NOX2 小干扰RNA 转染、ROS 清除剂、NADPH 氧化酶和NF-κB 抑制剂可阻止Salusin-β 诱导的血管平滑肌细胞ROS 产生和NF-κB p65 核易位,减轻血管平滑肌细胞迁移和血管损伤诱导的内膜增生。因此,笔者认为Salusin-β对血管内皮细胞可产生促炎作用,抗Salusin-β 治疗可能是治疗DM 的内皮损伤的新策略。
研究发现,下调Salusin-β 表达可通过降低miR-155-5p表达,抑制高糖诱导的肾小管上皮细胞炎症反应、氧化应激、细胞凋亡和脂质积聚,保护肾小管上皮细胞[20];且miR-155-5p表达的下调与糖尿病肾病小鼠中FBG 水平的降低有关[21]。本研究结果亦显示,沉默Salusin-β可降低DM大鼠FBG水平,考虑可能原因为Salusin-β对DM大鼠FBG的调控作用与miR-155-5p有关,在后续的研究中将对此进行深入分析。
综上所述,Salusin-β 可能通过激活NOX2/ROS/NF-κB 信号通路诱导DM 大鼠内皮功能障碍;沉默Salusin-β 可改善DM 大鼠胸主动脉内皮功能障碍,其作用机制可能与下调NOX2 表达、减少ROS 的产生和抑制NF-κB p65的核易位有关。
