麝香保心丸对缺氧复氧心肌细胞的保护作用及凋亡的影响
2023-05-08魏娜李思源高苑王雪瑞肖斌牛艺璇杨文霞刘振兵
魏娜,李思源,高苑,王雪瑞,肖斌,牛艺璇,杨文霞,刘振兵
急性ST段抬高型心肌梗死(STEMI)是缺血性心脏病患者的首要死因[1]。再灌注治疗是STEMI患者的主要治疗方法。然而,再灌注治疗常诱发心肌缺血再灌注损伤(MIRI),扩大心肌梗死面积,甚至导致STEMI 患者死亡[2-3]。目前,临床尚无有效治疗STEMI患者MIRI的措施[4]。细胞凋亡是一种程序性细胞死亡,是MIRI 发展的关键因素。既往研究表明,抑制细胞凋亡途径可以有效缓解MIRI[5]。麝香保心丸(shexiang baoxin pill,SBP)作为传统中药复方制剂,可减轻STEMI 患者MIRI,改善心肌再灌注损伤,缩小心肌梗死面积[6]。其作用机制具有多样性,如抑制氧化应激和炎症、促进心脏血管生成及调节心肌细胞的能量代谢等[7]。然而,SBP 对心肌细胞MIRI 的保护作用及其对凋亡的影响研究鲜见。本研究旨在探讨SBP对缺氧复氧心肌细胞的保护作用及其是否通过细胞凋亡机制实现。
1 材料与方法
1.1 材料 大鼠心肌细胞H9C2购自上海中乔新舟生物科技有限公司。SBP购自上海和黄药业有限公司,规格剂量:22.5 mg×42 丸/瓶,国药准字:Z31020068。CCK-8 试剂盒、胰蛋白酶、BCA试剂盒、ECL发光液、压片暗盒、X-OMAT BT 胶片、电泳液、PVDF膜、裂解液、TBST购自上海碧云天生物科技有限公司。高糖DMEM培养基、无糖DMEM培养基、胎牛血清(FBS)购自美国Gibco公司。青-链霉素购自美国Hyclone公司。甲醇、二氯甲烷购自国药集团。Anexxin-V FITC/PI双染色试剂盒购自BD公司。转膜液、牛血清白蛋白(BSA)、彩虹180广谱蛋白Marker购自北京索莱宝生物科技有限公司。B细胞淋巴瘤因子2(Bcl-2)抗体(兔抗、ab194583)购自Abcam 公司。Bcl-2 相关X 蛋白(Bax)抗体(兔抗、14796S)、胱天蛋白酶-3(Caspase-3)抗体(兔抗、14220S)、山羊抗兔二抗(7074S)购自CST公司。酶标仪(型号:ELX-800)购自BioTek公司。流式细胞仪(型号:FACSCanto Ⅱ)购自BD公司。
1.2 研究方法
1.2.1 药物提取(水提法) 取SBP 并碾成粉末,在20 mL蒸馏水中加入1 g SBP 粉末,微热混匀制成50 g/L 混悬液,1 500 r/min离心5 min后保留上清液,用0.22µm微孔滤膜过滤清除颗粒物,4 ℃保存备用。在使用时将工作液按分组需要进行稀释,配制成含相应浓度SBP的完全培养基。
1.2.2 细胞培养、缺氧-复氧模型建立和分组 细胞培养:将心肌细胞H9C2培养于37 ℃5%CO2、1%青-链霉素、10%FBS的高糖DMEM培养基,融合度处于80%以上时用胰酶消化并传代,选择对数生长期发育状况良好的细胞进行后续实验。缺氧-复氧模型建立:按照5 000个/孔将H9C2细胞接种于96孔板,培养24 h 后将完全培养基替换为无糖、无血清DMEM培养基,模拟缺氧时间分别为2 h、3 h、6 h(缺氧时的氧浓度:0),达到规定时间后替换为完全培养基复氧2 h(复氧时的氧浓度:95%);用CCK-8检测细胞活性,选择细胞活力为50%~60%的时间即为缺氧-复氧模型时间。将细胞随机分为6组:对照组,用等体积完全培养基正常培养心肌细胞;模型组,只进行缺氧-复氧处理;0.5、1、2及5 g/L SBP组分别用含相应浓度SBP的培养基预处理心肌细胞24 h,再进行缺氧-复氧处理。
1.2.3 CCK-8 法检测各组细胞存活率 取相应处理后的各组细胞,加入10µL CCK-8试剂,轻轻震荡,37 ℃孵育2 h,采用酶标仪测定450 nm 波长处的光密度(OD)值,细胞存活率(%)=(实验组OD 值-空白组OD 值)/(对照组OD 值-空白组OD值)×100%。为减少实验误差,每组重复12次。
1.2.4 Anexxin-V FITC/PI 双染色法检测各组细胞的凋亡率 将H9C2细胞接种至6孔板,调整细胞密度为1.5×105个/孔,培养24 h,将对照组、模型组和2 g/L SBP 组进行相应处理。干预结束后用不含EDTA 的胰酶消化并收集细胞,4 ℃、1 200 r/min 离心5 min,用预冷的PBS 清洗2 次,1 200 r/min离心5 min。结合缓冲液重悬心肌细胞,调整细胞密度为1×106个/mL,取100 µL 细胞用于染色。加入5 µL Annexin V-FITC 和10µL PI,轻轻混匀。避光、室温反应10~15 min。加入400µL结合缓冲液,混匀后置于冰上并在1 h内用流式细胞仪上机检测,用Cell Quest pro分析。
1.2.5 Western blot检测各组细胞Bax、Bcl-2、Caspase-3蛋白表达 用胰酶消化并收集对照组、模型组和2 g/L SBP 组细胞,加入相应的裂解液,-20 ℃裂解40 min,在12 000 r/min离心20 min,只保留上清液即总蛋白。采用BCA蛋白试剂盒进行蛋白浓度测定蛋白浓度。蛋白变性、上样、电泳3~4 h,湿法转膜1~2 h。用5%BSA封闭液室温封闭2 h,β-actin、Bax、Bcl-2及Caspase-3一抗(均1∶1 000稀释)分别在4 ℃下孵育过夜。用TBST 洗膜5 min,重复5 次。二抗(1∶2 000)孵育PVDF 膜1 h,再次洗膜5 次,每次5 min。用ECL 发光液浸润PVDF膜,完全避光放置于压片暗盒内并覆盖X-OMAT BT胶片30 s~3 min,将胶片先后置于显影液和定影液中显影成像,后将胶片晾干保存,再用扫描仪扫描胶片。用Image J 软件分析各蛋白条带灰度值。
1.3 统计学方法 采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 缺氧-复氧模型的建立 与对照组(100%±0%)比较,分别缺氧2 h、3 h及6 h,复氧2 h后,对应的细胞存活率为72.76%±4.84%、60.27%±0.58%及49.70%±4.92%。缺氧3 h,复氧2 h 后细胞活力维持在50%~60%,因此选择此缺氧-复氧条件进行后续实验。
2.2 各组细胞存活率比较 对照组、模型组、0.5 g/L SBP 组、1 g/L SBP 组、2 g/L SBP 组及5 g/L SBP 组心肌细胞存活率分别为100%±0%、60.29%±0.93%、69.66%±0.66%、 78.98%±0.77%、 84.30%±1.50%、81.35%±0.91%(n=12,F=441.545,P<0.01)。与对照组比较,各组心肌细胞存活率均下降;与模型组比较,各SBP 处理组心肌细胞存活率均升高(P<0.05);2 g/L SBP组细胞存活率最高,用作后续实验。
2.3 各组细胞凋亡率和Bax、Bcl-2、Caspase-3 蛋白相对表达水平比较 与对照组比较,模型组和2 g/L SBP 组凋亡率、Bax、Caspase-3 相对表达水平升高(P<0.05),而模型组与对照组Bcl-2 差异无统计学意义,2 g/L SBP 组与模型组和对照组比较Bcl-2 相对表达水平升高(P<0.05);与模型组比较,2 g/L SBP组凋亡率、Bax、Caspase-3 相对表达水平下降,而Bcl-2 相对表达水平和Bcl-2/Bax 比值升高(P<0.05)。见图1、2,表1。
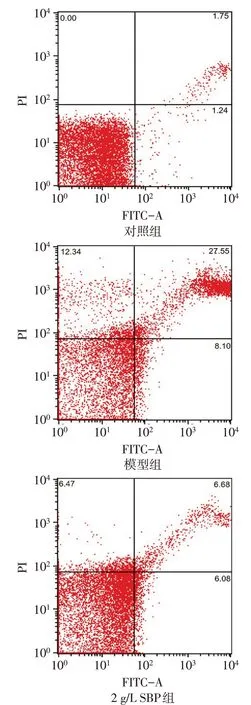
Fig.1 Results of flow cytometry of apoptosis in each group图1 各组细胞流式细胞仪检测图
3 讨论
SBP是我国传统中药复方制剂,由人工麝香、人参提取物、人工牛黄、肉桂、苏合香、蟾酥、冰片配方而成[8]。研究证实,SBP 主要用于治疗缺血性心脏病[9],可减少STEMI患者心血管不良事件发生率[10]。动物研究证实,SBP 可减少鼠MIRI 和梗死面积,并预防心肌重构[11-12]。SBP 化学成分十分复杂,主要有挥发性的小分子成分和不易挥发的胆酸、皂苷类等[9]。选用适当的溶剂是最大限度地发挥药物活性的关键[13]。本研究发现,采用水提法提取SBP 有效成分对缺氧复氧心肌细胞显示出明显的保护作用。其原因可能与挥发性成分有效保存和人参皂苷类物质吸收程度有关[14]。
MIRI 是影响STEMI 患者疗效的主要因素之一[15]。目前,单一治疗措施对MIRI治疗的有效性结论并不一致。研究显示,远端缺血预适应可降低STEMI 患者心肌梗死面积,增加心肌挽救指数[16]。然而,一项纳入5 401 例STEMI 患者的CONDI-2/ERIC-PPCI研究并没有发现远端缺血预适应可以降低心肌梗死面积[4]。García-Ruíz 等[17]研究发现,早期给予STEMI患者注射美托洛尔注射液可降低心肌梗死面积。然而,一项多中心随机对照试验并没有发现美托洛尔注射液能够降低STEMI患者心肌梗死面积[18]。SBP在急性心肌梗死防治中具有多种靶向作用。本团队既往研究发现,SBP 能够降低STEMI患者MIRI和心肌梗死面积,改善心肌再灌注和心功能[6]。既往研究也发现,SBP 的主要组成成分人参、麝香和肉桂提取物均可降低实验动物MIRI 和心肌梗死面积[19]。本实验亦证实,与模型组比较,不同浓度SBP 使缺氧复氧心肌细胞的存活率均升高,表明SBP对缺氧复氧心肌细胞具有保护作用。

Fig.2 Comparison of relative expression levels of Bax,Bcl-2 and Caspase-3 proteins between different cell groups图2 各组细胞Bax、Bcl-2、Caspase-3蛋白相对表达水平比较
Tab.1 Comparison of apoptosis and relative expression levels of Bax,Bcl-2 and Caspase-3 proteins between different cell groups表1 各组细胞凋亡率和Bax、Bcl-2、Caspase-3蛋白相对表达水平比较 (n=12,±s)
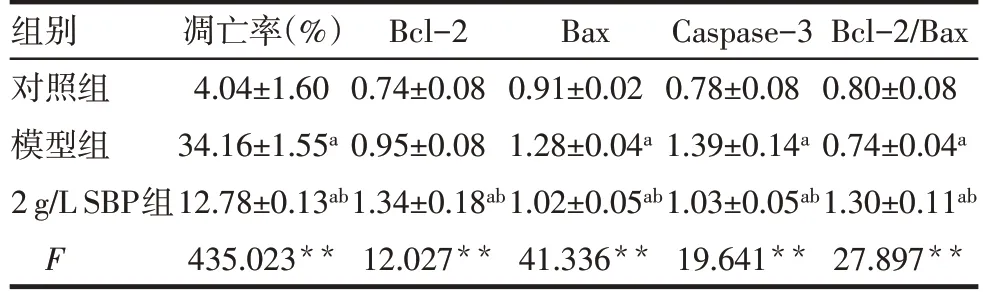
Tab.1 Comparison of apoptosis and relative expression levels of Bax,Bcl-2 and Caspase-3 proteins between different cell groups表1 各组细胞凋亡率和Bax、Bcl-2、Caspase-3蛋白相对表达水平比较 (n=12,±s)
**P<0.01;a与对照组比较,b与模型组比较,P<0.05。
组别对照组模型组2 g/L SBP组F凋亡率(%)4.04±1.60 34.16±1.55a 12.78±0.13ab 435.023**Bcl-2 0.74±0.08 0.95±0.08 1.34±0.18ab 12.027**Bax 0.91±0.02 1.28±0.04a 1.02±0.05ab 41.336**Caspase-3 0.78±0.08 1.39±0.14a 1.03±0.05ab 19.641**Bcl-2/Bax 0.80±0.08 0.74±0.04a 1.30±0.11ab 27.897**
大量研究表明,MIRI 发生后,Bax 和Caspase-3表达升高,而Bcl-2表达降低,这与心肌细胞凋亡有关[20]。因此,调节凋亡蛋白表达可能是治疗MIRI的潜在靶点。心肌细胞凋亡是由MIRI 引起的不可逆事件,减少细胞凋亡可有效预防MIRI[21]。Bcl-2 家族由促凋亡Bax 和抗凋亡Bcl-2 组成,Bcl-2/Bax 比也通常用于评估细胞在外部刺激下的抗凋亡能力,比值越大,说明抗凋亡能力越强。本实验亦证实,与模型组比较,2 g/L SBP 组Bcl-2/Bax 比值增大,说明SBP 可增强缺氧复氧心肌细胞的抗凋亡能力。Caspase-3表达量直接反映细胞凋亡程度,是细胞凋亡的最关键的执行分子[22]。本实验亦证实,与模型组比较,2 g/L SBP组使缺氧复氧心肌细胞的凋亡率、Bax、Caspase-3 相对表达水平下降,而Bcl-2 相对表达水平升高,证实了SBP 通过抑制缺氧复氧心肌细胞的凋亡发挥减轻MIRI的作用。
