抑制PI3K/Akt/mTOR信号通路对MPP+处理的SH-SY5Y细胞自噬、凋亡及PD特征蛋白表达的影响
2023-05-08王飞张小蕾李含章李亚楠胡梦妮马骏
王飞,张小蕾,李含章,李亚楠,胡梦妮,马骏△
帕金森病(Parkinson's disease,PD)是一种常见的中枢神经系统退行性疾病,其特征是黑质致密部位多巴胺能神经元的进行性变性和神经元内包涵体(路易体)的形成。酪氨酸羟化酶(tyrosine hydroxylase,TH)是一种合成多巴胺的关键酶,其表达减少可增加PD 的发生率[1]。α-突触核蛋白(αsynuclein,α-syn)是路易体的主要组成部分,α-syn的异常积聚是PD 发生的重要环节之一[2-3]。然而,PD的确切发病机制尚不清楚。相关研究表明,线粒体功能障碍、氧化应激、内质网应激、自噬功能障碍和钙超载等因素均可导致PD 的发生与进展[4]。已有研究证实,自噬功能障碍在包括PD、阿尔茨海默病等的神经系统疾病中非常重要[5]。据报道,多巴胺神经元的自噬受PD相关基因和神经毒素的影响,进而引发α-syn的异常积聚[6]。由于自噬是参与αsyn降解的主要过程之一,因此上调自噬可能是减轻α-syn 聚集性的一种值得探究的策略。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of Rapamycin,mTOR)途径是一条经典的自噬途径[7]。已有研究报道,PI3K/Akt/mTOR信号通路异常参与了PD的发生发展[8]。1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)是一种1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine,MPTP)在体内的代谢产物,主要用于建立SH-SY5Y细胞PD 模型[8]1612。本研究使用MPP+建立PD 模型,探讨PI3K/Akt/mTOR 信号通路在PD 发病机制中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞与主要试剂 人神经母细胞瘤SH-SY5Y细胞购自美国ATCC;DEME培养基、青-链霉素、胎牛血清购自美国Thermo Fisher Scientific;CCK-8 细胞增殖及毒性检测试剂盒购自北京康瑞纳;PI3K/Akt 激活剂胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1,纯度≥97%)、PI3K/Akt 抑制剂LY294002(纯度99.87%)购自美国MCE;Annexin VFITC/PI 双染细胞凋亡检测试剂盒购自上海Fuyuanbio;MPP+(纯度≥98%)、吖啶橙(acridine orange,AO)购自美国Sigma-Aldrich;添加PMSF 的RIPA 裂解液购自广州Applygen;兔抗人α-syn、TH、p62、微管相关蛋白1 轻链3B(microtubuleassociated protein 1 light chain 3B,LC3B)、p-mTOR、mTOR、p-PI3K、PI3K、p-Akt、Akt和β-actin抗体及山羊抗兔IgG二抗购自英国Abcam。
1.1.2 主要仪器 ELx808TM光吸收酶标仪购自美国Biotek;FACSCalibur流式细胞仪购自美国BD Biosciences;BX43生物显微镜购自日本Olympus。
1.2 方法
1.2.1 细胞培养 SH-SY5Y 细胞在含有10%胎牛血清、100 U/mL 青-链霉素的DEME 培养基中生长,置于37 ℃、5%CO2、湿度70%~80%的细胞培养箱中。
1.2.2 CCK-8 检测细胞存活率 将SH-SY5Y 细胞接种于96 孔板(5×104个/孔)中,使用不同浓度(0.25、0.5、0.75、1.0 mmol/L)的MPP+处理SH-SY5Y 细胞24 h。加入CCK-8(10 µL/孔)溶液培养2 h。使用酶标仪在450 nm 波长处检测吸光度,细胞存活率=(实验组吸光度/对照组吸光度)×100%。
1.2.3 细胞分组 通过显微镜观察细胞,当其融合度达70%~80%时细胞处于对数生长期,说明生长状态良好。将此时的SH-SY5Y 细胞接种于96 孔板,依次分为:Control 组(不做任何处理)、MPP+组(0.5 mmol/L MPP+处理)、IGF-1 组(0.1 mg/L IGF-1 处理)[9]、LY294002 组(10µmol/L LY294002处理)[8]和MPP++LY294002 组(0.5 mmol/L MPP+和10µmol/L LY294002 处理)。各组细胞均处理24 h。参照1.2.2 方法对各组SH-SY5Y细胞存活率进行检测。
1.2.4 流式细胞术检测细胞凋亡 将SH-SY5Y细胞接种于6 孔板,如1.2.3 分组处理后,收集细胞(5×105个/孔),然后每孔中添加500 µL 的Annexin V 结合缓冲液悬浮细胞(1×106个/mL),吸取100 µL 悬浮液于流式管中,添加5 µL Annexin V-FITC 和10 µL PI 溶液,室温下遮光孵育10 min。使用流式细胞仪在激发波长488 nm,发射波长530 nm 处对每个样本进行分析。使用BD CellQuest Pro 软件对结果进行分析。
1.2.5 AO 染色观察自噬空泡 将SH-SY5Y 细胞接种于24孔板,如1.2.3 分组处理后,每孔中添加2 mL AO(5 g/L)染色25 min,使用显微镜获取图像。红色荧光即表示为自噬空泡,统计有自噬空泡的细胞占总细胞的百分比。
1.2.6 Western blot 检测PI3K/Akt/mTOR 信号通路相关蛋白表达水平 使用添加PMSF 的RIPA 裂解液裂解各组处理的SH-SY5Y 细胞,取上清液进行Western blot 分析。裂解产物经10%SDS-PAGE电泳分离后,于4 ℃下转移到PVDF膜上。使用5%牛血清白蛋白封闭1 h。然后添加α-syn、TH、p62、LC3B、p-mTOR、mTOR、p-PI3K、PI3K、p-Akt、Akt 和β-actin一抗(1∶1 000)孵育。使用HRP标记的IgG二抗(1∶2 000)室温孵育1 h。化学发光法检测。通过Image J软件对灰度值进行量化。以目的蛋白与内参蛋白灰度值的比值评估目的蛋白表达水平。
1.3 统计学方法 采用GraphPad Prism软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,然后进行Tukey事后检验。P<0.05为差异有统计学意义。
2 结果
2.1 MPP+对SH-SY5Y细胞存活率的影响 0、0.25、0.5、0.75、1.0 mmol/L MPP+处理后,SH-SY5Y 细胞存活率(%)分别为100.00±0.00、78.36±5.23、55.29±4.68、42.83±5.99、35.27±4.64,组间比较差异有统计学意义(n=6,F=199.553,P<0.05)。与0 mmol/L MPP+相比,0.25、0.5、0.75、1.0 mmol/L MPP+明显降低SH-SY5Y 细胞存活率,且呈剂量依赖性下降。与0 mmol/L MPP+相比,0.5 mmol/L MPP+作用24 h 后,细胞存活率下降约50%,故以0.5 mmol/L MPP+作为后续研究浓度。
2.2 抑制PI3K/Akt/mTOR 信号通路对MPP+诱导的SH-SY5Y 细胞增殖、凋亡的影响 与Control 组比较,MPP+组和IGF-1组细胞存活率降低,凋亡率增高(P<0.05),LY294002 组细胞存活率增高,凋亡率降低(P<0.05)。与MPP+组比较,MPP++LY294002 组细胞存活率增高,凋亡率降低(P<0.05);与LY294002组比较,MPP++LY294002组细胞存活率降低,凋亡率增高(P<0.05)。而MPP+组和IGF-1组细胞存活率和凋亡率差异无统计学意义(P>0.05),见图1、表1。

Fig.1 Apoptosis of SH-SY5Y cells detected by flow cytometry图1 流式细胞仪检测SH-SY5Y细胞凋亡情况
Tab.1 Comparison of survival rate and apoptosis rate of SH-SY5Y cells between the five groups表1 各组SH-SY5Y细胞存活率、凋亡率比较(n=6,%,±s)

Tab.1 Comparison of survival rate and apoptosis rate of SH-SY5Y cells between the five groups表1 各组SH-SY5Y细胞存活率、凋亡率比较(n=6,%,±s)
**P<0.01;a与Control 组比较,b与MPP+组比较,c与LY294002 组比较,P<0.05;表2—4同。
组别Control组MPP+组IGF-1组LY294002组MPP++LY294002组F细胞存活率100.00±0.00 52.64±3.25a 58.69±4.15a 136.29±8.34ab 78.24±7.52bc 226.163**细胞凋亡率9.36±0.98 23.48±3.07a 19.67±3.24a 4.19±0.45ab 16.35±2.18bc 70.666**
Tab.2 Comparison of autophagic vacuoles ratio,expression levels of p62 and LC3B proteins between the five groups表2 各组SH-SY5Y细胞自噬空泡比例及p62、LC3B蛋白表达水平比较 (n=6,±s)

Tab.2 Comparison of autophagic vacuoles ratio,expression levels of p62 and LC3B proteins between the five groups表2 各组SH-SY5Y细胞自噬空泡比例及p62、LC3B蛋白表达水平比较 (n=6,±s)
组别Control组MPP+组IGF-1组LY294002组MPP++LY294002组F自噬空泡比例(%)75.36±9.36 24.36±2.58a 26.47±2.64a 89.89±9.08ab 61.51±5.59bc 119.538**p62 0.45±0.03 1.28±0.09a 1.15±0.10a 0.24±0.02ab 0.79±0.06bc 256.787**LC3BⅡ/Ⅰ0.89±0.09 0.24±0.03a 0.17±0.02a 1.28±0.11ab 0.57±0.05bc 267.938**
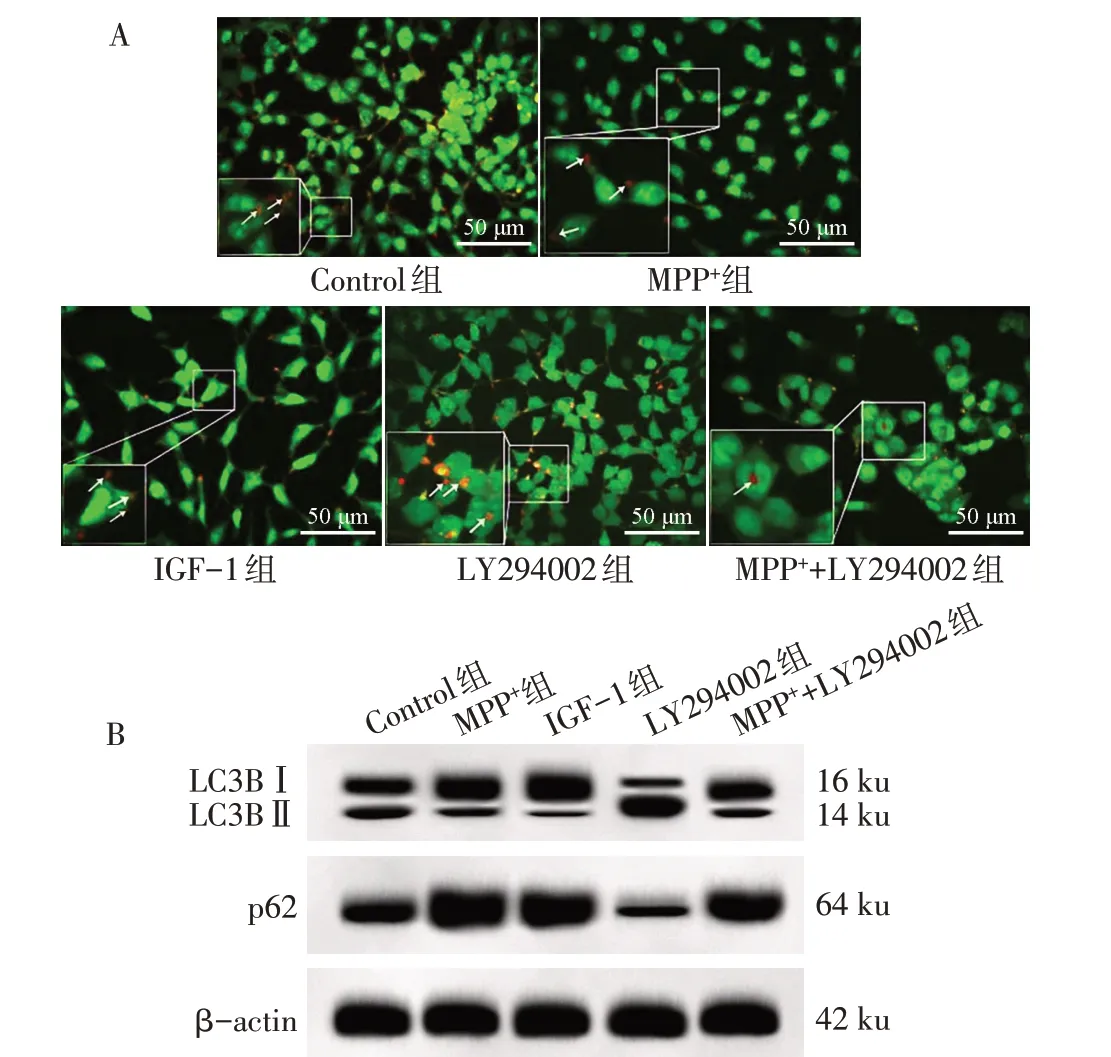
Fig.2 Effects of inhibiting PI3K/Akt/mTOR signaling pathway on autophagy of SH-SY5Y cells treated with MPP+图2 抑制PI3K/Akt/mTOR信号通路对MPP+处理的SH-SY5Y细胞自噬的影响
2.3 抑制PI3K/Akt/mTOR 信号通路对MPP+诱导的SH-SY5Y细胞自噬能力的影响 与Control组比较,MPP+组和IGF-1组细胞中自噬空泡减少,LC3BⅡ/Ⅰ降低,p62 蛋白水平增高(P<0.05);LY294002 组细胞自噬空泡增多,LC3BⅡ/Ⅰ升高,p62 蛋白水平降低(P<0.05)。与MPP+组比较,MPP++LY294002 组细胞自噬空泡增多,LC3BⅡ/Ⅰ升高,p62 蛋白水平降 低(P<0.05);与LY294002 组 比 较,MPP++LY294002 组细胞自噬空泡减少,细胞中LC3BⅡ/Ⅰ降低,p62 蛋白水平增高(P<0.05)。而MPP+组和IGF-1 组细胞中自噬空泡比例、LC3BⅡ/Ⅰ以及p62蛋白水平差异无统计学意义(P>0.05),见表2、图2。
2.4 抑制PI3K/Akt/mTOR 信号通路对MPP+诱导的SH-SY5Y 细胞PD 特征蛋白表达的影响 与Control组比较,MPP+组和IGF-1 组的SH-SY5Y 细胞中TH蛋白水平降低,α-syn 蛋白水平增高(P<0.05);LY294002组SH-SY5Y细胞中TH蛋白水平增高,αsyn 蛋白水平降低(P<0.05)。与MPP+组比较,MPP++LY294002组SH-SY5Y细胞中TH蛋白水平增高,α-syn 蛋白水平降低(P<0.05);与LY294002 组比较,MPP++LY294002 组SH-SY5Y 细胞中TH 蛋白水平降低,α-syn蛋白水平增高(P<0.05)。而MPP+组和IGF-1 组SH-SY5Y 细胞中TH 和α-syn 蛋白水平差异无统计学意义(P>0.05),见图3、表3。
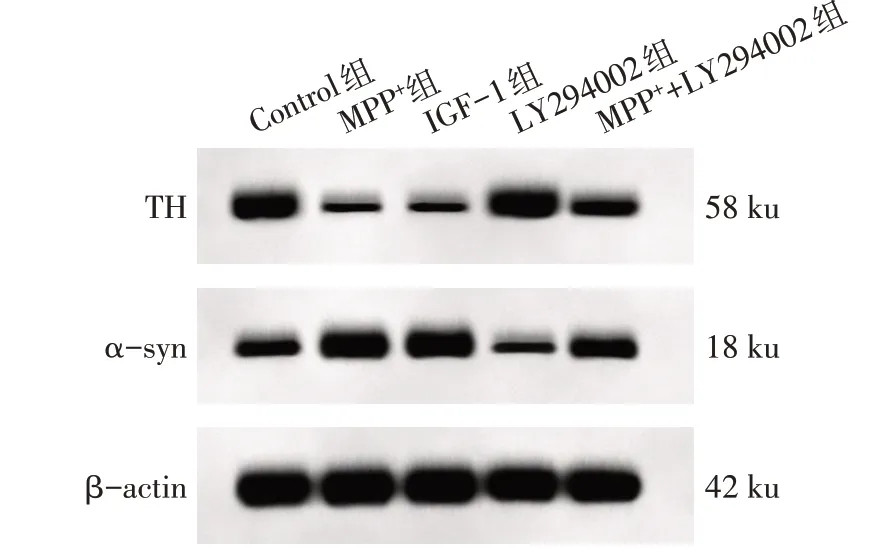
Fig.3 TH and α-syn protein expression in SH-SY5Y cells of each group detected by Western blot assay图3 Western blot检测各组SH-SY5Y细胞中TH和α-syn蛋白表达
Tab.3 Comparison of TH and α-syn protein levels in SH-SY5Y cells of each group表3 各组SH-SY5Y细胞中TH和α-syn蛋白水平比较(n=6,±s)
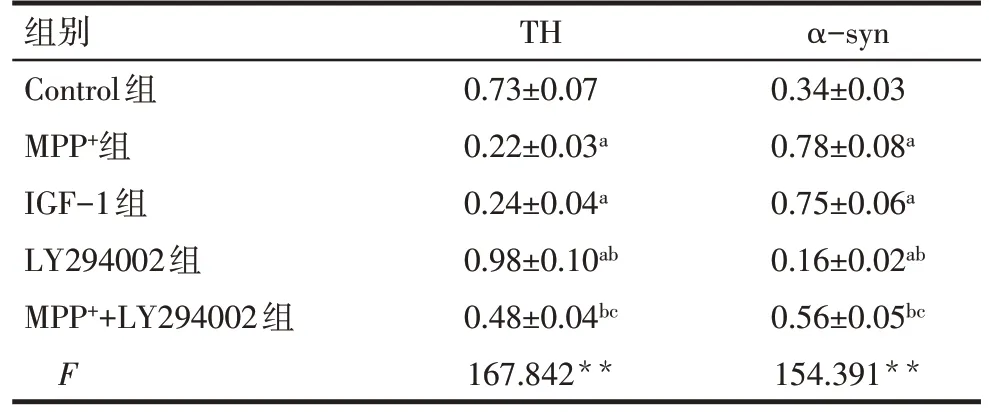
Tab.3 Comparison of TH and α-syn protein levels in SH-SY5Y cells of each group表3 各组SH-SY5Y细胞中TH和α-syn蛋白水平比较(n=6,±s)
组别Control组MPP+组IGF-1组LY294002组MPP++LY294002组F TH 0.73±0.07 0.22±0.03a 0.24±0.04a 0.98±0.10ab 0.48±0.04bc 167.842**α-syn 0.34±0.03 0.78±0.08a 0.75±0.06a 0.16±0.02ab 0.56±0.05bc 154.391**
2.5 抑制PI3K/Akt/mTOR 信号通路对MPP+诱导的SH-SY5Y 细胞中PI3K/Akt/mTOR 信号通路相关蛋白表达的影响 与Control 组比较,MPP+组和IGF-1组细胞中p-PI3K/PI3K、p-Akt/Akt与p-mTOR/mTOR增高(P<0.05);LY294002 组细胞中p-PI3K/PI3K、p-Akt/Akt 与p-mTOR/mTOR 降 低(P<0.05)。与MPP+组比较,MPP++LY294002 组细胞中p-PI3K/PI3K、p-Akt/Akt 与p-mTOR/mTOR 降低(P<0.05);与LY294002 组比较,MPP++LY294002 组细胞中p-PI3K/PI3K、p-Akt/Akt 与p-mTOR/mTOR 增高(P<0.05)。而MPP+组和IGF-1 组细胞中p-PI3K/PI3K、p-Akt/Akt 与p-mTOR/mTOR 差异无统计学意义(P>0.05),见表4、图4。
Tab.4 Analysis of p-PI3K/PI3K,p-Akt/Akt and pmTOR/mTOR ratios in SH-SY5Y cells in each group表4 各组SH-SY5Y细胞中p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR比较 (n=6,±s)
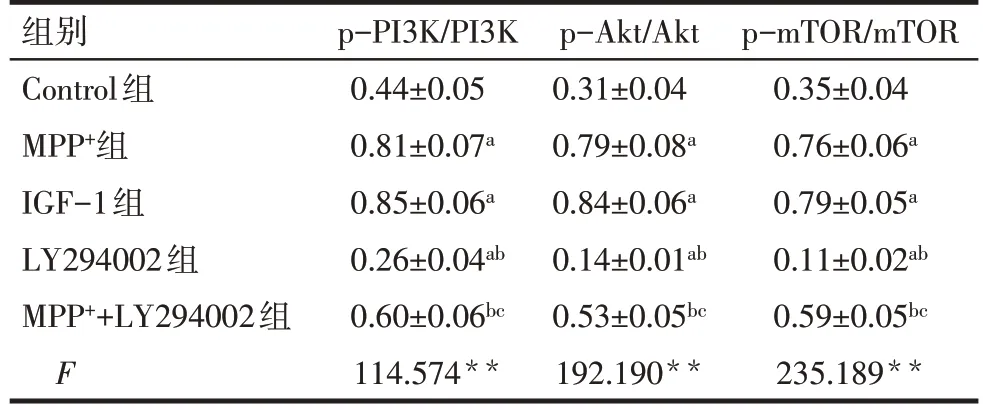
Tab.4 Analysis of p-PI3K/PI3K,p-Akt/Akt and pmTOR/mTOR ratios in SH-SY5Y cells in each group表4 各组SH-SY5Y细胞中p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR比较 (n=6,±s)
组别Control组MPP+组IGF-1组LY294002组MPP++LY294002组F p-PI3K/PI3K 0.44±0.05 0.81±0.07a 0.85±0.06a 0.26±0.04ab 0.60±0.06bc 114.574**p-Akt/Akt 0.31±0.04 0.79±0.08a 0.84±0.06a 0.14±0.01ab 0.53±0.05bc 192.190**p-mTOR/mTOR 0.35±0.04 0.76±0.06a 0.79±0.05a 0.11±0.02ab 0.59±0.05bc 235.189**
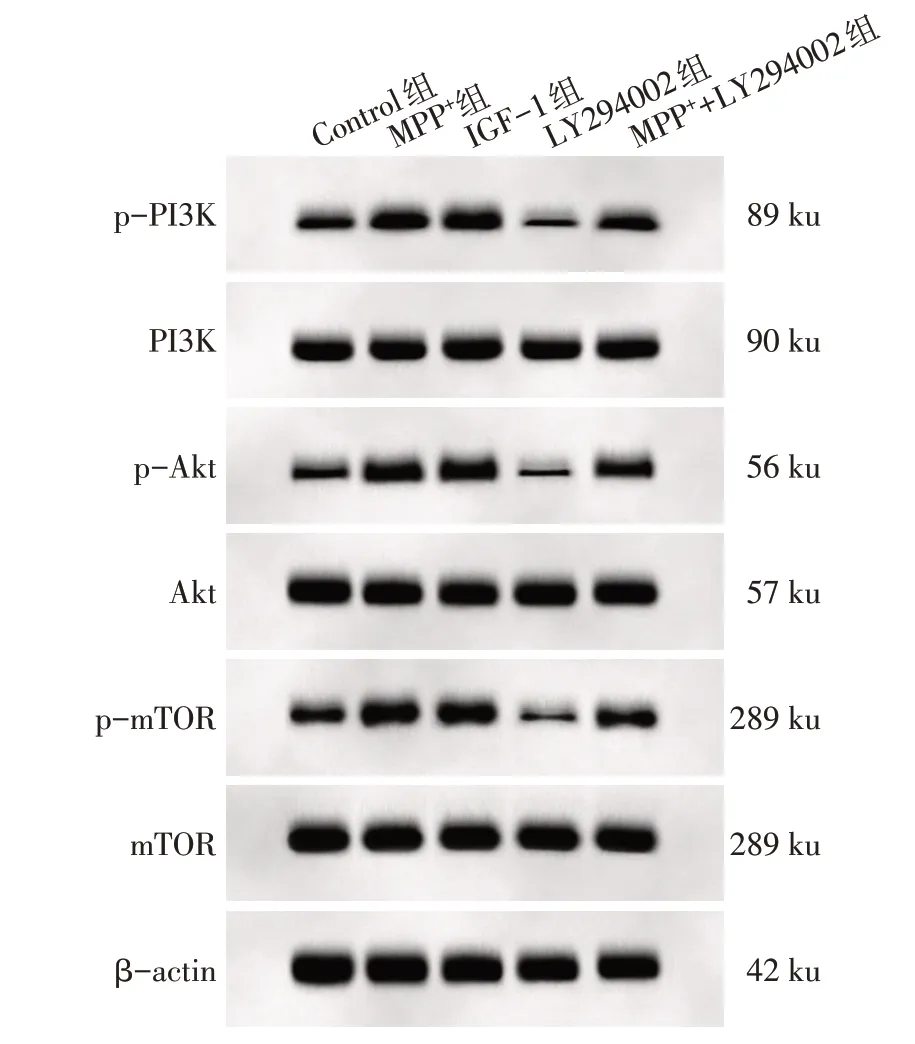
Fig.4 The p-PI3K,PI3K,p-Akt,Akt,p-mTOR and mTOR protein expression in SH-SY5Y cells of each group detected by Western blot assay图4 Western blot检测各组SH-SY5Y细胞中p-PI3K、PI3K、p-Akt、Akt、p-mTOR、mTOR蛋白表达
3 讨论
PD是一种在老年人中常见的疾病,患病率随着人口老龄化而上升[10]。目前,通过药物及深部脑刺激(DBS)手术治疗,可明显减轻PD 症状、改善生活质量,部分患者开期时症状可完全消失,但长期使用药物往往会伴随一系列的不良反应,DBS 手术也存在一些不良反应,而且费用较高[11-12]。PD的运动症状为僵硬、运动迟缓、体位不稳和静息性震颤,这是由黑质致密部多巴胺神经元的渐进性丧失引起的[13]。因此,了解PD 的发病机制对寻找针对PD 的治疗药物具有重要的临床意义。本研究以具有多巴胺神经元特性的人神经母细胞瘤SH-SY5Y 细胞作为研究对象,结果显示,随着MPP+浓度的增加,SHSY5Y 细胞存活率呈剂量依赖性下降,说明MPP+具有神经毒性,能够诱导SH-SY5Y细胞建立PD模型,且最适浓度为0.5 mmol/L。
自噬在PD 的发病机制中起着关键作用[5]。αsyn主要通过自噬降解[14]。PD相关基因的失调可能会破坏自噬,从而促进PD 的发展[6]。有研究表明,A30P 突变体、α-syn 可导致腹侧中脑神经元自噬功能障碍[15]。此外,在鱼藤酮诱导的PD 小鼠模型中,自噬被显著抑制,导致α-syn 的异常积聚[16]。在MPP+处理的SH-SY5Y细胞和MPTP 处理的小鼠中,自噬减少导致多巴胺能神经元的凋亡和退化[17]。本研究结果显示,在MPP+处理的SH-SY5Y 细胞中,细胞存活率降低,凋亡率增高,表明MPP+预处理可诱导SH-SY5Y 细胞凋亡。另外,本研究结果表明MPP+干预后细胞中自噬空泡减少,LC3BⅡ/Ⅰ显著降低,而p62 的表达增加,与上述研究结果一致,说明MPP+预处理可减少SH-SY5Y 细胞自噬。因此,寻找保护细胞免受凋亡损伤,并促进细胞自噬的方法对PD的治疗至关重要。
有研究报道,PI3K/Akt/mTOR 信号通路的失调是PD 患者多巴胺能神经元丢失的原因[18]。mTOR是自噬过程的主要调节因子,PI3K 和Akt 是mTOR上游的2 个重要调节因子。PI3K/Akt/mTOR 信号通路是mTOR 依赖的自噬途径中的重要信号通路,参与清除异常积聚蛋白,在PD等神经退行性疾病中起着重要的自噬调节作用[19]。研究表明,在鱼藤酮诱导的PD 动物模型中,抑制mTOR 可增加α-syn 的降解[16]。同样,锰诱导的SH-SY5Y细胞自噬调节障碍和α-syn 的异常聚集也可通过mTOR 抑制得到改善[20]。在MPTP预处理的PD小鼠模型中,激 活PI3K/Akt/mTOR 信号通路能导致自噬受损,从而触发了炎症小体的形成[21]。艾灸可以抑制mTOR,促进自噬,从而提高鱼藤酮诱导的PD大鼠黑质致密部中多巴胺能神经元的存活率[22]。本研究表明,MPP+可能通过激活PI3K/Akt/mTOR 信号通路抑制自噬,促进凋亡,进而诱导PD 细胞损伤。既往研究显示,AKT/AMPK、Parkin/Ambra1 等信号通路均与自噬相关,且参与调控PD 细胞损伤[23-24],但这些信号通路与PI3K/Akt/mTOR信号通路是协同作用还是冗余关系,还需要进一步验证。本研究发现,抑制PI3K/Akt/mTOR 信号通路可激活自噬,减少凋亡,进而减轻MPP+诱导的SH-SY5Y细胞损伤。
综上所述,抑制PI3K/Akt/mTOR 信号通路可减轻MPP+对SH-SY5Y 细胞的毒性作用,提示PI3K/Akt/mTOR信号通路的抑制剂可用于PD的治疗。今后还需进一步探讨PI3K/Akt/mTOR信号通路干预后对原代多巴胺能神经元和PD活体模型的影响。
