桑黄素通过抑制TXNIP/NLRP3/Caspase-1信号通路对脑缺血再灌注大鼠神经元凋亡的影响
2023-05-08薛丽韩红张力
薛丽,韩红,张力
缺血性卒中属于破坏性脑血管疾病,病死率、致残率较高[1]。目前,缺血性卒中的主要治疗方法是通过溶栓治疗或血管内血栓切除术及时有效地使梗死的血管再通,实现缺血脑组织的血流再灌注[2]。研究显示,血流再灌注过程中往往会造成脑缺血再灌注损伤,导致神经缺陷甚至死亡[3]。硫氧还蛋白互作蛋白(TXNIP)/核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)/胱天蛋白酶1(Caspase-1)信号通路是调节炎症反应的重要轴,已被证实参与了缺血再灌注损伤、糖尿病及慢性炎症相关疾病的进展[4]。桑黄素(Morin)是一种含C15类的黄酮类化合物,含有3 个酚环,具有抗氧化、抗炎、抗高血糖和抗血管生成作用[5]。目前,有关Morin在脑缺血再灌注损伤中的影响研究较少。本研究旨在探讨Morin 调控TXNIP/NLRP3/Caspase-1 信号通路对脑缺血再灌注大鼠神经元凋亡的影响。
1 材料与方法
1.1 材料 雄性SPF 级Sprague-Dawley 大鼠60 只,7~8 周龄,体质量(220±20)g,购自三峡大学实验动物中心,动物生产许可证号:SCXK(鄂)2022-0012。所有大鼠均维持在12 h/12 h 的明暗循环环境下,温度(22±3)℃,湿度(60±5)%,自由进食饮水。所有动物实验均按照美国国立卫生研究院实验动物护理和使用指南进行,并经动物伦理委员会的批准(JZLLSC2022-0122)。Morin 购自上海经科化学科技有限公司;TXNIP 过表达慢病毒(pLVX-TXNIP)及空载慢病毒(pLVX-NC)购自上海吉玛制药技术有限公司;白细胞介素(IL)-1β、IL-18 的酶联免疫吸附试验(ELISA)检测试剂盒购自上海酶联生物科技有限公司;蛋白提取试剂盒购自北京百奥莱博科技有限公司,TXNIP、NLRP3、Caspase-1 一抗购自Abcam公司。化学发光凝胶成像仪购自美国Bio-Rad公司。
1.2 研究方法
1.2.1 脑缺血再灌注大鼠模型的制备及干预 60 只大鼠随机均分为假手术组、模型组、Morin低剂量(Morin-L)组、Morin高 剂 量(Morin-H)组、Morin-H+pLVX-NC 组、Morin-H+pLVX-TXNIP 组。参照文献[6],采用线栓法建立大脑中动脉闭塞再灌注大鼠模型(假手术组除外),在脑缺血1 h 后,Morin-L 组、Morin-H 组分别腹腔注射10 mg/kg、40 mg/kg Morin[7];Morin-H+pLVX-NC 组、Morin-H+pLVX-TXNIP 组在40 mg/kg Morin腹腔注射给药的同时,分别给予尾部注射2.5µL pLVX-NC、pLVX-TXNIP(1×109TU/mL)干预[8];其余各组给予等量生理盐水干预;于给药1 h后(缺血2 h)拆除缝合线实现缺血再灌注。
1.2.2 神经功能缺损评分 各组大鼠(除假手术组外)再灌注72 h 后,由对大鼠分组并不知情的同一实验员对大鼠以Longa评分法[9]评估神经功能缺损情况,评分越高,神经功能缺损越严重。
1.2.3 ELISA检测各组大鼠血清中IL-1β、IL-18水平 各组大鼠尾静脉取2 mL 血,3 000 r/min 离心10 min,按照ELISA试剂盒说明书检测各组大鼠血清中IL-1β、IL-18水平。
1.2.4 脑含水量检测 每组取3只大鼠,颈椎脱臼处死并迅速取出大脑,称量大鼠全脑组织的湿质量;放入110 ℃的烘箱中孵育24 h重新称质量,以获得干质量,脑含水量=(湿质量-干质量)/湿质量×100%。
1.2.5 TTC 染色计算大鼠脑组织梗死面积 每组取3 只大鼠,取出全脑,去除残血后滤纸吸干,将大鼠的脑组织切成2.0 mm 厚的冠状切片并于10 g/L TTC 溶液中37 ℃避光染色10 min,置于含40 g/L多聚甲醛的聚丁二酸丁二醇酯(PBS)溶液中保存24 h。拍照并使用Image J计算梗死面积,其中正常脑组织染成红色,梗死脑组织染成白色。
1.2.6 HE观察大脑皮质半暗带组织病理学特征 剩余每组4只大鼠均取出大脑,分离并切取部分大脑皮质半暗带组织,一部分储存在-80 ℃冰箱,用于Western blot 检测;另一部分固定在多聚甲醛中,经石蜡包埋,切片后用苏木精染色,梯度脱水后,透明,封固,于400倍光学显微镜下观察病理变化。
1.2.7 Western blot 检测蛋白表达 收集1.2.6中部分大脑皮质半暗带组织,使用裂解缓冲液从皮质组织中提取蛋白质,分离蛋白并转移到PVDF膜上,5%脱脂奶粉在4 ℃封闭膜1 h,将膜与TXNIP、NLRP3 及Caspase-1(均1∶1 000)一抗在4 ℃下孵育过夜。TBST 洗涤后,加入二抗((1∶2 000))并在室温下孵育2 h,加入ECL发光底物可检测蛋白质信号,Image J软件分析结果。
1.3 统计学方法 采用SPSS 27.0软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较 假手术组、模型组、Morin-L 组、Morin-H 组、Morin-H+pLVXNC组、Morin-H+pLVX-TXNIP 组神经功能缺损评分分 别 为(0.00±0.00)、(3.15±0.32)、(2.37±0.24)、(1.01±0.11)、(1.03±0.11)、(2.86±0.29),差异有统计学意义(F=344.566,P<0.01),其中Morin-L 组高于Morin-H 组,Morin-H+pLVX-TXNIP 组 高 于Morin-H+pLVX-NC组(P<0.05)。
2.2 各组大鼠血清中IL-1β、IL-18水平比较 与假手术组比较,模型组IL-1β、IL-18 水平增加(P<0.05);与模型组比较,Morin-L 组、Morin-H 组IL-1β、IL-18 水平降低(P<0.05);与Morin-H 组及Morin-H+pLVX-NC 组比较,Morin-H+pLVX-TXNIP组IL-1β、IL-18水平增加(P<0.05),见表1。
2.3 各组皮质半暗带组织病理学变化 假手术组未见水肿、充血现象,细胞排列规则、有序;模型组出现水肿现象,有大量炎性细胞浸润,细胞结构模糊不清。Morin-L 组、Morin-H 组、Morin-H+pLVX-NC 组水肿现象逐渐消失,炎性细胞浸润逐渐减轻;Morin-H+pLVX-TXNIP 组水肿、炎性细胞浸润现象依然存在,见图1。
Tab.1 Comparison of serum levels of IL-1β and IL-18 between the six groups表1 各组血清中IL-1β、IL-18水平的比较(n=10,ng/L,±s)

Tab.1 Comparison of serum levels of IL-1β and IL-18 between the six groups表1 各组血清中IL-1β、IL-18水平的比较(n=10,ng/L,±s)
**P<0.01;a与假手术组比较,b与模型组比较,c与Morin-L 组比较,d与Morin-H 组比较,e与Morin-H+pLVX-NC 组比较,P<0.05;表2、3同。
组别假手术组模型组Morin-L组Morin-H组Morin-H+pLVX-NC组Morin-H+pLVX-TXNIP组F IL-1β 10.27±1.03 29.12±2.92a 22.04±2.21b 15.34±1.54bc 15.27±1.53 24.35±2.44de 115.929**IL-18 75.15±7.52 138.52±13.86a 106.37±10.64b 84.15±8.42bc 84.28±8.43 115.68±11.57de 54.256**
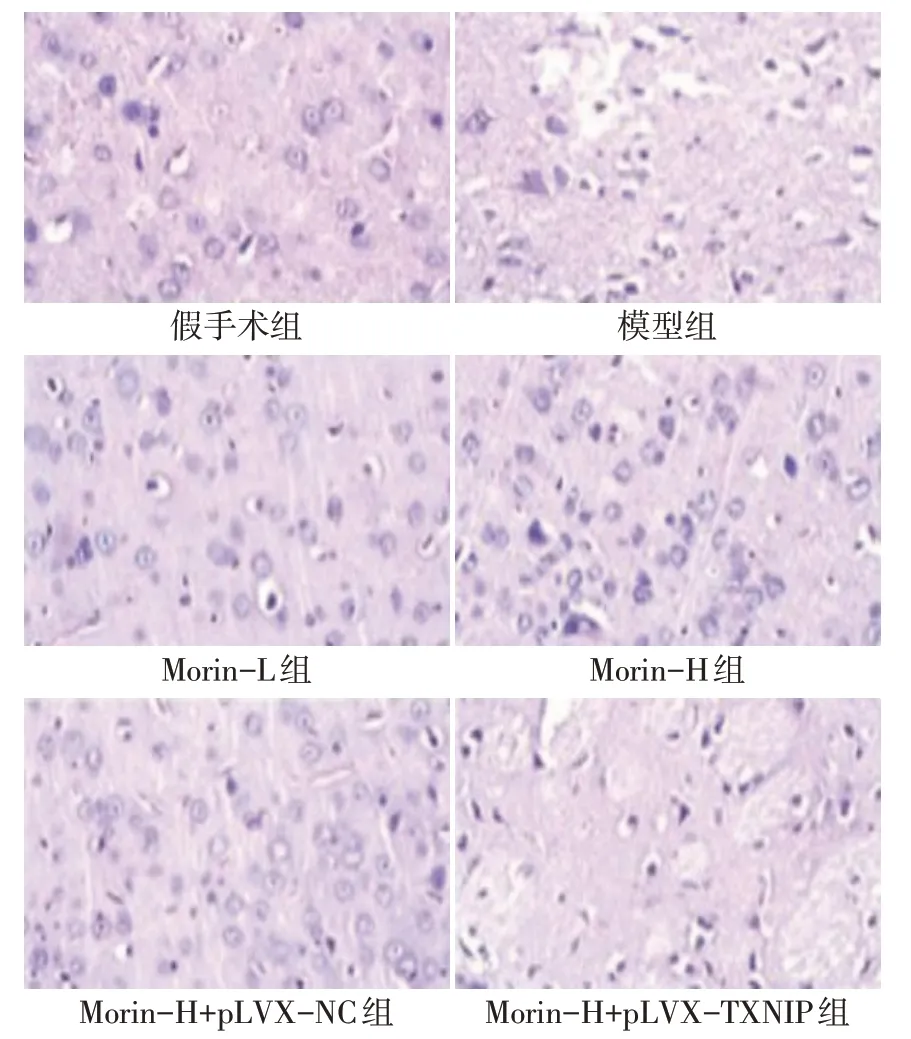
Fig.1 Histopathological changes of cerebral penumbra in each group of rats(HE,×400)图1 各组大鼠大脑皮质半暗带组织病理学变化(HE,×400)
2.4 各组梗死面积及脑含水量比较 与假手术组比较,模型组脑含水量、梗死面积增加(P<0.05);与模型组比较,Morin-L组、Morin-H组脑含水量、梗死面积降低(P<0.05);与Morin-H+pLVX-NC组比较,Morin-H+pLVX-TXNIP 组脑含水量、梗死面积增加(P<0.05),见图2、表2。
2.5 各组TXNIP、NLRP3、Caspase-1 蛋白表达水平比较 与假手术组比较,模型组TXNIP、NLRP3、Caspase-1 蛋白增加(P<0.05);与模型组比较,Morin-L 组、Morin-H 组的TXNIP、NLRP3、Caspase-1蛋白降低(P<0.05);与Morin-H+pLVX-NC组比较,Morin-H+pLVX-TXNIP组TXNIP、NLRP3、Caspase-1蛋白增加(P<0.05),见图3、表3。
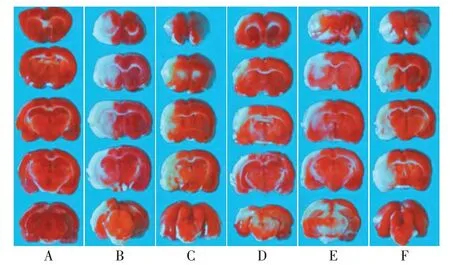
Fig.2 Changes in infarct size of brain tissue(TTC staining,×100)图2 脑组织梗死面积变化(TTC染色,×100)
Tab.2 Comparison of infarct size of brain tissue and brain water content between six groups of rats表2 各组脑组织梗死面积和脑含水量比较(n=3,±s)

Tab.2 Comparison of infarct size of brain tissue and brain water content between six groups of rats表2 各组脑组织梗死面积和脑含水量比较(n=3,±s)
组别假手术组模型组Morin-L组Morin-H组Morin-H+pLVX-NC组Morin-H+pLVX-TXNIP组F梗死面积(%)0.00±0.00 21.05±2.11a 13.21±1.33b 8.51±0.86bc 8.48±0.85 15.64±1.57de 92.531**脑含水量(%)65.12±3.01 85.34±3.55a 75.66±2.76b 67.43±2.34bc 68.32±2.28 82.54±2.88de 26.751**
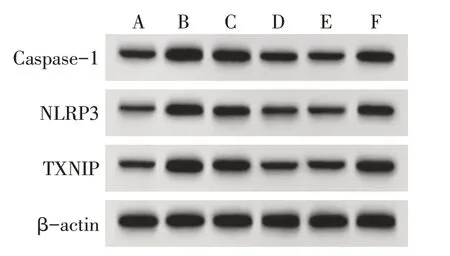
Fig.3 Expression of TXNIP,NLRP3 and Caspase-1 proteins in each group(Western blot assay)图3 各组TXNIP、NLRP3、Caspase-1蛋白表达(Western blot图)
Tab.3 Comparison of TXNIP,NLRP3 and Caspase-1 protein expression between six groups of rats表3 各组TXNIP、NLRP3、Caspase-1蛋白表达水平比较(n=4,±s)

Tab.3 Comparison of TXNIP,NLRP3 and Caspase-1 protein expression between six groups of rats表3 各组TXNIP、NLRP3、Caspase-1蛋白表达水平比较(n=4,±s)
组别假手术组模型组Morin-L组Morin-H组Morin-H+pLVX-NC组Morin-H+pLVX-TXNIP组F TXNIP 0.25±0.03 1.19±0.12a 0.63±0.07b 0.34±0.04bc 0.37±0.04 0.71±0.08de 96.979**NLRP3 0.17±0.02 0.85±0.09a 0.54±0.06b 0.24±0.03bc 0.25±0.03 0.66±0.07de 95.663**Caspase-1 0.34±0.04 1.12±0.12a 0.77±0.08b 0.39±0.04bc 0.37±0.04 0.74±0.08de 72.103**
3 讨论
目前,脑血管疾病尤其是缺血性卒中仍然是导致患者死亡和残疾的主要原因之一,血流再灌注可导致一些缺血性脑组织损伤或功能障碍,导致脑缺血再灌注损伤[10]。虽然缺血性卒中的治疗已经取得了很大进展,但由于其发病机制的复杂性,目前临床对于脑缺血/再灌注损伤依然缺乏有效预防及治疗方法[11]。
Morin是一种黄色多酚,称为3,5,7,2',4'-五羟基黄酮,属于黄酮类化合物,在自然界中广泛存在,具有抗炎、抗氧化等多种作用[12]。Park等[13]研究发现,Morin可减轻脂多糖诱导的小鼠炎症性骨丢失,降低破骨细胞活性及数量。Chen 等[14]研究证实,Morin可以减少局灶性脑缺血性损伤大鼠模型氧化应激、抑制炎症反应,改善神经功能缺损。Khamchai 等[15]研究发现,在中动脉闭塞和再灌注大鼠模型中,Morin 可显著降低氧化应激、炎症反应,保护大脑和血脑屏障损伤。本研究结果显示,模型组较对照组大鼠神经功能缺损评分、脑含水量增加,炎症反应(IL-1β、IL-18 水平)明显上升,大鼠脑组织出现脑梗死,表明脑缺血再灌注后脑组织严重受损;但经不同浓度Morin 治疗后,大鼠神经功能缺损评分、脑含水量、炎症反应以及脑梗死面积均降低,表明Morin尤其是高剂量Morin 抗炎作用显著,Morin 可减轻脑缺血再灌注大鼠脑损伤。
TXNIP/NLRP3/Caspase-1 通路是常见的炎症反应通路,可产生IL-8和IL-1β等炎性细胞因子,从而参与下游炎症反应[16]。Chen等[17]研究发现,在缺氧缺血脑损伤幼鼠中,提高TXNIP 表达可激活NLRP3炎性体并加重脑损伤。Zhou 等[18]研究发现,Morin通过抑制TXNIP/NLRP3/Caspase-1 信号通路活化,从而减轻髓核细胞焦亡并改善椎间盘退变。但Morin 能否通过抑制TXNIP/NLRP3/Caspase-1 信号通路来减轻脑缺血再灌注大鼠脑损伤尚未可知。本研究结果显示,模型组TXNIP、NLRP3、Caspase-1 蛋白表达较假手术组上调,提示脑缺血再灌注引发的脑损伤可能与激活TXNIP/NLRP3/Caspase-1 通路有关。经不同浓度Morin 治疗后,TXNIP、NLRP3、Caspase-1 蛋白表达明显降低,推测Morin 可能通过抑制TXNIP/NLRP3/Caspase-1 通路活化而发挥抗炎作用,进而起到保护神经元的作用。为进一步验证该猜想,实验在Morin-H 干预基础上,以pLVXTXNIP及阴性对照pLVX-NC加以干预,结果发现过表达TXNIP逆转了Morin-H对模型大鼠脑损伤的保护作用,提示Morin 可能通过抑制TXNIP/NLRP3/Caspase-1信号通路活化,从而减轻脑缺血再灌注大鼠脑损伤。
综上所述,Morin 通过抑制TXNIP/NLRP3/Caspase-1 信号通路活化,抑制炎症反应、神经元凋亡,减轻脑缺血再灌注大鼠脑损伤。
