二甲双胍对复发性流产大鼠妊娠结局、内分泌及VEGF/MAPK信号通路的影响
2023-05-08周知黎业娟陈琳王安国阮海玲马宁周璟卢伟英
周知,黎业娟,陈琳,王安国,阮海玲,马宁,周璟,卢伟英
复发性流产(recurrent sponiaeous abortion,RSA)是育龄期女性的常见疾病[1]。正常妊娠女性自然流产发生率约10%,而RSA占5%左右[2]。RSA发病率较高且发病机制复杂,是临床治疗的难点。其与母体内分泌失调、胎盘血管网络异常、生殖道异常、免疫功能异常、染色体异常等有关,RSA患者连续流产后再次妊娠时发生胚胎停止发育及死胎的概率会大大增加[3]。卵巢功能正常、母胎界面血管生成正常、子宫内膜完整性、母体正常的孕激素水平及相关激素受体的正常表达在受精卵的着床、妊娠的维持过程中发挥重要的作用,任一环节出现异常均有可能导致流产[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)直接作用于血管内皮细胞,可调节血管生成,与母胎界面血管的生成关系密切,VEGF 的正常表达对于维持孕期母体子宫及胎盘系统稳定具有重要意义。VEGF 与血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)结合后可激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK),进而增加新生血管的生成,因此VEGF可能参与RSA过程[5-6]。研究发现,在孕早期使用二甲双胍(metformin,Met)可增强血管内皮功能、降低流产率、改善卵巢能量代谢等[7],但关于其对RSA 的治疗效果尚不清晰。本研究通过建立大鼠RSA 模型,观察Met 对RSA 大鼠的辅助治疗作用,以期为临床治疗RSA提供参考。
1 材料与方法
1.1 实验动物 SPF 级雌性SD 大鼠100 只、雄性SD 大鼠50只,4 月龄左右,体质量(230±30)g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2016-0002,动物质量合格证号:省科委2000A027。所购大鼠饲养于海南省妇女儿童医学中心动物房中,适应性饲养1周后用于后续研究。本研究经本院动物伦理委员会批准后进行。
1.2 主要试剂 Met购自广州阿达拉生物科技有限公司;黄体酮购自浙江仙琚制药有限公司;羟基脲、米非司酮购自德国默克公司;卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成激素(leuteinizing hormone,LH)、垂体泌乳素(prolactin,PRL)、雌二醇(estradiol,E2)、孕酮(progesterone,P)放射免疫检测试剂盒均购自北京华英生物技术研究所;VEGF、VEGFR-2兔抗鼠单抗购自Absin公司;细胞外信号调节激酶(ERK)、磷酸化ERK(p-ERK)兔抗鼠单抗、GAPDH 兔抗鼠单抗、羊抗兔IgG 二抗购自英国Abcam 公司;HE 染色试剂盒购自上海生工公司。
1.3 研究方法
1.3.1 RSA 动物模型制备 RSA 大鼠模型通过改进参考文献[8]方法进行制备:选取雌性大鼠100只、雄性大鼠50只合笼交配,于次日早晨在雌性大鼠的阴道涂片中观察到较多精子数量及阴栓者记为受孕第1 天。选取其中受孕成功的60只雌性大鼠按照随机数字表法分为对照组(10 只)及造模组(50 只)。造模组均持续灌胃羟基脲(450 mg/kg)10 d,第11 天灌胃米非司酮(3.75 mg/kg),羟基脲加米非司酮可成功模拟临床流产的状态。模型大鼠出现阴道流血、活动缓慢、精神萎靡、食欲下降等现象,解剖后大鼠子宫有竹节样改变、子宫颜色暗红、着床点有淤血出现等现象时即为模型构建成功,所有大鼠均造模成功。对照组灌胃等量生理盐水,灌胃时间为每天上午7:00—8:00。
1.3.2 动物分组及给药 将造模成功的50只大鼠按照随机数字表法分为RSA组、黄体酮组(156 mg/kg)和Met低、中、高剂量组(250、1 000、2 000 mg/kg),每组10只,Met的给药剂量依据参考文献[9]和前期预实验确定。受孕第1天开始灌胃给药,对照组及RSA 组灌胃等量蒸馏水,灌胃时间为每天上午8:00—9:00,持续15 d。
1.3.3 大鼠胚胎丢失率观察 末次给药结束后24 h,即大鼠受孕第16天,将各组大鼠麻醉后处死,解剖大鼠子宫观察胚胎丢失情况。胚胎丢失率=[流产胚胎数/(存活胚胎数+流产胚胎数)]×100%[8]。
1.3.4 大鼠血清激素水平检测 末次给药结束后24 h,在处死大鼠前取各组大鼠腹主动脉血3 mL,3 500 r/min离心5 min后分离血清,-20 ℃备用,按照说明书,放射免疫法检测各组大鼠血清中FSH、LH、PRL、E2、P水平。
1.3.5 大鼠蜕膜组织病理形态学观察 各组麻醉处死后分离大鼠子宫,用组织钳钝性分离子宫壁,将胚盘与胚胎剥离着床位置,无菌环境下分离大鼠子宫蜕膜组织,使用4%多聚甲醛溶液固定后,按照HE染色试剂盒说明书进行染色,检测子宫蜕膜组织病理变化。
1.3.6 Western blot 法检测子宫蜕膜组织VEGF/MAPK 通路相关蛋白相对表达水平 提取大鼠子宫蜕膜组织中的总蛋白,并测定其浓度,电泳后转移至PDVF 膜上,封闭2 h后,添加VEGF、VEGFR-2、ERK、p-ERK及GAPDH一抗(1∶1 000),4 ℃过夜后TBST洗涤,加二抗(1∶5 000),孵育曝光显色。采用蛋白成像凝胶仪分析VEGF、VEGFR-2、ERK、p-ERK 蛋白的表达水平。
1.4 统计学方法 采用GraphPad Prism 9 软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组胚胎丢失率比较 对照组大鼠胚胎呈淡红色串珠状,存活胚胎数大于死亡胚胎数,且死亡胚胎数极少;RSA组大鼠胚胎多为褐色,胚胎部分或全部消失,子宫内出现血痕,死亡胚胎数明显增加,存活胚胎数减少,两者数量相当;Met各剂量组和黄体酮组与RSA 组相比,褐色胚胎减少,子宫的血痕减轻,死亡胚胎数随着Met剂量的增加而减少,存活胚胎数随着Met剂量的增加而增多,黄体酮组与Met高剂量组的死亡胚胎数、存活胚胎数基本一致,见图1。与对照组比较,RSA组大鼠胚胎丢失率升高(P<0.05);与RSA组比较,黄体酮组胚胎丢失率下降,Met低、中及高剂量组胚胎丢失率依次下降(P<0.05),见表1。

Fig.1 Embryo morphology of rats in each group图1 各组大鼠胚胎形态图
Tab.1 Comparison of embryo loss rate of rats between the six groups表1 各组大鼠胚胎丢失率比较(n=10,±s)
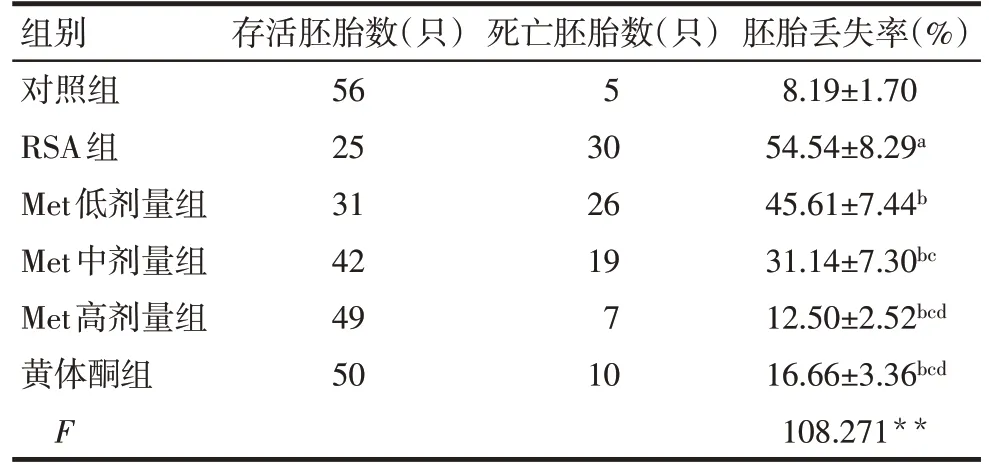
Tab.1 Comparison of embryo loss rate of rats between the six groups表1 各组大鼠胚胎丢失率比较(n=10,±s)
**P<0.01;a与对照组组比较,b与RSA组比较,c与Met低剂量组比较,d与Met中剂量组比较,P<0.05。
组别对照组RSA组Met低剂量组Met中剂量组Met高剂量组黄体酮组F存活胚胎数(只)56 25 31 42 49 50死亡胚胎数(只)5 30 26 19 7 10胚胎丢失率(%)8.19±1.70 54.54±8.29a 45.61±7.44b 31.14±7.30bc 12.50±2.52bcd 16.66±3.36bcd 108.271**
2.2 各组血清激素水平比较 结果见表2。与对照组比较,RSA 组大鼠血清FSH、LH、PRL、E2及P 表达量均降低(P<0.05);与RSA组比较,Met各剂量组和黄体酮组大鼠血清FSH、LH、PRL、E2及P 表达量均升高(P<0.05),Met 高剂量对FSH、LH、PRL、E2及P表达量的作用效果更好,但Met 高剂量组和黄体酮组各指标比较差异无统计学意义(P>0.05)。
2.3 各组子宫蜕膜组织形态学比较 与对照组比较,RSA组大鼠子宫蜕膜组织上皮不完整、细胞排列不规则且出现萎缩变性、淤血情况明显;与RSA组比较,Met 各剂量组大鼠的子宫蜕膜组织形态呈现不同程度的缓解,Met 高剂量组与黄体酮组的子宫蜕膜组织形态相似,见图2。
Tab.2 Comparison of serum hormone levels of rats between the six groups表2 各组大鼠血清中激素水平比较(n=10,±s)

Tab.2 Comparison of serum hormone levels of rats between the six groups表2 各组大鼠血清中激素水平比较(n=10,±s)
**P<0.01;a与对照组组比较,b与RSA组比较,c与Met低剂量组比较,d与Met中剂量组比较,P<0.05。
组别对照组RSA组Met低剂量组Met中剂量组Met高剂量组黄体酮组F PRL(mIU/L)102.61±5.40 70.06±2.08a 78.19±3.01b 86.37±3.71bc 96.37±4.26bcd 95.13±4.31bcd 97.383**E2(ng/L)24.20±0.20 17.11±0.45a 18.71±0.12b 19.94±0.42bc 22.46±0.81bcd 21.97±0.87bcd 223.454**P(µg/L)2.40±0.21 1.14±0.10a 1.57±0.14b 1.90±0.17bc 2.28±0.20bcd 2.19±0.19bcd 78.160**组别对照组RSA组Met低剂量组Met中剂量组Met高剂量组黄体酮组F FSH(IU/L)7.01±0.27 5.07±0.11a 5.71±0.13b 6.20±0.17bc 6.84±0.25bcd 6.72±0.24bcd 135.481**LH(IU/L)6.03±0.75 3.09±0.39a 3.92±0.49b 4.86±0.60bc 5.83±0.72bcd 5.61±0.70bcd 35.556**
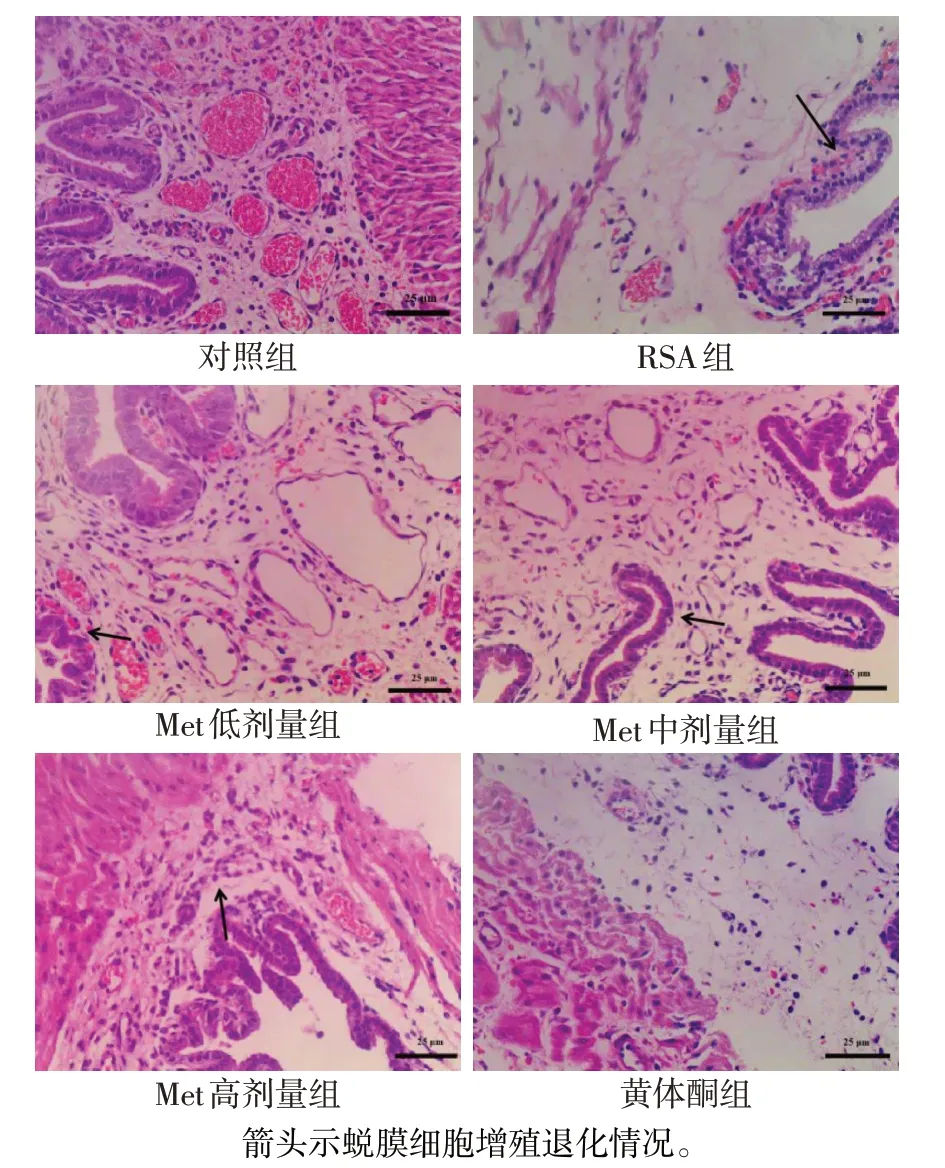
Fig.2 Morphological changes of rat decidua tissue observed by HE staining(×400)图2 HE染色观察各组大鼠子宫蜕膜组织形态学变化(×400)
2.4 各组子宫蜕膜组织VEGF/MAPK通路相关蛋白表达比较 与对照组比较,RSA 组大鼠子宫蜕膜组织中VEGFR-2、VEGF、p-ERK 蛋白表达量均降低(P<0.05);与RSA组比较,Met各剂量组和黄体酮组大鼠子宫蜕膜组织中VEGFR-2、VEGF、p-ERK蛋白表达量均升高(P<0.05),Met 高剂量对VEGFR-2、VEGF、p-ERK 蛋白表达的促进作用更好,但Met 高剂量组和黄体酮组各指标比较差异无统计学意义(P>0.05),见图3、表3。

Fig.3 The expression of VEGF/MAPK pathway related proteins in uterine decidua tissue of rats in each group图3 各组大鼠子宫蜕膜组织VEGF/MAPK通路相关蛋白表达情况
Tab.3 Comparison of the expression of VEGF/MAPK pathway related proteins in uterine decidua of rats between the six groups表3 各组大鼠子宫蜕膜组织VEGF/MAPK通路相关蛋白表达情况比较 (n=10,±s)
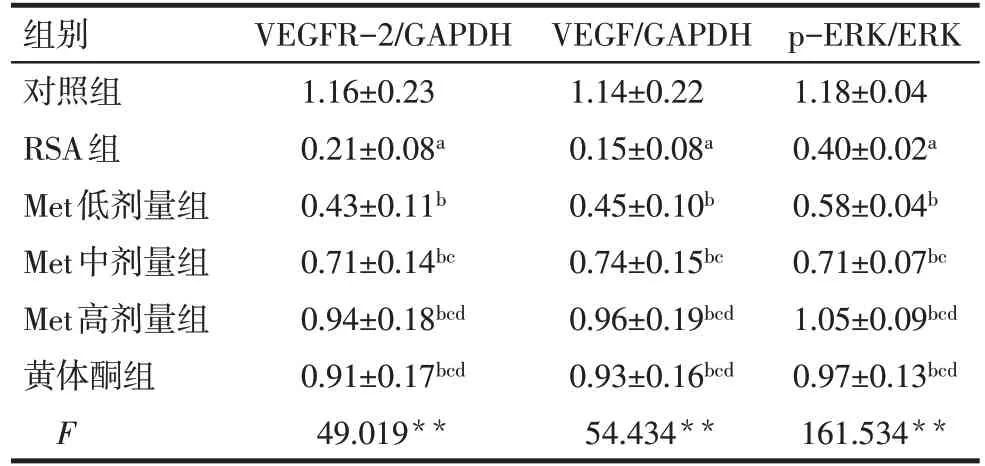
Tab.3 Comparison of the expression of VEGF/MAPK pathway related proteins in uterine decidua of rats between the six groups表3 各组大鼠子宫蜕膜组织VEGF/MAPK通路相关蛋白表达情况比较 (n=10,±s)
**P<0.01;a与对照组比较,b与RSA 组比较,c与Met 低剂量组比较,d与Met中剂量组比较,P<0.05。
组别对照组RSA组Met低剂量组Met中剂量组Met高剂量组黄体酮组F VEGFR-2/GAPDH 1.16±0.23 0.21±0.08a 0.43±0.11b 0.71±0.14bc 0.94±0.18bcd 0.91±0.17bcd 49.019**VEGF/GAPDH 1.14±0.22 0.15±0.08a 0.45±0.10b 0.74±0.15bc 0.96±0.19bcd 0.93±0.16bcd 54.434**p-ERK/ERK 1.18±0.04 0.40±0.02a 0.58±0.04b 0.71±0.07bc 1.05±0.09bcd 0.97±0.13bcd 161.534**
3 讨论
RSA 是育龄女性常见病,随着生育人群数量增多,复发流产、自然流产率呈升高趋势[10]。建立稳定的RSA大鼠模型对于探究流产的机制及相应治疗方法具有重要的现实意义。陈阳等[11]用羟基脲和米非司酮建立流产动物模型,其中RSA 组大鼠流产率升高,血清中P 含量下降,大鼠卵巢功能受损,模型构建较为稳定。本结果亦显示,RSA 组大鼠出现阴道流血、活动缓慢、精神萎靡、食欲下降等现象,胚胎丢失率较对照组升高,提示大鼠RSA 模型构建成功。研究显示,Met可被小肠上皮细胞吸收,通过小肠上皮细胞膜表面的单胺转运体及阳离子转运蛋白转运进入血液、肝脏、胎盘等,可增加多囊卵巢综合征患者的妊娠率,降低流产率等[12-13],故推测其对RSA可能具有一定的治疗价值。本研究结果显示,与RSA组比较,Met各剂量组大鼠胚胎丢失率降低,高剂量组与阳性药物黄体酮效果相当,表明Met 尤其是高剂量具有降低RSA 大鼠胚胎丢失的作用,提示Met可改善RSA 临床症状,但关于其具体作用机制尚不明确。
女性生殖功能的内分泌稳态通过下丘脑-垂体-卵巢轴调节,女性正常的激素水平对于维持妊娠具有重要意义[14]。FSH 是由垂体分泌的一种糖蛋白,具有促进卵巢生长及卵泡颗粒层细胞增殖分化的作用;LH 是一种促性腺激素,促进机体排卵及生成黄体;PRL水平过高或过低均会影响卵泡的成熟;E2是由卵巢分泌的一种性激素,血清E2的水平能反映胎儿的生长状况及胎盘的状态,低水平的E2不利于胎儿的正常生长发育,可能预示着不良妊娠结局;P 是由卵巢黄体分泌的一种孕激素,对于维持妊娠具有重要作用[15-16]。本研究结果显示,与RSA 组比较,Met 各剂量组大鼠血清FSH、LH、PRL、E2及P 表达量均升高,高剂量Met与黄体酮调节RS大鼠内分泌作用效果差异无统计学意义,提示Met 尤其高剂量组具有调节RSA 大鼠内分泌的作用,考虑Met 缓解RSA大鼠胚胎丢失情况可能与改善大鼠内分泌功能有关。
妊娠过程中丰富的营养及血液供应是维持胚胎正常发育的关键因素,子宫蜕膜组织健康的血管网络及血液循环发挥着重要作用。VEGF 具有改善血管通透性、促进血管内皮细胞有丝分裂、诱导血管形成等作用,通过与其受体VEGFR-2 结合发挥作用,对母胎界面的血管网络及血管生成起到积极作用,低表达的VEGF 可导致绒毛血管网络生成不足、血管内皮细胞分裂异常等,进而引发流产[17]。ERK 是MAPK的家族成员,是MAPK主要的信号传导途径,VEGF 与其受体VEGFR-2 结合后可促进ERK 的激活,ERK激活后可将信息转导入细胞核,对细胞的分化及胚胎的发育具有一定的调控作用,能促进血管内皮细胞的增殖,对母胎界面的血管生成具有促进作用[18-19]。研究发现,小鼠胚胎丢失率高、蜕膜组织血管新生均与VEGF/MAPK 通路相关蛋白表达异常有关[20-21]。本研究结果显示,与RSA 组比较,Met 各剂量组大鼠子宫蜕膜组织血管损伤得到一定的缓解,子宫蜕膜组织中VEGFR-2、VEGF、p-ERK 蛋白表达量均升高,且高剂量Met 的效果更佳,表明Met对RSA大鼠的子宫蜕膜组织血管具有一定的保护作用,可提高VEGF/MAPK通路相关蛋白的表达。
综上所述,Met 具有降低RSA 大鼠的胚胎丢失率、调节内分泌等作用,可能与Met 具有促进VEGF/MAPK 通路激活作用有关。然而,本研究只是初步探究Met 对RSA 大鼠内分泌及VEGF/MAPK 通路的影响,未进行相关通路抑制剂及激活剂的验证实验,后续仍需深入研究。
