罗氟司特对大鼠创伤性脑损伤的作用及其机制研究
2023-05-08石昆林李晨希宗建春
石昆林,李晨希,宗建春
创伤性脑损伤(traumatic brain injury,TBI)是40岁以下人群致死、致残的常见原因。截至2017 年底,我国TBI 患者的绝对人数已超过了世界上大多数国家,造成了巨大的社会负担[1]。有研究表明,创伤后炎症反应在TBI 的病理过程中有着重要的作用[2]。罗氟司特(Roflumilast,RF)是一种选择性磷酸二酯酶4 抑制剂,可提高环磷酸腺苷(cAMP)水平。Keskin 等[3]在脑缺血再灌注损伤的研究中发现,RF具有抑制炎症反应,减轻脑细胞损伤的作用,且可能与NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)有关,但其能否减轻TBI仍未可知。本研究建立TBI 大鼠模型后,腹腔注射RF 溶液,通过观察TBI 后伤侧大脑皮层内白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α、NLRP3、神经元病理特点和大鼠神经功能缺损评分的变化,探究RF 对大鼠TBI的影响及其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级健康雄性Sprague-Dawley 大鼠36只,8周龄,体质量220~250 g,购自重庆医科大学动物实验中心,动物生产许可证号:SCXK(渝)2022-0010。动物饲养于重庆医科大学动物实验中心动物房。实验大鼠的模型操作及取材过程取得重庆医科大学附属第二医院实验动物伦理委员会许可。
1.1.2 主要试剂与仪器 RF粉剂购自上海阿拉丁生化科技股份有限公司;IL-6、IL-1β 和TNF-α 酶联免疫吸附试验(ELISA)检测试剂盒均购自厦门仑昌硕生物科技有限公司;苏木素-伊红(HE)高清恒染试剂盒、兔源抗NLRP3 一抗、山羊抗兔二抗(IgG)均购自武汉赛维尔生物科技有限公司;酶标仪购自美国Bio-Rad公司;低温离心机购自德国Eppendorf公司;显微镜购自日本NIKON公司。
1.2 方法
1.2.1 TBI模型的建立及分组 36只大鼠按随机数字表法分为3 组:假手术(Sham)组、TBI 组、TBI+RF 组,每组12 只。Sham 组大鼠无撞击过程,其余过程与其他2 组相同。TBI+RF组和TBI组大鼠均采用改良Feeney自由落体法[4]建立TBI模型。具体步骤:(1)用10%水合氯醛(300 mg/kg)腹腔注射将大鼠麻醉,并固定于立体定位架,去除耳后与双眼之间的毛发,保证术区视野清洁。(2)做顶部正中线右侧切口,逐层分离组织,充分暴露颅骨,在矢状缝右侧和冠状缝后方约3 mm 处钻直径约5 mm骨窗,确保硬脑膜完整。(3)将骨窗与自由落体打击装置连接妥当,10 g 重锤从20 cm 高处沿管道自由下落冲击撞杆,造成大脑顶叶挫裂伤。(4)止血、消毒后缝合头皮。
1.2.2 干预方法及样本采集 TBI+RF 组大鼠建模后即刻、1 d、2 d 腹腔注射RF(1 mg/kg)溶液,TBI 组和Sham 组注射等量溶剂(5%DMSO 和95%生理盐水溶液)。建模后3 d 时,按随机数字表法抽取各组大鼠:4 只大鼠用生理盐水和4%多聚甲醛进行心脏灌注,取出全脑,置于4%多聚甲醛中固定24 h,石蜡包埋,制成厚度为4µm的切片,用于HE染色和NLRP3免疫组化染色;4只大鼠处死后,立即取出全脑,置于液氮中速冻,再转移至-80 ℃冰箱中保存,用于ELISA检测。
1.2.3 大鼠神经功能缺损评分 在建模后1、2、3、7 和14 d时,采用改良神经功能缺损严重程度评分(modified neurological severity score,mNSS)量表评估大鼠神经功能[5]。该量表包括运动(肌肉状态和异常运动)、感觉(视觉、触觉和本体感受)、反射反应和平衡测试。若小鼠无法进行测试或缺乏预期的反应,则获得1分。1~6分为轻度功能缺损,7~12分为中度功能缺损,13~18分为重度功能缺损。
1.2.4 HE染色观察病灶周围皮层大鼠神经元病理变化 取1.2.2 制作的石蜡切片,烤片、脱蜡、水化后,进行标准HE 染色,中性树脂封固,在光学显微镜下观察并拍照。每只大鼠选择3张切片,每张切片在病灶周围读取5个不同视野,由对实验分组不知情的研究人员使用Image J 分析死亡神经元数量,结果以死亡神经元的百分比表示[6]。
1.2.5 ELISA 检测IL-1β、IL-6 和TNF-α 的含量 处死大鼠后立即取出脑组织,在冰面上分离伤侧顶叶皮层组织,制成组织匀浆,离心(5 000 r/min,10 min,4 ℃)后取上清液,参照ELISA试剂盒说明书进行操作。
1.2.6 NLRP3 免疫组化染色分析 取1.2.2 制作的石蜡切片经烤片、脱蜡、水化后,PBS洗涤3次,每次5 min;用柠檬酸抗原修复缓冲液进行抗原修复,PBS 洗涤3 次,每次5 min。滴加3%双氧水溶液室温避光孵育25 min,阻断内源性过氧化物酶,PBS洗涤3次,每次5 min。滴加3%牛血清白蛋白室温孵育30 min,进行血清封闭。切片滴加NLRP3 一抗(稀释度1∶200)置于湿盒内4 ℃孵育过夜。次日PBS 洗涤3 次,每次5 min。滴加辣根过氧化物酶标记的IgG二抗(稀释度1∶200)室温下孵育50 min。滴加二氨基联苯胺显色液显色,PBS 洗涤3 次,每次5 min,用苏木素复染约3 min 后封片,置于显微镜下观察、拍照。每只大鼠选择3张切片,每张切片在病灶周围读取5个不同视野,由对实验分组不知情的研究人员使用Image J 软件分析NLRP3 含量,结果以平均光密度(AOD)值表示。
1.3 统计学方法 采用SPSS 26.0软件进行数据分析。正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
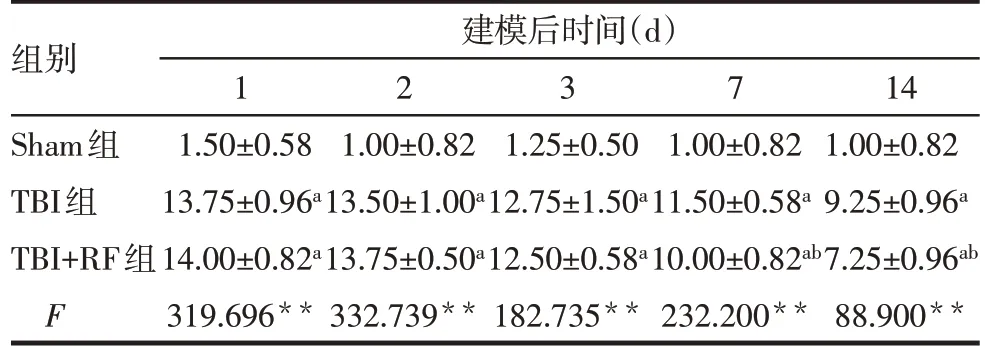
2.1 各组大鼠mNSS比较 各组大鼠在建模后1、2、3、7、14 d 的mNSS 比较差异有统计学意义(均P<0.05)。与Sham 组比较,TBI 组与TBI+RF 组大鼠各时间点mNSS 均升高(均P<0.05);建模后1、2、3 d内,TBI 组与TBI+RF 组大鼠mNSS 差异无统计学意义,建模后7、14 d时,TBI+RF组大鼠mNSS较TBI组降低(均P<0.05),见表1。
Tab.1 Comparison of mNSS at different time points after modeling between the three groups表1 各组大鼠建模后不同时间点mNSS比较(n=4,分,±s)
Tab.1 Comparison of mNSS at different time points after modeling between the three groups表1 各组大鼠建模后不同时间点mNSS比较(n=4,分,±s)
**P<0.01;a与Sham组比较,b与TBI组比较,P<0.05。
组别Sham组TBI组TBI+RF组F建模后时间(d)1 1.50±0.58 13.75±0.96a 14.00±0.82a 319.696**2 1.00±0.82 13.50±1.00a 13.75±0.50a 332.739**3 1.25±0.50 12.75±1.50a 12.50±0.58a 182.735**7 1.00±0.82 11.50±0.58a 10.00±0.82ab 232.200**14 1.00±0.82 9.25±0.96a 7.25±0.96ab 88.900**
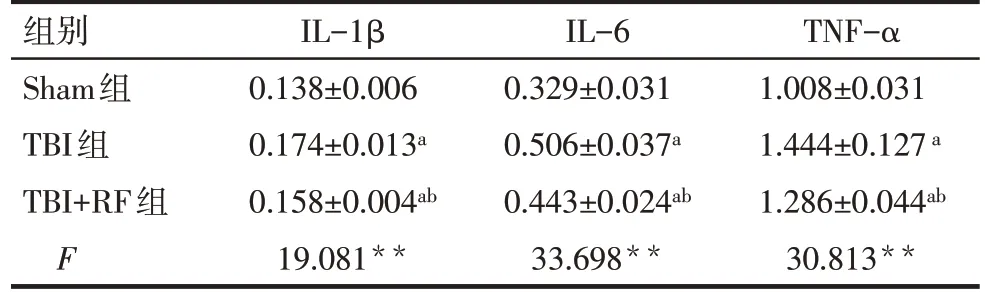
2.2 各组大鼠损伤侧皮层中IL-1β、IL-6、TNF-α含量比较 ELISA结果显示,与Sham组比较,TBI组和TBI+RF组大鼠损伤侧皮层中IL-1β、IL-6、TNF-α含量升高(P<0.05);与TBI 组比较,TBI+RF 组大鼠损伤侧皮层中IL-1β、IL-6、TNF-α 含量降低(P<0.05),见表2。
Tab.2 Comparison of contents of IL-1β,IL-6 and TNF-α in the injured cortex of rats between the three groups表2 各组大鼠损伤侧皮层IL-1β、IL-6、TNF-α含量比较(n=4,ng/g,±s)
Tab.2 Comparison of contents of IL-1β,IL-6 and TNF-α in the injured cortex of rats between the three groups表2 各组大鼠损伤侧皮层IL-1β、IL-6、TNF-α含量比较(n=4,ng/g,±s)
**P<0.01;a与Sham组比较,b与TBI组比较,P<0.05。
组别Sham组TBI组TBI+RF组F IL-1β 0.138±0.006 0.174±0.013a 0.158±0.004ab 19.081**IL-6 0.329±0.031 0.506±0.037a 0.443±0.024ab 33.698**TNF-α 1.008±0.031 1.444±0.127a 1.286±0.044ab 30.813**
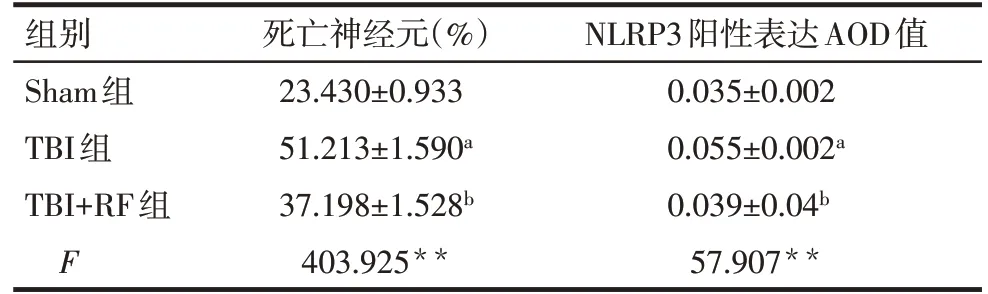
2.3 各组大鼠病灶周围皮层神经元病理变化及死亡神经元数量比较 Sham组神经元排列规则,大多形态正常,细胞核大而圆,呈空泡状,核仁明显,周围脑组织细胞间质无明显水肿。TBI 组和TBI+RF 组病灶周围脑组织结构疏松,细胞间质水肿明显,见较多死亡神经元,胞体缩小、变形,细胞核固缩、裂解,胞浆呈淡红色,见图1。与Sham组比较,TBI组大鼠病灶周围皮层中死亡神经元比例升高(P<0.05);与TBI 组比较,TBI+RF 组大鼠病灶周围皮层中死亡神经元百分比降低(P<0.05),见表3。
2.4 各组大鼠病灶周围NLRP3含量比较 3组大鼠脑组织病灶周围均可见不同数量的NLRP3 阳性细胞,见图2。与Sham 组比较,TBI 组大鼠病灶周围NLRP3 含量升高(P<0.05);与TBI 组比较,TBI+RF组大鼠病灶周围NLRP3 含 量 降 低(P<0.05),见表3。
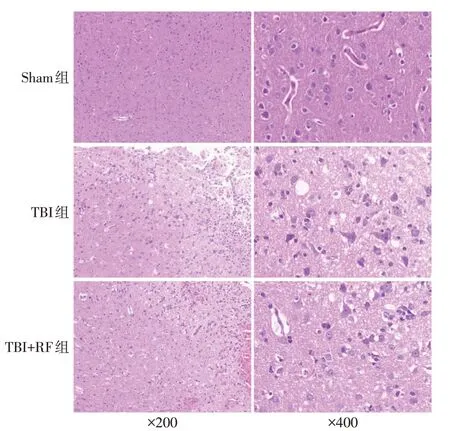
Fig.1 Comparison of pathological changes of neurons in perifocal cortex of rats between the three groups(HE staining)图1 各组大鼠病灶周围神经元病理变化比较(HE染色)
Tab.3 Comparison of the number of dead neurons and NLRP3 content in the perifocal cortex of rats between the three groups表3 各组大鼠病灶周围皮层中死亡神经元数量和NLRP3含量的比较 (n=4,±s)
Tab.3 Comparison of the number of dead neurons and NLRP3 content in the perifocal cortex of rats between the three groups表3 各组大鼠病灶周围皮层中死亡神经元数量和NLRP3含量的比较 (n=4,±s)
**P<0.01;a与Sham组比较,b与TBI组比较,P<0.05。
组别Sham组TBI组TBI+RF组F死亡神经元(%)23.430±0.933 51.213±1.590a 37.198±1.528b 403.925**NLRP3阳性表达AOD值0.035±0.002 0.055±0.002a 0.039±0.04b 57.907**
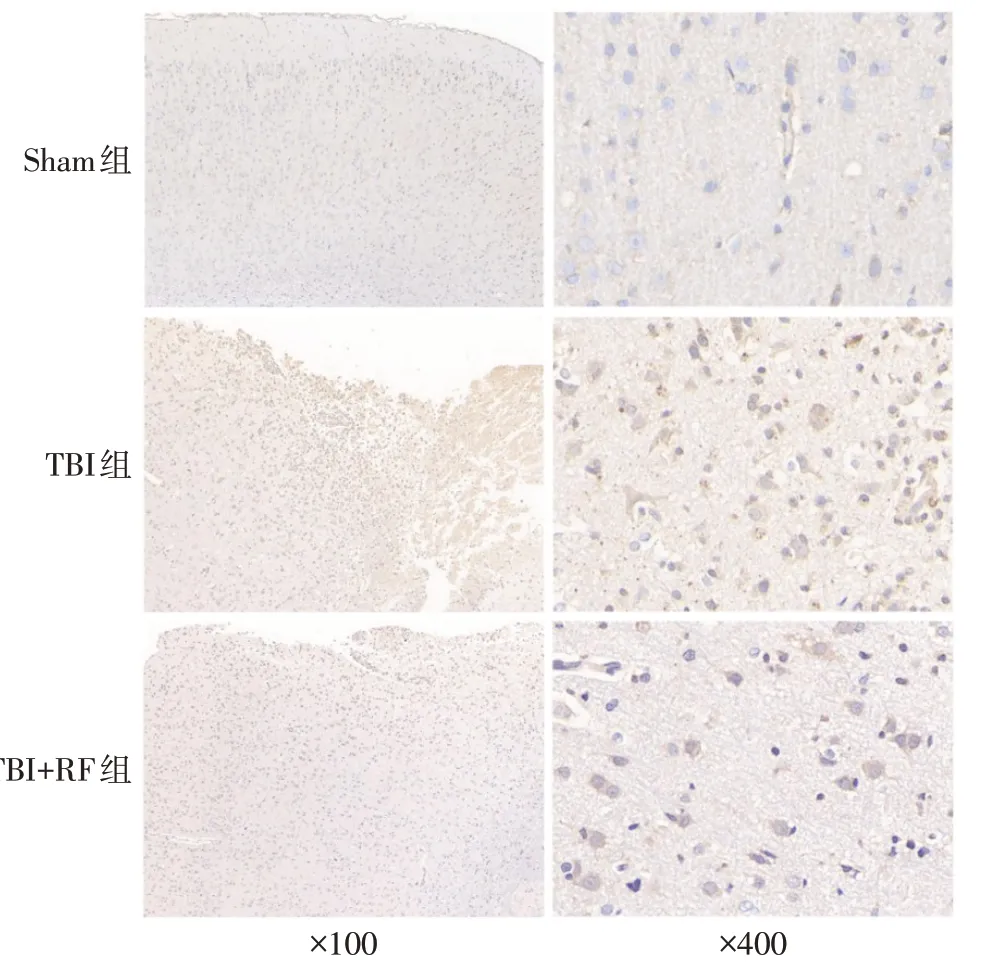
Fig.2 Comparison of NLRP3 content around lesion between the three groups(Immunohistochemical staining)图2 各组大鼠病灶周围NLRP3含量比较(免疫组化染色)
3 讨论
TBI 是在外力作用下对大脑造成的一种获得性损害。目前仍缺乏针对TBI 的有效药物疗法,临床多以对症治疗和长期康复训练为主,以此来促进伤后神经功能的恢复[7-8]。RF 吸收入血后,在体内迅速代谢为RF氮氧化物,可以很容易地穿过血脑屏障渗透到大脑[9],间接提高脑组织内cAMP 含量,已被证明对海马神经元损伤和脑缺血模型动物具有神经保护作用[3,10-11]。另外,Blokland 等[12]发现RF 可以改善健康老年人的言语记忆成绩。本研究探讨了RF 对大鼠TBI 的影响,发现经RF 治疗后7 d、14 d mNSS 低于TBI 组;同时,其病灶周围大脑皮层细胞间质水肿减轻,死亡神经元减少,提示RF 治疗可以减轻大鼠TBI,具有神经保护作用,但其作用机制仍未完全明确。
神经炎症贯穿于TBI 急性和慢性阶段,可修复受损的组织,但过度产生的促炎症介质却成为TBI病理进展的重要推动力。TBI 后早期神经炎症包括神经胶质细胞(小胶质细胞和星形胶质细胞)激活和脑内大量炎症介质释放,如NLRP3、TNF-α、IL-6、IL-1β等[13]。NLRP3是第一个在大脑中被研究的炎症小体,主要位于小胶质细胞中,其激活可以诱导趋化因子和IL-1β、IL-18、胱天蛋白酶-1 等炎症介质的释放[14],是TBI 后神经炎症和神经行为障碍的主要驱动因素之一。有研究表明,通过抑制NLRP3可以减轻脑水肿,缩小病灶体积,改善长期运动和认知功能,从而改变TBI模型小鼠预后[15]。Wang等[16]也发现抑制IL-1β、IL-6、TNF-α 等炎性因子可以缓解TBI后神经炎症损伤。在本研究中,与Sham组比较,TBI 组大鼠病灶周围皮层中IL-1β、IL-6、TNF-α 和NLRP3 含量均升高,表明TBI 后早期神经炎症已激活,而经RF治疗后,上述炎症介质含量均明显降低,提示RF对大鼠TBI的神经保护作用可能与抑制IL-1β、IL-6、TNF-α和NLRP3等促炎介质相关。
cAMP 是TBI 的一个关键因素,在神经元、小胶质细胞和星形胶质细胞内发挥信号级联作用。有研究发现,在大鼠TBI 早期,脑组织内cAMP 含量即出现明显下降[17],这种下降持续到伤后14 d 仍可被检测到[18],而提高cAMP含量可以提高TBI模型小鼠的学习记忆成绩[19]。另一项研究发现,抑制磷酸二酯酶10A 可以缩短大鼠在TBI 后寻找平台的时间,减轻TBI所致的神经元损伤,具有神经保护作用,这与cAMP/蛋白激酶A(PKA)信号通路的激活密切相关[20]。cAMP/PKA 信 号 通 路 被 激 活 后,可 导 致NLRP3 表达下调,而应用PKA 抑制剂,则可逆转这种现象。此外,cAMP/PKA 信号通路激活也下调了TBI 后脑组织内TNF-α、IL-6、IL-1β 等促炎因子水平。本研究应用RF间接提高TBI后脑组织内cAMP含量,结果发现NLRP3、TNF-α、IL-6、IL-1β 含量降低,与上述研究结果一致,提示RF 抑制TBI 后早期神经炎症可能与激活cAMP/PKA 信号通路有一定关系。
综上所述,RF 通过降低TBI 早期炎症介质水平,减轻大鼠创伤性脑损伤,起到神经保护作用,与激活cAMP/PKA信号通路有一定关系。但本研究中未检测cAMP 和PKA 相关蛋白含量,未来仍需更多的研究探讨RF 调控cAMP/PKA 信号通路的作用机制。
