IL4I1影响肝细胞癌发生发展的研究
2023-05-08张海溢王宸怡马雯慧刘雨倩宋天悦陈凤鸿
张海溢,王宸怡,马雯慧,刘雨倩,宋天悦,陈凤鸿
(徐州医科大学麻醉学院,江苏 徐州 221004)
现阶段,肝癌已经成为人们较为常见的死亡原因之一。全球范围内,肝癌的恶性程度在所有恶性肿瘤中居于前列,其致死率在所有恶性肿瘤中居第四位[1]。肝癌的危险因素包括乙型肝炎病毒感染、丙型肝炎病毒感染、脂肪肝、酒精性肝硬化、吸烟、肥胖、糖尿病、铁负荷过多及各种不良饮食习惯等[2]。肝癌患者的预后很差,只有5% ~15% 的早期肝癌患者能通过手术将病灶切除。肝癌的早期诊断比较困难,导致多数患者病情进展至晚期才得以确诊,治疗效果不如人意[3]。肝细胞癌是原发性肝癌的一种。临床上治疗肝细胞癌的方法多为根治性手术(如肝移植术、肝切除术)或姑息治疗(如分子靶向治疗、免疫治疗),但原发性肝细胞癌(hepatocellular carcinoma,HCC)发生转移和复发的概率极高,并最终导致患者预后不良[4-5]。目前,运用医学生物信息学可以分析基因层面肝细胞癌的发生发展机制,并为其治疗提供重要的理论参考依据。因此,研究各种基因参与肝细胞癌发生发展的机制,进而找到合适的免疫靶向治疗药物,对肝细胞癌的治疗及改善患者的预后具有重要的意义。白细胞介素4 诱导蛋白1(interleukin-4 induced 1 protein,IL4I1)是一种L 型- 苯丙氨酸氧化酶,位于人类基因19q13.3 ~19q13.4 染色体上,因由白细胞介素4分泌诱导产生而得名[6]。IL4I1 主要由B 细胞、T 细胞、成熟树突状细胞以及巨噬细胞产生[7-9]。IL4I1 的五种亚型由人类基因编码,1 型在淋巴组织,2 型在中枢神经系统和人类精子中,3、4、5 型未知[6]。IL4I1 主要负责抑制T 细胞的增殖、幼稚B 细胞的分化以及促进巨噬细胞向2 型转化[9]。相关文献报道,IL4I1 通过调节免疫细胞的功能从而促进肿瘤细胞免疫逃逸,导致淋巴瘤[10]、宫颈癌[11]、慢性淋巴细胞白血病[8]、乳腺癌[12]的发生与发展。目前,尚没有关于IL4I1 在肝细胞癌中作用的文献报道。本研究通过从TCGA 公共数据库中下载有关肝细胞癌的相关数据,利用医学生物信息学分析IL4I1 在肝细胞癌中的作用机制,并探讨其能否成为肝细胞癌新的诊断与免疫治疗靶点。
1 数据分析与方法
1.1 数据来源
从TCGA(https://portal.gdc.cancer.gov/)数 据库中下载肝癌转录组(the fragments per kilobase of transcript per million mapped reads,FPKM),提取与肝细胞癌有关的基因表达量,分析424 个样本(N=50,T=374)中IL4I1 的表达在正常组织与肝细胞癌组织中有无明显差异,绘制差异分析图;接着筛选出其中的配对样本,分析肝癌组织与癌旁组织中的IL4I1 基因表达是否有明显差异。
1.2 IL4I1 与临床病理特征的分析
使用Perl 软件合并IL4I1 基因的表达数据与临床数据,利用R 软件(4.2.1 版本)分析IL4I1 在正常组织和肝细胞癌组织中的差异表达量以及与临床病理特征的相关性。采用单因素和多因素Cox 回归分析IL4I1在正常组织和肝细胞癌组织中的差异表达量以及临床病理特征对肝癌患者生存预后的影响。
1.3 GSEA
将肝细胞癌患者分为高低表达两组,使用GSEA 富集软件对富集结果进行分析注释,对每个分析进行1000 次基因集排列,将P<0.05 和错误发现率(discovery rates,FDR)<0.25 定义为显著富集。
1.4 统计学方法
运用R 软件(4.0.2 版本)进行统计分析,使用Wilcoxon 秩和检验分析IL4I1 差异表达以及临床因素与患者预后的关系,计量资料采用中位数(用四分位数间距)表示。临床病理特征分析、Cox 回归分析和GSEA 以P<0.05 为差异有统计学意义。
2 结果
2.1 IL4I1 在肝细胞癌中的差异表达情况
本研究共选取TCGA 数据库中肝细胞癌样本424个,其中包括50 个肝细胞癌组织和374 个癌旁组织,进行IL4I1 基因表达检测。从统计结果(见图1)可以看到:在肝细胞癌组织中IL4I1 的表达水平﹝ 0.69(0.31,1.75)﹞明显比正常肝组织﹝0.22(0.15,0.51)﹞高,两者比较差异具有统计学意义(P<0.01)。
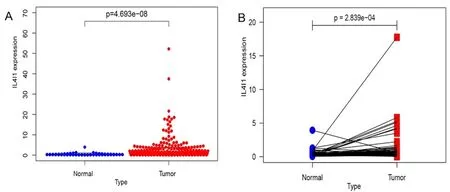
图1 肝细胞癌组织与正常组织中IL4I1 的表达差异
2.2 单因素及多因素分析肝细胞癌组织中IL4I1表达量及临床病理特征对患者预后的影响
单因素Cox 分析IL4I1 的基因表达与肝细胞癌患者预后相关性之间的关系(见表1),自变量为Parameter 对应的内容,因变量为风险比(hazard ratio,HR),关系为Parameter 每增加一个单位,相应地HR 会增加一定的数值。结果显示:肿瘤分期﹝ HR=1.86,95% 可 信 区 间(confidence interval,CI):1.46 ~2.39,P<0.01 ﹞、T 分 期(HR=1.80,95%CI:1.43 ~2.27,P<0.01)、M 分期(HR=3.85,95%CI:1.21 ~12.28,P<0.05)与肝细胞癌患者的预后相关。多因素Cox 回归分析显示(见表2),IL4I1 表达水平的高低不能作为影响肝细胞癌患者预后的独立危险因素(HR=1.00,95%CI:0.96 ~1.04,P>0.05)。
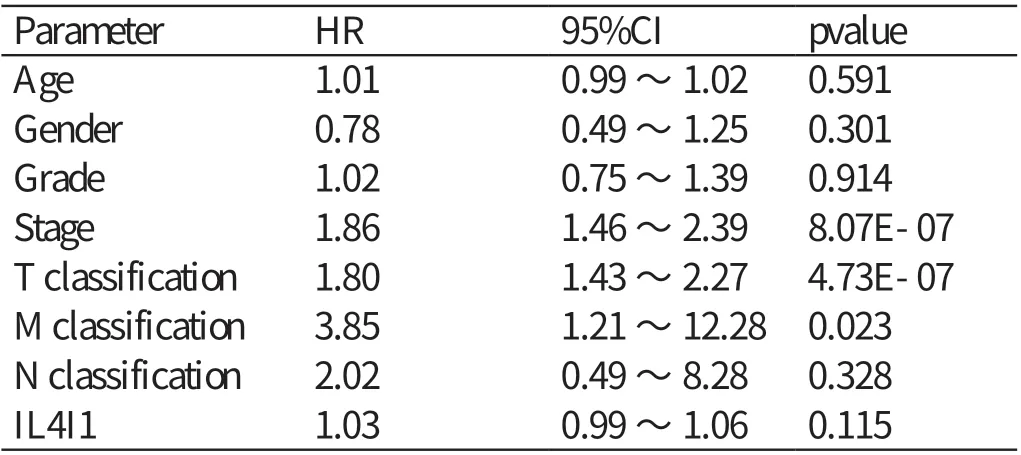
表1 单因素分析肝细胞癌组织中IL4I1 表达量及临床病理特征对患者预后的影响
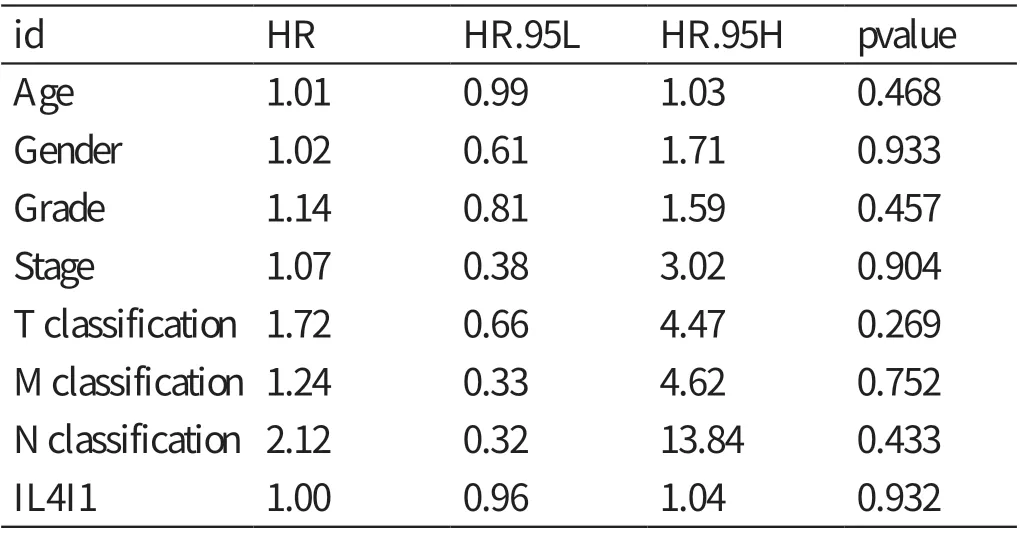
表2 多因素分析肝细胞癌组织中IL4I1 表达量及临床病理特征对患者预后的影响
2.3 IL4I1 表达量与肝细胞癌患者临床病理特征相关性的分析
IL4I1 的 表 达 量 与TNM 分 期 中 的T 分 期﹝ T1、T2、T3、T4分别为0.66(0.30,1.52)、0.92(0.36,2.79)、0.64(0.26,1.92)、1.57(0.84,2.91),P<0.05 ﹞(见图2A)以及肿瘤组织学分级﹝ G1、G2、G3、G4分别为0.31(0.19,0.76)、0.75(0.32,1.78)、0.93(0.42,2.14)、0.86(0.46,2.07),P<0.01 ﹞有 关(见 图2B),与患者的年龄、性别、淋巴结浸润程度及肿瘤远处转移无关(P>0.05)(见图2C、2D、2E、2F)。
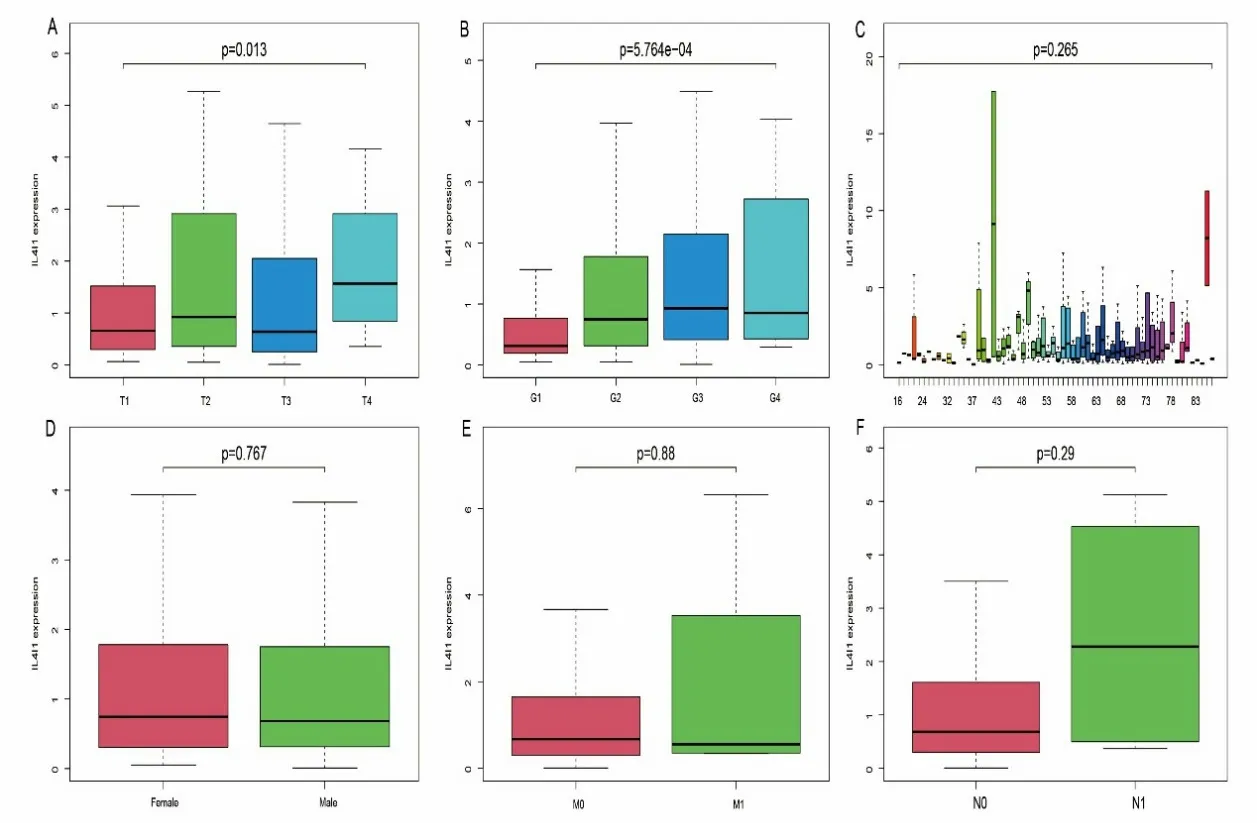
图2 不同临床病理分类的肝细胞癌患者中IL4I1 基因表达的差异
2.4 GSEA
GSEA 提示,自然杀伤细胞介导的细胞毒性作用、细胞因子信号通路、造血细胞谱系、抗原处理和提呈途径、T 细胞受体信号通路等基因集在高表达组富集(ES 值 分 别 为0.813、0.772、0.744、0.706、0.702,P<0.01)。见表3。
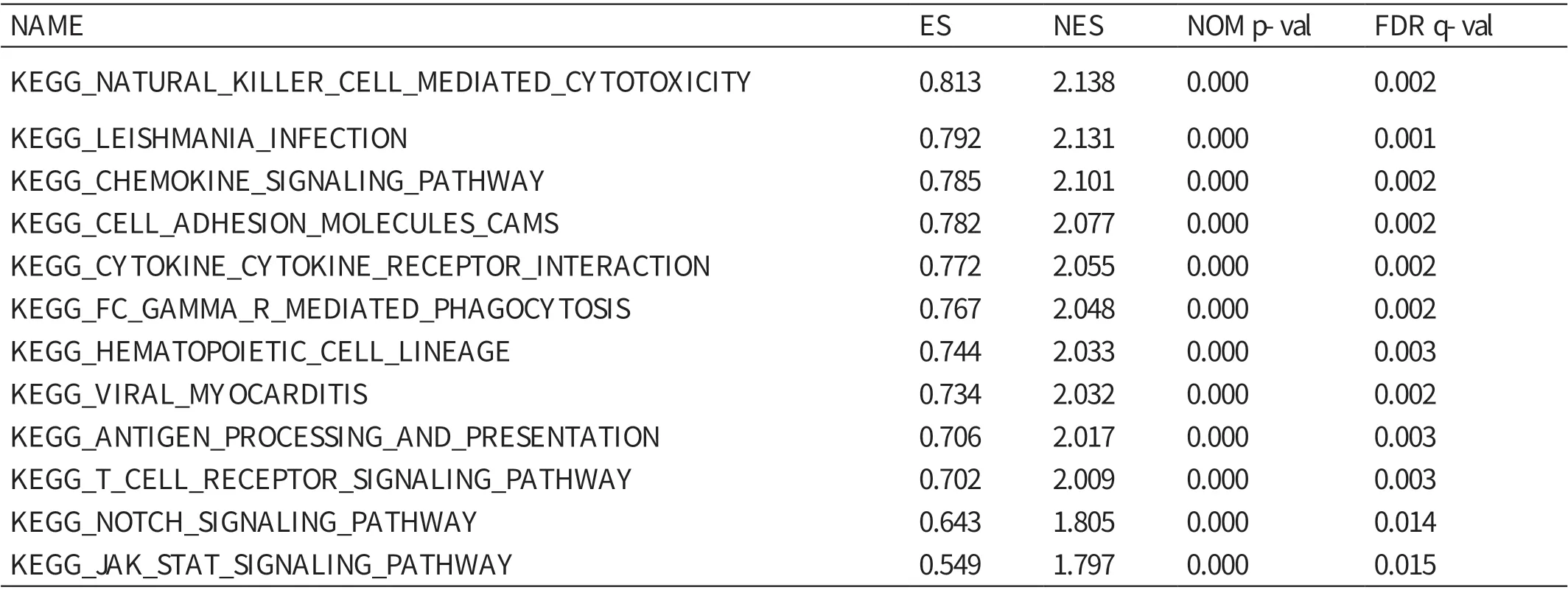
表3 GSEA
3 讨论
在全球范围内,原发性肝癌占所有癌症的6%,占所有癌症致死率的9%,它是全球第六种常见的癌症,也是癌症死亡的第四大原因[1]。原发性肝癌包括肝细胞癌(约占75%)、胆管细胞癌(约占6%)等。慢性炎症性肝损害是引起原发性肝癌最重要的危险因素,慢性炎症过程可能源于病毒感染(乙型肝炎病毒、丙型肝炎病毒等)、代谢性改变(酒精性脂肪性肝炎、非酒精性脂肪性肝炎等)、长期接触慢性致癌性毒素(黄曲霉毒素等)或寄生虫感染(血吸虫等)[13]。虽然接种疫苗和使用新型抗病毒药物抑制了与乙型病毒性肝炎或与丙型病毒性肝炎相关肝癌的恶化过程,但患者的不良生活习惯(如长期饮酒、饮食习惯不良等)加剧了慢性炎症的进展,从而提高了肝细胞癌的发生率[13]。由于肝癌在遗传、代谢和炎症方面的异质性,故治疗方法极具挑战性:化学药物(如阿霉素)治疗或激酶抑制剂(如一线药物索拉非尼、二线药物瑞格非尼等)治疗仅能略微延长肝癌患者的总体生存时间;虽然手术切除肿瘤或肝脏移植都可以用于治疗肝癌,但存在高复发率、低合格率等问题,导致肝癌的治疗效果并不理想[14-16]。因此,对肝微环境的复杂细胞和免疫分子网络的更好理解有利于发现新的治疗措施。在肿瘤微环境中,免疫系统识别肿瘤细胞,通过免疫调节消灭肿瘤细胞,从而抑制肿瘤的发生发展。目前,免疫疗法已经成为一种很有前景的肝癌治疗方法[17]。
在肿瘤微环境中,T 细胞可以识别肿瘤抗原,这些抗原由抗原提呈细胞(APC)递呈给T 细胞受体。此外,T 细胞介导的免疫调节反应还受到一组被称为免疫检查点的细胞表面分子的微调。许多肿瘤细胞能够逃避免疫系统,主要是通过过度表达抑制性配体与免疫检查点结合,抑制T 细胞免疫功能的活化而实现的[17]。有研究表明,在肝细胞癌患者中发现了T 细胞数量的减少和免疫功能的抑制,从而促进了肝细胞癌的发生发展[18]。越来越多的证据表明,用药物阻断免疫检查点,减少肿瘤细胞表达的抑制性配体与免疫检查点结合,是肝癌免疫治疗中最有效的方法之一[19]。近年来,细胞毒性T 淋巴细胞相关抗原4(CTLA-4)、程序性细胞死亡蛋白-1(PD-1)和程序性细胞死亡配体1(PD-L1)等抑制性检查点已被用来抑制实体瘤的抗肿瘤免疫反应[20-21]。T 细胞对激活状态的高代谢需求,使得它们特别容易受到生化环境改变的影响。在肿瘤微环境中产生的免疫抑制酶通过分解必需或半必需氨基酸和产生有毒的分解代谢产物来改变营养物质的可利用性,从而抑制局部T 细胞的抗肿瘤免疫反应[9]。IL4I1 是一种苯丙氨酸氧化酶,有研究表明IL4I1通过促进色氨酸的降解产生吲哚代谢产物和犬尿酸来激活芳烃受体(Aryl hydrocarbon receptor,AHR),促进肿瘤细胞的运动,并抑制获得性免疫,从而促进慢性淋巴细胞白血病(CLL)在小鼠体内的进展,证明了IL4I1 可以作为代谢免疫检查点,阻断IL4I1 有望成为肿瘤免疫治疗的新靶点[22]。IL4I1 在肝细胞癌中的作用机制以及能否成为肝癌新的诊断与免疫治疗靶点是本文所要研究的重点。
本研究通过医学生物信息学方法分析TCGA 公共数据库中肝癌的RNA 测序数据,发现肝细胞癌组织中的IL4I1 表达量显著高于正常肝组织,与在其他癌症中如B 细胞淋巴瘤[8]、肾癌[23]、卵巢癌[11]、皮肤黑色素瘤[24]中的研究结果一致。此外,本研究证实,在肿瘤分化程度越低和直径越大患者的癌组织中,IL4I1 的表达水平越高。通过GSEA,进一步阐明IL4I1的促癌机制,结果显示,自然杀伤细胞介导的细胞毒性作用、细胞因子信号通路、造血细胞谱系、抗原处理和提呈途径、T 细胞受体信号通路等基因集在高表达组富集。免疫细胞抑制和功能紊乱是肿瘤形成的重要原因。有研究表明,IL4I1 可以通过调节免疫细胞的分化,促进癌症的进展[25]。Notch 激活与肝癌的发生密切相关。有研究表明,肝组织的干细胞(hepatic stem cells,HpSCs)是Alb-Cre 小鼠中最有可能致癌的候选细胞,Notch2 信号异常可诱导具有HpSCs 特征的人类肝癌的形成[26]。JAK-STAT 激活与肝癌的发生密切相关,STAT 有多种受体。有研究表明,IL4I1可以通过激活STAT-3 和STAT-6 受体促进M1 型巨噬细胞向M2 型巨噬细胞的转化,从而促进肿瘤逃逸[27]。结合上述分析,IL4I1 可能通过JAK-STAT 信号通路和Notch 信号通路促进肝癌的发生和发展,再次证明了IL4I1 作为肝癌免疫治疗潜在靶点的潜力。IL4I1 作为新型的免疫抑制酶,在免疫代谢调节和肿瘤免疫逃逸的过程中发挥了重要作用。在免疫代谢调节方面,IL4I1 参与了T 细胞[25],B 细胞[24]的分化;在肿瘤免疫逃逸方面,IL4I1 主要通过直接限制细胞毒性T 细胞和Th1 细胞的生长,间接促进调节性T 细胞(Treg)的分化来抑制人类T 淋巴细胞的抗肿瘤作用[28]。当然,也有B 细胞及肿瘤特异性巨噬细胞的参与[24]。但IL4I1 介导的B 细胞在肿瘤发生过程中的作用尚不明确,有待进一步研究。已有研究表明,IL4I1作为免疫治疗靶点在乳腺癌的治疗中发挥了重要作用[12]。总之,IL4I1 作为免疫抑制酶,在肿瘤的临床治疗中发挥着越来越重要的作用,关于其详细的生理作用,有待进一步研究。
本研究结果表明,基因IL4I1 在肝细胞癌组织中表达上调,IL4I1 可能通过JAK-STAT 信号通路和Notch 信号通路促进肝细胞癌的发生和发展,其具有作为肝细胞癌免疫治疗靶点的潜力。
