生物钟基因对牦牛卵巢类固醇激素合成的影响
2023-05-08周凯欣苟育聪吕玺玮
洪 金,周凯欣,苟育聪,吕玺玮,张 寿,高 磊
(青海大学 农牧学院,青海 西宁 810016)
【研究意义】牦牛(Bos grunniens)作为世居青藏高原的土著动物,对高寒缺氧的高原牧区有较强的适应能力,具有重要的经济价值[1]。相比平原牛种,牦牛的性成熟晚且繁殖力低下,严重影响高寒地区农牧业发展和当地牧民的经济收入[2]。类固醇激素的合成与分泌影响雌性动物繁殖性能[3],生物钟与机体生命活动及其生理机能的调节有很大关系[4]。前期研究表明,生物钟系统调节哺乳动物血清生殖激素水平[5-7],奶牛卵巢中有生物钟基因的表达[8],同时Cry1、Bmal1和Per2等生物钟基因也分布在奶牛肝脏和乳腺组织中[9]。但牦牛卵巢中是否存在生物钟基因表达并调控类固醇合成,目前尚未见报道。因此,研究生物钟基因对牦牛卵巢类固醇激素合成的作用,进而通过生物钟靶向调控提高牦牛繁殖力具有重要意义。【前人研究进展】卵巢是合成哺乳动物类固醇激素的重要器官,其中雌二醇(Estradiol,E2)对卵巢颗粒细胞的增殖分化和卵泡的生长发育起着重要的调节作用,而孕酮(Progesterone,P4)对雌性动物的妊娠维持极为重要[3]。类固醇激素的合成分泌涉及一系列复杂的生理生化过程,包括类固醇急性调节蛋白(Steroidogenic actue regulatory protein,StAR)、细胞色素P450 侧链裂解酶(Cytochrome P450 cholesterol side chain lyase,CYP11A1)、17α-羟化酶(17α-hydroxylase,CYP17A1)、17β-羟基脱氢酶(17β-hydroxysteroid dehydrogenase,HSD17B3)和细胞色素P450 芳香化酶(Cytochrome P450 aromatase,CYP19A1)等限速酶的参与和调节[10]。研究发现,类固醇合成因子1(Steroidogenic factor 1,SF1)和孤儿核受体(Orphan nuclear receptor 77,NUR77)等核受体基因通过结合在类固醇合成基因StAR、Cyp11a1、Hsd17b3和Cyp19a1的转录起始位点,激活上述靶基因的转录[11-14]。生物钟是一套控制生物钟基因及其编码蛋白24 h周期性震荡的非常复杂的调控系统,在哺乳动物、植物和微生物机体中存在表达分布[15-16]。经典的生物钟基因有Clock、Bmal1、Nr1d1、Per1、Per2、Cry1、Cry2、Dbp等,这些生物钟基因还可以在其下游生物钟控制基因的启动子区域直接结合调控该基因的转录[17-19]。哺乳动物体内生物钟不仅存在于位于中枢控制系统的下丘脑视交叉上核,而且也存在于大多数外周组织、器官和细胞中,维持机体生理机能的节律性变化和平衡[20-21]。前期研究证实,生物钟调节哺乳动物血清促性腺激素释放素、促黄体生成素和孕酮等生殖激素分泌水平[5-7],生物钟基因Cry1在绵羊的卵巢、子宫和下丘脑等组织中均存在表达分布[22],生物钟基因Bmal1敲除(Bmal1-/-)小鼠卵巢生物钟基因及类固醇合成基因StAR的表达显著下调[23],进一步研究证实,生物钟控制基因StAR的表达调控受到多种生物钟基因的调节[24],推测生物钟系统与动物季节性繁殖和血清类固醇激素含量变化有关。【本研究切入点】牦牛作为季节性发情动物,其繁殖行为受日照影响较大[25]。而牦牛卵巢类固醇激素含量是否存在昼夜节律性变化,其卵巢中是否存在生物钟基因表达并影响类固醇合成,需要进一步深入研究。【拟解决的关键问题】本研究拟检测牦牛血清雌二醇和孕酮含量昼夜变化规律,探究生物钟因子、类固醇合成和核受体因子在牦牛卵巢中表达分布情况,分析牦牛类固醇合成和核受体转录因子启动子区域生物钟控制元件,阐明牦牛生物钟基因对卵巢类固醇合成的影响,为研究高原牦牛繁殖障碍机理及通过生物钟靶向调控,提高牦牛生殖力提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 12月龄、健康、初始体质量相近(250 kg左右)的雌性牦牛6头,饲养于青海省海西州金穗牧业有限公司,给予正常进食和饮水。
1.1.2 试验材料和主要试剂 雌二醇测定试剂(E2)和孕酮测定试剂(P4),均购自北京北方生物技术研究所有限公司;蛋白裂解试剂(KGP701)和蛋白浓度测定试剂(KGP902),均购自江苏凯基生物技术股份有限公司;兔抗BMAL1(ab93806)一抗和兔抗CYP19A1(ab18995)一抗,均购自英国Abcam 公司;兔抗StAR(D223242)一抗,购自上海生工生物工程股份有限公司;鼠抗β-actin(DKM9001L)一抗,购自天津三箭生物技术有限公司;驴抗兔IgG(H+L)二抗(A18741)、PVDF 膜(88585)、脱脂奶粉(37530)和ECL 发光液(A38556),均购自美国Thermo Fisher公司;DAB显色剂(D12384)和苏木精染液(51275),均购自美国Sigma-Aldrich 公司;TRIzol(9018)、反转录试剂盒(RR036A)、TaqTMPCR 酶(R001B)和SYBR®Premix ExTaqII(RR820A),均购自日本TaKaRa公司。
1.2 试验方法
1.2.1 样品采集 青海地区8—9 月日照与黑夜时间大致相当(12 h∶12 h),光照开始时间在08:00 左右(ZT0),光照结束时间在20:00左右(ZT12)。牦牛属于季节性发情动物[25],本研究在8—9月雌性牦牛生殖能力旺盛的时间段采集血液和卵巢组织。
血清样品:颈静脉采血,收集ZT0 和ZT12 时间点每只雌性牦牛血液样品,于室温环境下2 000 r/min离心30 min析出血清,-80 ℃冻存备用。
卵巢组织:手术法分别采集ZT0和ZT12时间点的卵巢组织,每点3只。收集的一部分卵巢组织样品立即用多聚甲醛(40 g/L)固定,用于免疫组化(Immunohistochemistry,IHC)试验;另外一部分卵巢组织样品迅速用液氮冻存备用,用于后续提取总RNA和蛋白试验。
1.2.2 牦牛血清雌二醇和孕酮含量的节律性变化分析 ELISA 检测ZT0和ZT12时间点牦牛血清雌二醇和孕酮含量,具体操作按照ELISA 试剂盒操作说明进行,分析牦牛血清雌二醇和孕酮含量是否存在昼夜节律性变化。
1.2.3 生物钟蛋白BMAL1 在牦牛卵巢中的表达定位 IHC 检测生物钟蛋白BMAL1 在ZT0 时间点收集的牦牛卵巢组织中的表达分布情况。将脱蜡的卵巢切片置于切片架中,然后将切片架放入柠檬酸钠缓冲液(0.01 mol/L,pH 6.0)中,用微波炉加热至沸腾,进行抗原热修复;室温冷却后取出切片放入湿盒中,室温条件下滴加H2O2-甲醇溶液(体积分数为3%)完全覆盖组织部分并孵育10 min;牛血清白蛋白(50 g/L)滴加后,在37 ℃的恒温箱中封闭1 h;试验组每张切片滴加适量BMAL1一抗,阴性对照(Negative control,NC)组用PBS代替一抗进行试验,4 ℃孵育过夜;每张切片滴加适量二抗后,37 ℃恒温箱孵育1 h;DAB 显色液进行染色处理,各切片保持一致的显色时间;自来水冲片后使用苏木精染液复染,并保持各切片显色时间一致;梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜镜检并采集图像。
1.2.4 生物钟基因在牦牛卵巢中的表达分析 PCR 检测生物钟基因(Bmal1、Dbp、Nr1d1、Per1)在牦牛卵巢中的表达。利用NCBI 中的Pick Primers 在线引物设计软件(www.ncbi.nlm.nih.gov)设计引物(表1),并由上海生工生物工程股份有限公司合成。采用TRIzol 法提取卵巢组织总RNA,利用分光光度计测定260 nm吸光度,计算总RNA浓度,按照说明书操作进行反转录合成cDNA。PCR反应体系参照说明书配制,反应程序为94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火15 s,72 ℃延伸30 s,30 个循环;72 ℃延伸5 min。琼脂糖凝胶(2 %)电泳检测PCR产物。
1.2.5 生物钟基因、类固醇合成基因和核受体基因在牦牛卵巢中的时空表达分析 以Gapdh为内参基因,荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)检测生物钟基因、类固醇合成基因(StAR、Cyp11a1、Hsd17b3、Cyp19a1)以及核受体基因(Sf1、Lhcgr、Nr1h4、Nur77)在牦牛卵巢中的时空表达规律。利用NCBI 在线引物设计软件,设计引物(表1),以cDNA 为模板进行RT-qPCR 试验,具体操作按照RT-qPCR SYBR green MIX 试剂的说明书进行。根据样本的循环阈值(Ct),采用相对定量法(2-△△Ct)进行数据分析。
1.2.6 生物钟蛋白和类固醇合成蛋白在牦牛卵巢中的表达分析 蛋白免疫印迹(Western blot,WB)检测生物钟蛋白BMAL1、类固醇合成蛋白StAR 和CYP19A1在牦牛卵巢中的表达。将牦牛卵巢组织研磨后,使用蛋白裂解液提取蛋白,BCA 法测定蛋白浓度,以上操作均按照试剂盒说明书进行。取适量蛋白样品进行电泳,然后将蛋白转印至PVDF 膜上;将膜转移至脱脂奶粉(50 g/L)中,室温条件下封闭2 h;PBST洗膜后将膜分别置于对应的一抗工作液中,使用4 ℃摇床振荡过夜;PBST洗膜后将膜分别置于对应的二抗工作液中,置于室温摇床上进行1.5 h的孵育;然后用ECL 发光液在暗室里显色;图像分析系统采集图像并分析数据。
1.2.7 牦牛类固醇合成基因和核受体基因启动子区域生物钟控制元件分析 登录NCBI(www.ncbi.nlm.nih.gov)或Ensembl(asia.ensembl.org)网址查找牦牛卵巢类固醇合成基因与核受体基因的基因组DNA 序列,列出位于转录起始位点上游的-1 至-2 000 bp 的启动子区域,对牦牛体内可能存在的生物钟基因结合元件(E-box、RORE 和D-box)进行统计分析,揭示牦牛卵巢生物钟调控类固醇合成的内在机制。其中,5′-CANNTG-3′(其中N表示任意核苷酸序列)为E-box;5′-(A/G)GGTCA-3′或5′-TGACC(C/T)-3′为RORE;5′-TTA(TG/CA)TAA-3′为D-box。
1.3 数据统计与分析
利用Sigma plot v14.0 软件对试验数据进行计算和处理,并进行单因素方差分析(t检验)和双因素方差分析(Two way ANOVA),数据采用“平均值±标准差”形式表示。
2 结果与分析
2.1 牦牛血清类固醇激素含量昼夜节律性变化
ELISA 检测不同时间点(ZT0 和ZT12)牦牛血清雌二醇和孕酮含量,结果显示,ZT0 时间点牦牛血清雌二醇和孕酮含量均极显著低于ZT12时间点(P<0.001),表明牦牛血清雌二醇含量和孕酮含量有节律性的变化(图1)。

图1 牦牛血清雌二醇和孕酮含量昼夜节律性变化Fig.1 Circadian rhythmicity of serum E2 and P4 levels in female yaks
2.2 类固醇合成基因和核受体基因在牦牛卵巢中的节律性表达分析
类固醇合成基因和核受体基因在牦牛卵巢中表达的RT-qPCR检测结果(图2)显示,不同时间点(ZT0和ZT12)类固醇合成基因(StAR、Cyp11a1、Hsd17b3、Cyp19a1)和核受体基因(Sf1、Lhcgr、Nr1h4、Nur77)在牦牛卵巢中均有表达。其中,ZT12 的Cyp11a1、Cyp19a1和Nr1h4表达水平显著高于ZT0(P<0.05),ZT12 的Hsd17b3、Sf1和Nur77表达水平极显著高于ZT0(P<0.001),StAR和Lhcgr在2个时间点的表达无显著差异,表明Cyp11a1、Hsd17b3、Cyp19a1、Sf1、Nr1h4和Nur77在牦牛卵巢中存在节律性表达差异。
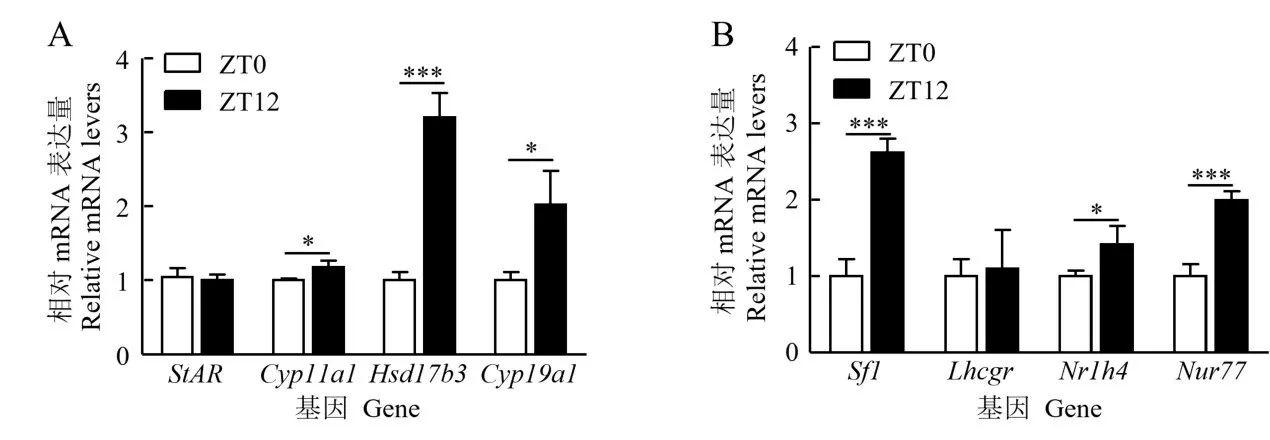
图2 类固醇合成基因和核受体基因在牦牛卵巢中的时空表达分析Fig.2 Circadian rhythm expression of steroidogenic and nuclear receptor genes in yak ovaries
2.3 生物钟蛋白BMAL1在牦牛卵巢组织中的表达
根据文献报道,生物钟蛋白BMAL1 在ZT0 时间点的哺乳动物卵巢组织存在高表达[10,13],为检测生物钟因子在牦牛卵巢中是否存在表达分布,选取ZT0 时间点采集的牦牛卵巢组织进行免疫组化试验。BMAL1抗体孵育结果显示,牦牛卵巢颗粒细胞有棕色信号(图3B),说明生物钟蛋白BMAL1在牦牛卵巢组织中有表达,且主要分布在分泌雌二醇和孕酮的卵巢颗粒细胞,提示BMAL1 与牦牛类固醇激素分泌有关。相反,阴性对照显示卵巢颗粒细胞中无棕色信号,细胞核被苏木精染为蓝色(图3A),表明棕色染色为BMAL1蛋白特异性染色。
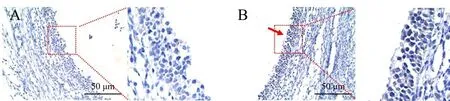
图3 生物钟蛋白BMAL1在牦牛卵巢组织中的表达分布Fig.3 Expression and distribution of circadian clock protein BMAL1 in yak ovaries
2.4 生物钟基因在牦牛卵巢中的表达
采用普通PCR 验证生物钟基因在牦牛卵巢中的表达,结果表明,生物钟基因(Bmal1、Dbp、Nr1d1、Per1)在不同时间点(ZT0和ZT12)牦牛卵巢中均有表达(图4)。采用RT-qPCR检测生物钟基因在牦牛卵巢中的时空表达规律,结果显示(图5),ZT0 的Bmal1基因表达水平极显著高于ZT12(P<0.01),ZT12 的Nr1d1表达水平显著高于ZT0(P<0.05),ZT12的Dbp和Per1表达水平极显著高于ZT0(P<0.01),表明生物钟基因在牦牛卵巢中存在节律性表达差异。同时发现,生物钟基因(Bmal1、Dbp、Nr1d1、Per1)与类固醇合成基因(Cyp11a1、Hsd17b3、Cyp19a1)和核受体基因(Sf1、Nr1h4、Nur77)表达变化存在节律相关性。

图4 生物钟基因在牦牛卵巢中的表达分析Fig.4 Expression analysis of circadian clock genes in yak ovaries
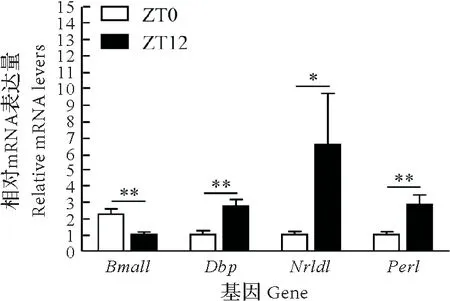
图5 生物钟基因在牦牛卵巢中的时空表达分析Fig.5 Circadian rhythm expression of circadian clock genes in yak ovaries
2.5 生物钟蛋白和类固醇合成蛋白在牦牛卵巢中的表达
生物钟蛋白BMAL1、类固醇合成蛋白StAR 和CYP19A1 在牦牛卵巢中表达的WB 检测结果(图6)显示,ZT0 时间点BMAL1 蛋白在牦牛卵巢中的表达水平极显著高于ZT12(P<0.01),ZT12 时间点CYP19A1蛋白在牦牛卵巢中的表达水平极显著高于ZT0(P<0.001),两个时间点类固醇合成蛋白StAR 在牦牛卵巢中的表达水平无显著差异。结果表明,BMAL1 和CYP19A1 蛋白在牦牛卵巢中存在节律性表达,且有节律相关性。
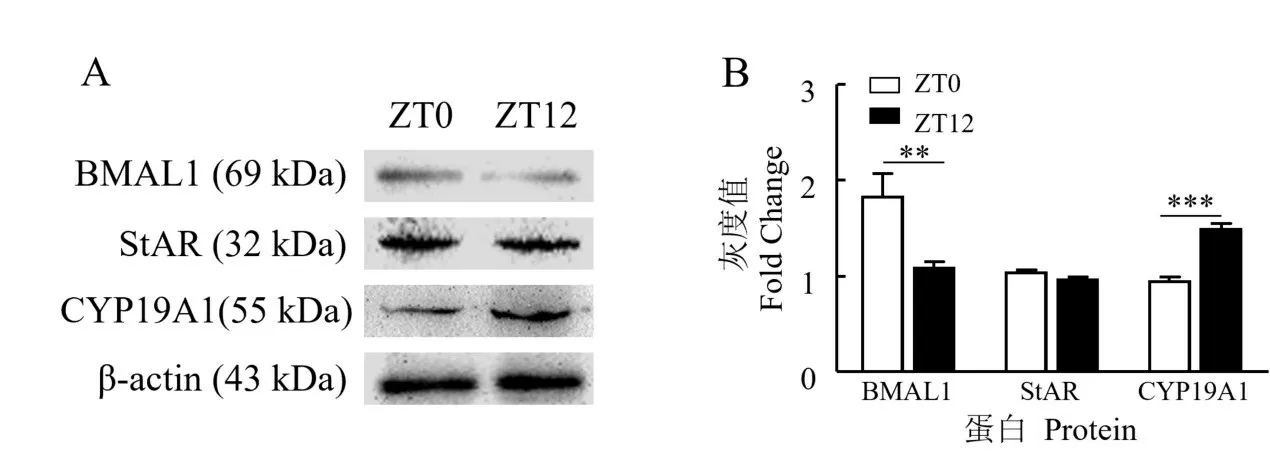
图6 生物钟和类固醇合成蛋白在牦牛卵巢中的表达变化Fig.6 Expression of circadian clock and steroidogenic proteins in yak ovaries
2.6 牦牛类固醇合成相关基因启动子区域存在生物钟控制元件
生物信息学统计分析得出,所有与牦牛类固醇合成和类固醇合成有关的核受体基因启动子区域,都存在一定数量的生物钟作用元件(E-box、RORE 和D-box),其中所有基因的启动子区域都有较多的Ebox模块,除StAR外其余基因都有一定的RORE 模块,Hsd17b3、Lhcgr和Nr1h4基因有一定的D-box模块,说明牦牛类固醇合成相关基因启动子区存在生物钟基因结合位点,生物钟基因对牦牛类固醇激素的合成有一定的调节作用(表2)。

表2 牦牛类固醇激素合成相关基因启动子上可能的生物钟控制元件Tab.2 Putative clock-controlled elements at the promoters of steroidogenesis-related genes in yaks
3 讨论与结论
3.1 讨论
3.1.1 牦牛卵巢类固醇激素分泌与生物钟系统相关联 卵巢类固醇激素主要包括雌二醇和孕酮,其在卵巢内的合成过程包括一系列复杂的生理和生物化学反应[26]。首先,卵巢卵泡内膜细胞中的胆固醇在StAR作用下从线粒体外膜转移到内膜,在CYP11A1作用下转化为孕烯醇酮,然后经HSD3B2催化生成孕酮。CYP17A1 催化孕酮转变为雄烯二酮,进入颗粒细胞并最终在CYP19A1 作用下形成雌二醇[27]。研究发现,雌性哺乳动物的生殖机能随季节和光照变化,具有强烈的周期性变化规律[28]。雌性山羊的这种周期性规律表现为激素分泌变化导致的增强或减少的性腺功能和性欲[29]。雌性哈努曼叶猴由于季节更替导致的性腺激素分泌水平的变化影响其繁殖性能[30]。通过神经内分泌调节和药物处理可以改善雌马的繁殖季节性限制[31],揭示了生物节律对维持雌性生殖具有重要作用。诸多研究表明,生物钟基因在包括肝脏、肾脏、胰脏、卵巢、胸腺和血液在内的多种外周组织和器官中均存在广泛表达分布,构成了完整的外周生物钟系统[15]。不同雌性动物血清雌二醇和孕酮含量均存在明显的昼夜节律变化,说明生物钟系统与雌性动物类固醇激素分泌有关[6,32-33]。本研究结果与上述研究发现一致,牦牛血清雌二醇和孕酮含量存在昼夜节律性变化,说明生物钟系统与牦牛类固醇激素分泌存在相关性。
3.1.2 生物钟基因在牦牛卵巢中的表达分布 研究表明,生物钟参与多种生理机能调控,维持机体内环境稳态[13,34]。哺乳动物下丘脑-垂体-卵巢轴上每个水平的生物钟系统对雌性生殖活动和繁殖能力均具有重要的调控作用[17]。前期研究发现,生物钟基因在哺乳动物卵巢组织以及从大鼠和小鼠卵巢分离的卵巢颗粒细胞中均存在节律性表达[13,35-42]。从小鼠、兔子和牛卵巢分离的卵母细胞以及子宫中分离出的未附植胚胎中均存在生物钟基因的节律性表达[43-46]。大鼠卵巢中卵泡和黄体中存在生物钟基因的节律性表达[47-48],且生物钟基因Per1和Per2的mRNA在傍晚呈现表达高峰[37]。生物钟基因Clock、Bmal1、Per1、Per2、Cry1和Cry2在大鼠的输卵管组织和妊娠晚期小鼠的子宫、胎盘和胎膜中均存在节律性表达分布[49-50]。生物钟基因与奶牛类固醇激素分泌密切相关[8]。生物钟基因Bmal1在哺乳动物生理机能调控中起到关键性作用[51],跑步轮试验检测发现Bmal1-/-小鼠活动和作息规律紊乱[52]。本研究结果与上述研究一致,牦牛卵巢组织存在生物钟蛋白BMAL1的表达分布,且在卵巢颗粒细胞高表达,提示生物钟系统参与牦牛类固醇激素合成。生物钟蛋白BMAL1 和生物钟基因(Bmal1、Dbp、Nr1d1、Per1)在牦牛卵巢中均存在昼夜节律性表达,说明牦牛体内存在完整的卵巢生物钟系统。
3.1.3 牦牛卵巢生物钟对类固醇激素分泌的调控 研究表明,雌性Bmal1-/-小鼠表现为不孕不育,类固醇激素分泌减少,发情周期延长,胚胎附植率降低,卵巢组织类固醇合成基因表达下调[23,53-56]。雌性Clock基因突变小鼠产仔数减少,排卵障碍,死胎和畸形数增多[6,57]。生物钟基因Per1/Per2敲除小鼠卵巢中类固醇合成基因表达下降[24]。Bmal1子宫肌细胞条件性敲除小鼠分娩过程中难产率显著增加[58],表明生物钟基因对雌性动物生殖机能维持具有重要作用。体外培养的猪卵巢颗粒细胞中,Bmal1基因表达下调影响类固醇合成相关的基因表达和孕酮激素的分泌[59]。CRY 通过调节非洲爪蛙卵巢类固醇激素的合成调控其发情周期变化[60]。Bmal1与Nr1d1基因协同调控牛子宫内膜基质细胞前列腺素合成关键酶基因的表达水平[61]。综上所述,生物钟系统可以通过多种途径参与到卵巢类固醇激素的合成调控。本研究结果与上述研究发现一致,牦牛卵巢生物钟蛋白和生物钟基因存在昼夜节律性表达的差异,牦牛卵巢中存在类固醇合成蛋白StAR、CYP19A1 和类固醇合成基因(StAR、Cyp11a1、Hsd17b3、Cyp19a1)表达,且类固醇合成基因(Cyp11a1、Hsd17b3和Cyp19a1)和类固醇合成蛋白CYP19A1 均存在节律性表达差异,表明生物钟系统与牦牛类固醇合成因子表达有关,且或许直接参与Cyp11a1、Hsd17b3和Cyp19a1基因的表达调控。
研究表明,某些核受体基因与类固醇合成基因转录调控有关。类固醇合成基因StAR、Cyp11a1、Hsd17b3和Cyp19a1存在核受体基因Sf1和Nur77的结合位点,通过结合在靶基因启动子区域启动靶基因的转录,促进类固醇激素合成[12-13]。前期研究发现,人、山羊、大鼠和小鼠卵巢中均存在类固醇合成基因(Hsd3b2、Hsd17b3和Cyp11a1)、核受体基因(Sf1和Nr0b1)和生物钟基因的节律性表达[54,61-63]。核受体基因Sf1条件性敲除小鼠胚胎附植存在障碍,孕酮分泌减少[64]。生物钟基因Clock诱导Cyp19a1和LhcgrmRNA 的表达,从而诱导卵巢颗粒细胞雌二醇分泌;Per2通过抑制BMAL1/CLOCK 异源二聚体的活性,从而抑制StAR的表达,抑制卵巢孕酮分泌[65]。本研究结果与上述发现一致,牦牛卵巢中不仅存在类固醇合成基因(Cyp11a1、Hsd17b3和Cyp19a1)的节律性表达,也存在核受体基因(Sf1、Nr1h4和Nur77)的节律性表达,说明牦牛卵巢生物钟系统通过直接或间接(调控核受体基因)影响类固醇合成基因的表达,影响其类固醇激素的分泌。
大量研究证实,生物钟控制基因启动子区域存在一定的生物钟控制元件,启动生物钟震荡调控机制[66]。类固醇合成基因StAR、Cyp11a1、Hsd3b2和Cyp19a1,已被证实都是生物钟控制基因,受到生物钟系统的调控[24,67]。猪卵巢中核受体基因Sf1通过结合在类固醇合成基因Cyp19a1的转录起始位点,激活其mRNA 的表达[59]。鸡卵巢类固醇合成基因StAR的启动子区域存在一定数量的BMAL1/CLOCK 二聚体结合位点(E-box),证明生物钟系统对鸡类固醇合成基因StAR的表达有直接调节作用[67]。山羊Hsd17b3和Sf1基因启动子区域存在大量的生物钟控制元件,Bmal1基因过表达可显著提高山羊睾丸间质细胞中Hsd17b3的表达水平,实时荧光素酶活性监测证实BMAL1/CLOCK 二聚体直接调控Hsd17b3基因的转录[68]。本研究结果与上述研究发现一致,牦牛体内类固醇合成和核受体基因启动子区域,均存在一定数量的生物钟控制元件,说明牦牛类固醇合成和核受体基因均为生物钟控制基因。类固醇合成基因(Cyp11a1、Hsd17b3和Cyp19a1)和核受体基因(Nr1h4和Nur77)有较多的E-box、RORE和D-box序列统计数,且同时存在节律性表达,提示牦牛卵巢生物钟直接调控Cyp11a1、Hsd17b3、Cyp19a1、Nr1h4和Nur77的转录水平影响类固醇激素合成。
3.2 结论
本研究发现牦牛卵巢生物钟与类固醇合成基因表达存在节律相关性,初步分析了生物钟对牦牛类固醇激素分泌的影响。研究结果为后期研究牦牛卵巢生物钟调控类固醇激素分泌的分子机制以及通过生物钟靶向调控牦牛繁殖力提供理论基础。
致谢:青海大学省部共建三江源生态与高原农牧业国家重点实验室自主课题(2022-ZZ-09)、青海大学青年科研基金项目(2022-QNY-5,2021-QNY-8)、青海省科技厅科技援青合作专项项目(2020-QY-217)和青海省科技厅自然科学基金青年项目(2022-ZJ-934Q)同时对本研究给予了资助,谨致谢意!
