两株蒜头果内生木霉的物种鉴定及其对幼苗的促生作用研究
2023-05-08王俊威雷小铃陈婉东
王俊威,雷小铃,陈婉东,潘 悦,王 娟
(1.西南林业大学 地理与生态旅游学院,云南 昆明 650224;2.西南林业大学 林学院,云南 昆明 650224;3.西南林业大学 绿色发展研究院,云南 昆明 650224)
【研究意义】蒜头果(Malania oleifera)属铁青树科蒜头果属,主要分布于我国云南东南部广南、富宁两县以及广西西部的部分石灰岩地区,为国家Ⅱ级珍稀濒危保护植物。蒜头果种仁油中富含神经酸,该物质能促进受损神经组织的修复与再生,故而被誉为植物油中的“液体黄金”[1-2]。随着蒜头果市场前景和应用价值的不断凸显,云南省广南、富宁两县积极开展蒜头果人工种植,然而蒜头果幼苗造林存活率及保存率较低,且易受多种病害侵染[3-4],因此研究蒜头果促进生长、提高抗性的方法是实现其种植产业持续健康发展的技术保障。【前人研究进展】在与植物长期的协同进化过程中,植物内生真菌成为决定植物健康和产量的关键因素之一,不仅与植物的营养摄取、生长发育及存活率紧密相关,也对植物免疫系统调节起着重要作用[5]。前期研究表明,木霉为蒜头果内生真菌的优势属[6]。据报道,内生木霉可代谢产生吲哚乙酸(IAA)、细胞分裂素和类植物生长素等多种植物生长调节剂刺激植物生长,同时降低高浓度植物外源激素对寄主生长产生的抑制作用[7-9]。而且,内生木霉通过增加不溶性化合物的溶解性以及微量营养物质的可利用性,提高植物对矿质元素的摄取率[10-11]。大量研究表明,内生木霉可显著促进植物的种子萌发、组织分化、根系生长以及生物量和产量的增加[12-14]。此外,内生木霉可通过增强植物抗氧化系统能力,有效清除活性氧或阻止活性氧的产生,提高宿主对生物和非生物胁迫的耐受力[15-16]。【本研究切入点】目前国内外未见蒜头果内生木霉对其幼苗生长发育和抗性水平有何影响的报道。【拟解决的关键问题】本研究将对前期分离获得的两株蒜头果内生木霉进行物种鉴定,揭示其产IAA 及解钾能力,并通过接种幼苗的生长性状、生物量、叶绿素含量及抗氧化酶活性测定,综合评价供试木霉的促生作用,为蒜头果微生物资源利用及优质苗木培育提供参考数据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 SF151 和SF231 于2019 年4 月分别采集自云南省文山州广南县健康蒜头果植株的根和茎,从表面消毒后的样品中分离获得[6]。
1.1.2 供试苗木 2019年10月收集当年生大小一致且无病害症状的蒜头果种子,用50%多菌灵可湿性粉剂浸泡30 min后无菌水漂洗自然风干,河沙经高压灭菌后添加无菌水保持湿度,将浸泡后的种子置于河沙中沙藏4 个月待萌发。营养钵使用75%乙醇溶液表面消毒,将萌发的蒜头果种子用灭菌混合基质(红土∶腐殖土∶珍珠岩=3∶2∶1)单株种植于营养钵,定期浇无菌水保持营养钵中土壤湿润,待蒜头果长至6~8片叶时进行接种试验。
1.2 供试菌株的种类鉴定
1.2.1 分子学鉴定 通过尿素提取法提取上述两株真菌的DNA[17],分别对其DNA 原液进行核糖体内转录间隔区(ITS)、转录延长因子(TEF)和RNA 聚合酶大亚基(RPB2)3 个基因片段的PCR 扩增,相关引物和PCR 反应条件参照Zhu等[18]和Chaverri等[19]。PCR 产物经凝胶电泳检测送昆明硕擎生物科技有限公司进行双向测序。
测序结果在CExpress 中手动拼接校正后经NCBI 比对,选出相似度较高且已发表的菌株作为参考,查阅文献并下载参考序列基于最大似然法(ML)和贝叶斯法(BI)构建系统发育树。使用jModelTest 2.1.4 构建最佳模型,系统发育树在MrBayes 3.1.2 中采用Markov Chain Monte Carlo(MCMC)法构建,去除25%的最初结果,后验概率经最终的贝叶斯系统树计算[20]。最大似然法使用RAxML 分析,靴带值重复计算1 000 次[21]。
1.2.2 形态学鉴定 将活化后的菌株转接至玉米葡萄糖培养基(CMD)、马铃薯葡萄糖培养基(PDA)和低营养琼脂培养基(SNA)平板,25 ℃条件下黑暗培养5~20 d后观察菌落形态、质地以及颜色等特征。并用灭菌解剖针挑取SNA培养基上的气生菌丝或疱状结构制备水玻片,显微镜下观察菌株的分生孢子梗、瓶梗、分生孢子形态及着生方式,每类结构测量30次。
1.3 促生功能测定
1.3.1 产IAA 能力测定 供试菌株活化后接种于PDB 液体培养基,经180 r/min,28 ℃,12 d 培养后抽滤菌丝收集发酵液。发酵液与Salkowski 比色液等比例混合后静置30 min,根据显色结果对菌株的产IAA 能力进行定性检测。混合液颜色越深,表明其产IAA 能力越强。将显色的发酵液与Salkowski 比色液等比例混合后采用紫外分光光度计测定其OD530,并通过绘制标准曲线计算供试菌株的产IAA活性。
1.3.2 解钾能力测定 将木霉菌株接种于PDA 培养基中28 ℃暗培养7 d,用灭菌打孔器取直径5 mm 的菌饼接种于解钾培养基培养20 d,若菌饼周围出现透明圈,表明该菌具有解钾活性,测量透明圈直径,并通过四苯硼酸钠重量法测定菌株的解钾能力[22]。
1.4 幼苗接种效应研究
取上述7 个菌饼接种于600 mL PDB 液体培养基,置于恒温振荡培养箱中180 r/min,28 ℃培养96 h,经无菌滤纸过滤并通过血球计数板统计将菌液浓度稀释至1×106个/mL。
试验设2 个处理组和1 个对照组,处理组每月通过灌根的方式定期施用50 mL 供试菌液,对照组施用等量无菌水,共处理6次,每处理20个重复。每处理随机取10株幼苗测量施菌前和培养6个月后的幼苗株高、茎粗和叶片数,其中株高用钢卷尺测量植株茎基部到茎尖的距离,叶片数为整株幼苗所有叶片的数量,茎粗用游标卡尺测定茎基部直径。随后将植株取出清水洗净根部后自然风干,测定其鲜重,105 ℃杀青30 min,再65 ℃烘干至恒重后测定其干重。每处理另取10 株幼苗,采集第2~4 片功能叶测定其叶绿素含量、SOD 和POD 活性,其中叶片叶绿素含量采用乙醇浸提比色法进行测定[23],叶片的SOD 和POD 活性参照罗阳兰[13]进行测定,再将植株取出洗净根部后统计单株吸器数量和最大吸器直径。最后每株2 段总长6 cm 的侧根,剪成1 cm 的根段通过KOH-台盼蓝染色法来观察接种真菌在蒜头果幼苗根部定殖情况并计算定殖率[24]。
1.5 数据统计
使用 SPSS25.0对不同处理间幼苗的生长性状、生物量、叶绿素含量及抗氧化酶活性进行单因素方差分析,并对供试菌株接种幼苗后的各项测定指标进行相关性分析。
2 结果与分析
2.1 两株蒜头果内生木霉的物种鉴定
如图1 所示,经ITS、TEF 和RPB2 3 个片段构建系统发育树,SF231 与SF151 两株菌分别位于两个不同的分类单元。其中SF231 与T.koningiopsis聚为一支,与T.koningiopsisCEN1386 的贝叶斯和最大似然后验概率分别达到1.00 和95。SF151 与T.gamsiiGJS04-09 位于相同支系,且贝叶斯和最大似然分别1.00和100。
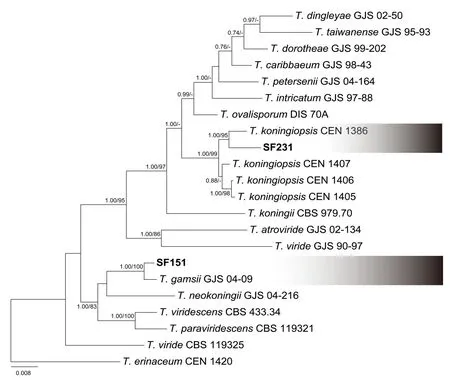
图1 基于ITS、TEF和RPB2联合的贝叶斯系统发生树Fig.1 Bayesian consensus tree generated from the DNA sequences of ITS,TEF and RPB2
如图2 所示,SF151 在PDA 培养基上25 ℃培养7 d 后菌落呈白色,菌丝致密。在SNA 培养基中25 ℃菌落白色,在CMD 培养基上25 ℃培养,菌丝颜色较浅呈黄绿色。分生孢子梗树状,瓶梗中部略膨大,成对出现于单个或末端分枝,也会多个聚集,大小为(6.1-)7.1-10.5(-12.4)×(1.4-)1.8-2.3(-2.8)µm,长宽比(2.5-)3.7-4.9(-7.4)。分生孢子光滑,卵圆、椭圆或不规则椭圆形,大小(2.4-)2.7-3.9(-4.2)×(2.2-)2.3-2.9(-3.3)µm,长宽比(1.1-)1.2-1.4(-1.5)。
SF231 在PDA 培养基上25 ℃培养7 d 菌落呈浅灰至深灰,菌丝致密。在SNA 培养基中25 ℃培养菌落浅灰色,在CMD 培养基上25 ℃培养,菌落透明状,边缘疱状结构聚合。分生孢子梗呈树状,瓶梗基部较窄,大小为(4.3-)5.4-9.6(-10.6)×(1.9-)2.0-2.4(-2.6)µm,长宽比(2.0-)2.2-4.7(-5.0),分生孢子光滑,椭圆形,大小为(2.8-)2.9-3.8(-4.2)×(2.2-)2.3-3.0(-3.2)µm,长宽比(1.0-)1.2-1.6(-1.7)。结合两株内生木霉的系统
发育分析和形态学特征,将SF151和SF231分别鉴定为T.gamsii和T.koningiopsis。
2.2 两株蒜头果内生木霉的促生功能
2.2.1 蒜头果内生木霉的产IAA 能力 如表1所示,IAA标准品与Salkowski比色液混合后显色反应为深红,产IAA活性为1 000 mg/L,T.gamsii发酵液与Salkowski比色液混合后显示为红色,活性为89.46 µg/mL,T.koningiopsis发酵液的显色反应颜色较浅,活性为6.69 µg/mL,结果表明,两株菌均具有IAA 分泌能力,其中T.gamsii的产IAA能力较强。

表1 两株蒜头果内生木霉的产IAA能力Tab.1 IAA producing ability of two endophytic Trichoderma strains from M.oleifera
2.2.2 蒜头果内生木霉的解钾能力T.gamsii和T.koningiopsis接种于解钾培养基后出现大小不同的透明圈,其中接种T.koningiopsis的透明圈直径为36.22 mm,较接种T.gamsii(直径25.91 mm)的透明圈大。经定量检测,T.koningiopsis和T.gamsii的解钾活性分别为29.26 mg/L 和11.55 mg/L(表2),由此表明两株菌均具有解钾活性,且T.koningiopsis的活性较高。
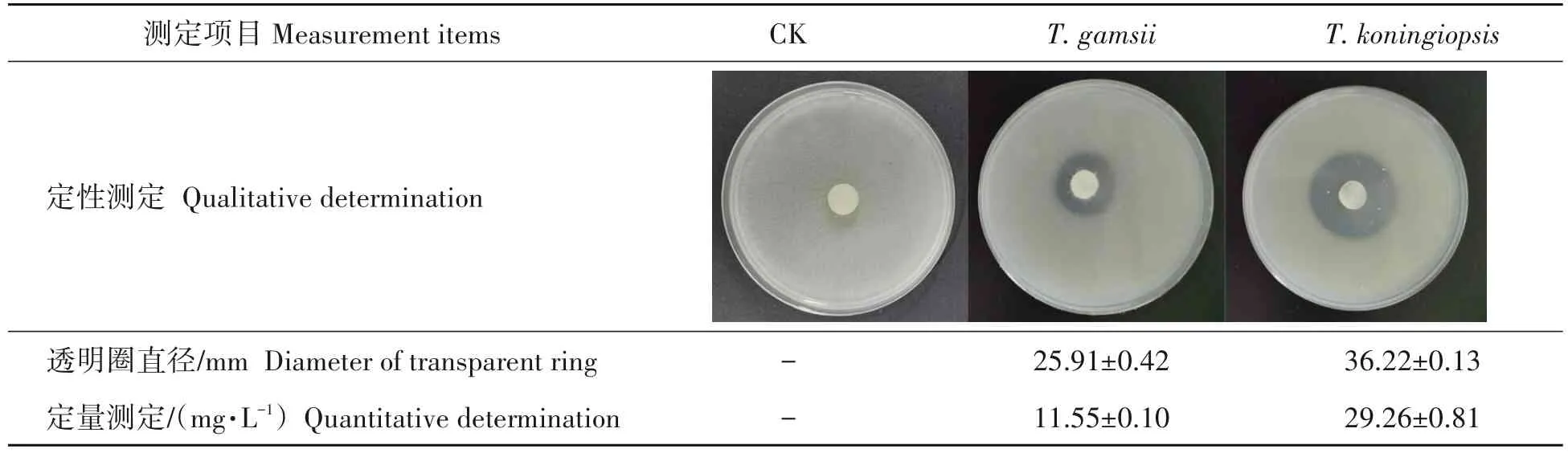
表2 两株蒜头果内生木霉的解钾能力Tab.2 Potassium dissolving ability of two endophytic Trichoderma strains from M.oleifera
2.3 两株蒜头果内生木霉对幼苗的促生作用研究
2.3.1 接种蒜头果内生木霉对其幼苗的生长性状的影响 如图3所示,接种T.gamsii6个月后蒜头果幼苗的株高增量、叶片增量、茎粗和主根长分别为9.7 cm、6.50 片、1.26 cm 和16.20 cm,较对照增加了162.16%、140.74%、44.83%和37.06%,且与接种T.koningiopsis的处理和对照差异显著(P<0.05)。经T.koningiopsis接种处理的幼苗茎粗较对照增加16.09%,且与对照差异显著(P<0.05)。结果表明,接种两株内生木霉均能促进蒜头果幼苗的生长,其中T.gamsii的促生效果较为显著。

图3 接种两株蒜头果内生木霉的幼苗株高增量(A)、叶片增量(B)、茎粗(C)和主根长(D)Fig.3 Height increment(A),leaf increment(B),stem diameter(C)and main root length(D)of M.oleifera seedlings inoculated with two strains of endophytic Trichoderma
2.3.2 接种蒜头果内生木霉对其幼苗吸器数量和最大吸器直径的影响 如图4所示,接种T.gamsii的处理组蒜头果幼苗根部吸器数量最多,为35.60 个,与接种T.koningiopsis的处理组和对照差异显著(P<0.05);接种T.koningiopsis的蒜头果幼苗根部吸器数量为25.70 个,与对照差异显著(P<0.05)。而对照组的蒜头果幼苗根部吸器最大直径为1.58cm,显著高于接种T.gamsii和T.koningiopsis的处理组(P<0.05),两组接菌处理的根部吸器最大直径则无显著差异(P>0.05)。
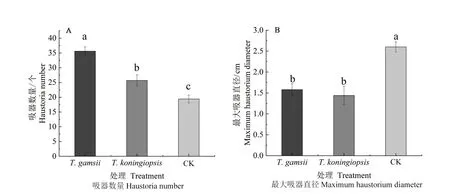
图4 接种两株蒜头果内生木霉的幼苗根部吸器数量及最大吸器直径Fig.4 The number of haustoria and the maximum haustorium diameter in the root of M.oleifera seedlings inoculated with two strains of endophytic Trichoderma
2.3.3 接种蒜头果内生木霉对其幼苗生物量的影响 如表3 所示,接种T.gamsii的地上、地下和全株鲜重以及地上、地下和全株干重分别较对照增加59.71%、33.06%、364.76%、59.47%、33.04%和41.07%,其中地上、全株鲜重以及地上干重与接种T.koningiopsis的处理组和对照差异显著(P<0.05),地下鲜重、地下干重以及全株干重与对照差异显著(P<0.05)。接种T.koningiopsis的处理全株鲜重显著高于对照(P<0.05)。结果表明,接种两株内生木霉均能一定程度促进蒜头果幼苗生物量的提高,其中T.gamsii的促进效果更为显著。

表3 接种两株蒜头果内生木霉对蒜头果幼苗生物量的影响Tab.3 Effect of inoculating two strains of endophytic Trichoderma on the biomass of M.oleifera eedlings
2.3.4 接种蒜头果内生木霉对其幼苗叶绿素含量的影响 接种T.gamsii的蒜头果幼苗叶绿素含量最高,为3.37 mg/g,其次是接种T.koningiopsis的处理,二者分别较对照高出21.66%和7.58%(图5),且均与对照差异显著(P<0.05)。由此表明,接种两种蒜头内生木霉均能促进幼苗叶绿素含量的升高。
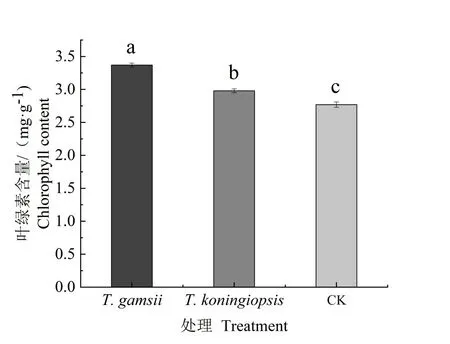
图5 接种两株蒜头果内生木霉的幼苗叶绿素含量Fig.5 The chlorophyll content of M.oleifera seedlings inoculated with two strains of Trichoderma
2.3.5 接种蒜头果内生木霉对其幼苗抗性相关指标的影响 如图6 所示,接种T.gamsii的幼苗POD 和SOD 活性最高,分别较对照高出40.85%和28.19%,其中POD 活性与接种T.koningiopsis的处理和对照差异显著(P<0.05),SOD活性与对照差异显著(P<0.05)。接种T.koningiopsis的处理,其POD 活性较对照高出26.03%且与对照差异显著(P<0.05)。由此表明,接种两种内生木霉能一定程度提高蒜头果幼苗的抗性水平。
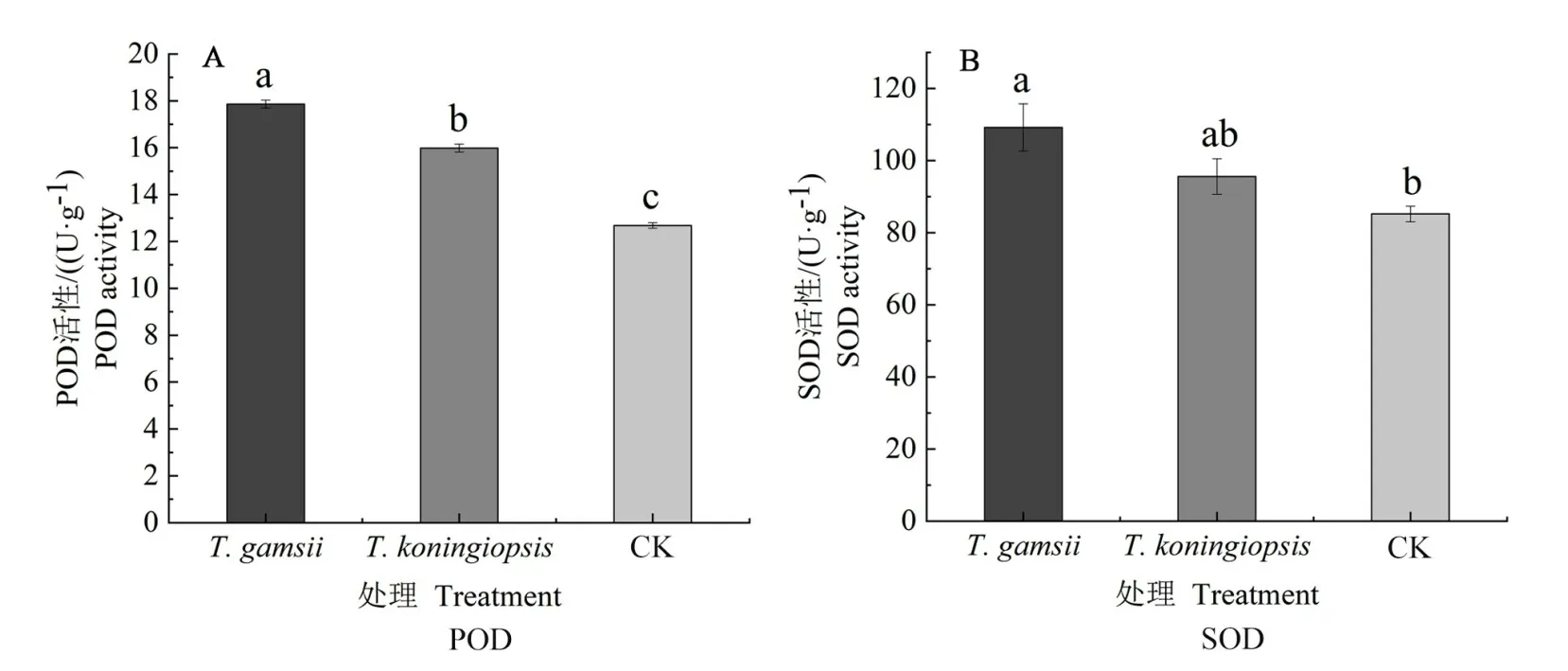
图6 接种两株蒜头果内生木霉的幼苗叶片POD和SOD活性Fig.6 The contents of Pod,SOD activities in leaves of M.oleifera seedlings inoculated with two strains of endophytic Trichoderma
2.3.6 接种蒜头果内生木霉对幼苗根部定殖率的影响 如图7所示,其中T.gamsii在蒜头果幼苗根系的定殖率为58.87%,T.koningiopsis的定殖率为52.16%,表明两种木霉对蒜头果幼苗根系有较好的定殖能力。
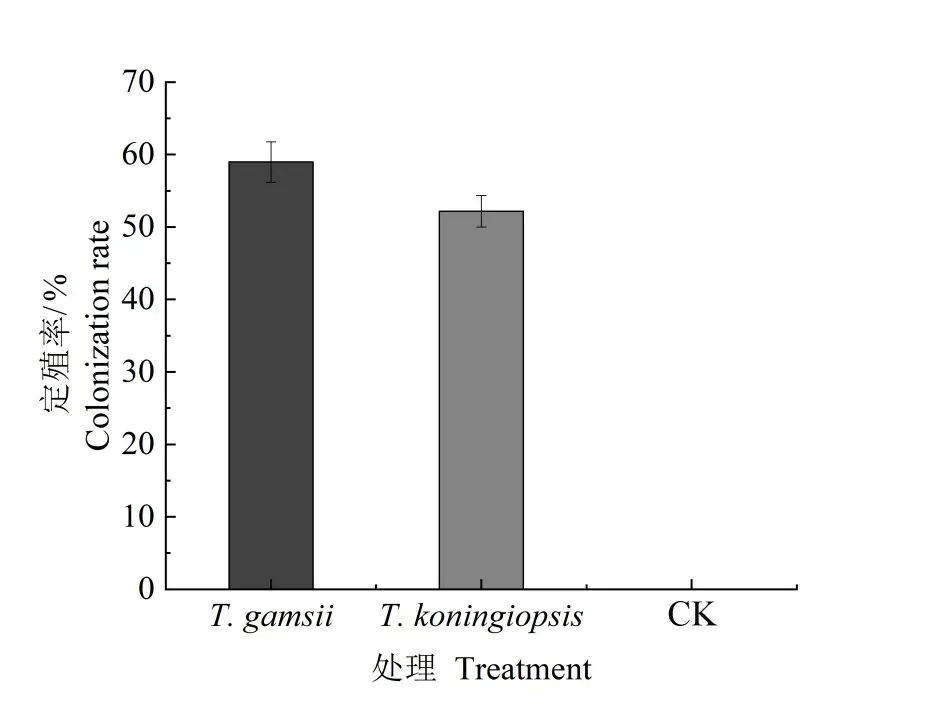
图7 两株蒜头果内生木霉接种幼苗后在其根系的定殖率Fig.7 The colonization rate of two strains of endophytic Trichoderma in M.oleifera root
2.3.7 接种幼苗不同测定指标的相关性分析 经不同处理的蒜头果幼苗各项测定指标的相关性分析(表4),茎粗、吸器数量、全株鲜重、叶绿素含量和叶片PDA活性除与最大吸器直径呈显著或极显著负相关外,与其余指标均呈显著或极显著正相关。株高增量、叶片SOD含量除与主根长、最大吸器直径和全株干重无显著相关性外,与其余指标均呈显著或极显著相关。叶片增量除与最大吸器直径、全株干重外,与其余指标显著或极显著正相关。由此表明,不同接种处理的蒜头果幼苗生长性状、生物量、叶绿素或抗性相关生理指标间密切相关。
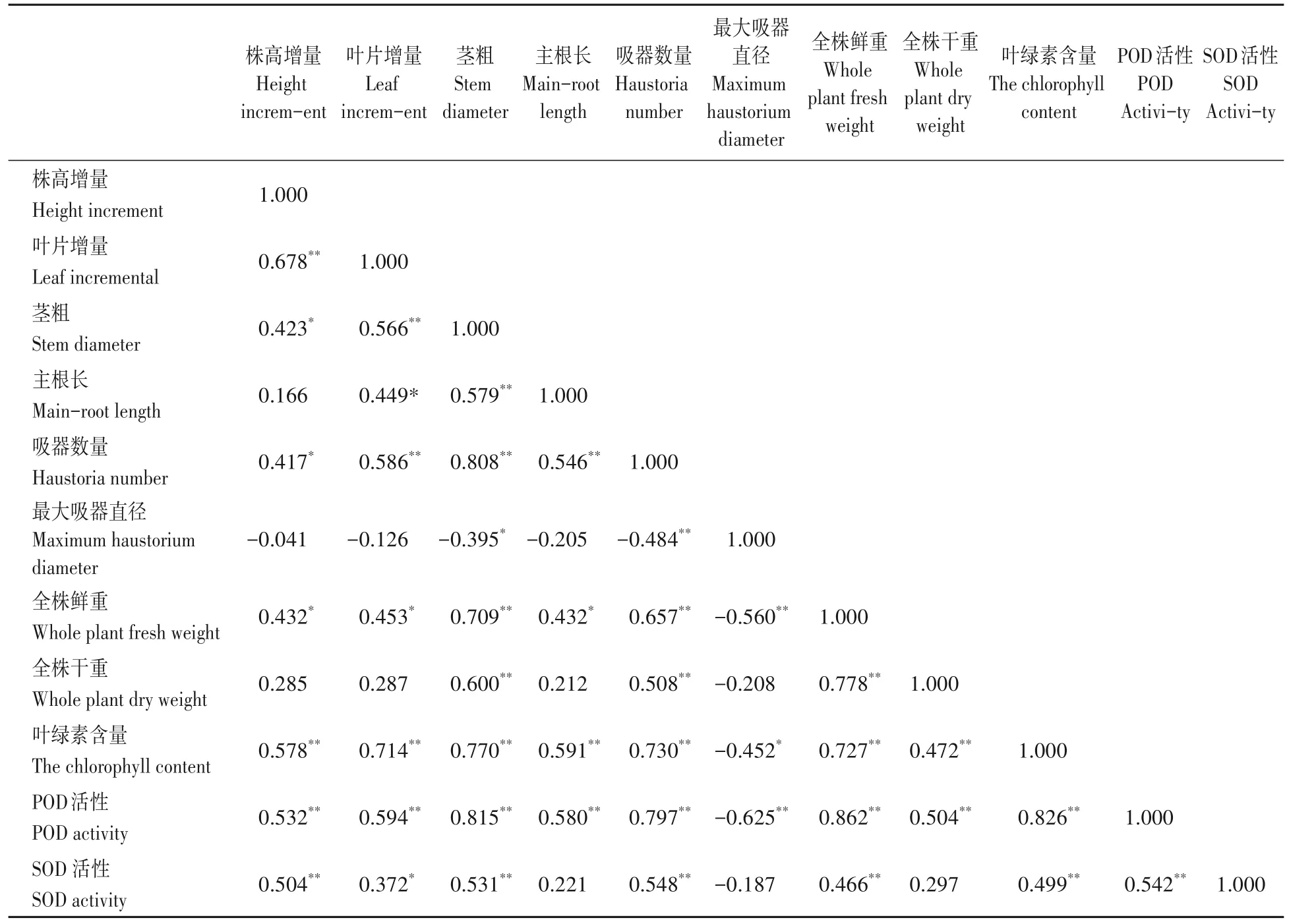
表4 蒜头果幼苗各指标相关性分析Tab.4 Correlation analysis of various indexes of M.oleifera seedlings
3 讨论
本研究中,通过ITS、RPB2和TEF 三片段联合构建系统发育树表明,SF151 和SF231 分别与T.gamsii和T.koningiopsis的已知序列位于同一分支,且贝叶斯和最大似然的后验概率较高;同时,两株菌的菌落和微观结构与T.gamsii和T.koningiopsis有关形态学的描述基本一致[25-26],虽然分生孢子的形态较文献报道略小,但其长宽比较为接近。通过分子系统学分析和形态学比较可鉴定两株内生木霉。
木霉的次生代谢产物中含有多种生长激素类物质,通过植物根系吸收能有效促进寄主的生长发育。相关研究表明,野生型拟南芥幼苗接种T.virens和T.atroviride后能促进其生物量增加及侧根发育。同时检测到T.virens能产生吲哚-3-乙酸、吲哚-3-乙醛和吲哚-3-乙醇3种生长素相关化合物[8]。类似地,You等[27]发现T.koningiopsis也能产生吲哚-3-乙酸。本研究中T.gamsii和T.koningiopsis均具有产IAA 活性,其中T.gamsii产IAA 活性较强,接种蒜头果后二者均能促进幼苗生长及生物量的增加,其中T.gamsii的促生效果尤为显著,由此表明供试木霉产IAA 能力对寄主植物的生长发育有重要影响,下一步还有待对其产IAA活性的促生机制进行研究探讨。此外,Lilliana等[28]研究表明接种木霉能增加豆科植物的叶面K浓度,另有研究表明喷施木霉可提高大豆对钾元素20%的吸收[29]。本研究中T.koningiopsis具有较高的解钾活性,推测对植株钾元素的吸收有积极的促进作用。
一些木霉种类接种寄主植物后能显著提高植株的生长性状和生物量。哈茨木霉T23能有效促进花生分枝、增加结果数、有籽果率及百粒籽重[30];棘孢木霉M45浸种处理的水稻株高、地上干重以及根际土壤总氮含量显著上升[31]。本研究中,T.gamsii和T.koningiopsis接种蒜头果幼苗后对其生长性状及生物量均有提升,其中T.gamsii能显著增加植株的株高、叶片数、茎粗、主根长以及鲜重及干重。这与接种T.gamsii显著促进玉米的生长[32],接种T.koningiopsis明显提高马尾松幼苗的株高、湿重以及根长的研究报道相符[33]。此外,蒜头果为根部半寄生植物,即使没有其他寄主植物,根部也会通过吸器产生自寄生现象[34]。本研究中,接种T.gamsii和T.koningiopsis的蒜头果幼苗根部自吸器数量显著多于对照,而最大自吸器直径则显著小于对照,由此推测自吸器数量多更有利于充分吸收根部的营养物质,这与杨贵钗等的研究报道相符[35]。
叶绿素作为植物生长过程中必不可少的因素之一,不仅可以促进植物的生长,还能提高其抗逆境胁迫能力。本研究中经T.gamsii和T.koningiopsis接种处理的幼苗叶绿素含量显著高于对照,这与之前木霉促进寄主植物叶绿素含量升高的研究报道相一致[36-37]。而且,木霉能诱导寄主植物的系统抗性,SOD酶通过催化超氧自由基歧化成O2和H2O2,有效抵抗有害物质对植物的伤害[38]。POD 酶除参与植物氧自由基的清除,还与软木脂及木质素的合成相关[39]。本研究中,T.gamsii和T.koningiopsis接种处理能显著提高蒜头果幼苗叶片的POD 及SOD 活性,这与接种深绿木霉和长枝木霉后显著提高寄主植物抗氧化酶活性的结论相符[15,40]。
此外,研究表明木霉菌具有较强的定殖能力,能有效利用根系里复杂的碳水化合物加快其在根系表面的生长,同时溶解可溶性或微溶性物质,通过螯合或降解作用溶解根系里的金属氧化物,增加根系对矿质元素的吸收[41]。这与本研究中T.gamsii和T.koningiopsis在蒜头果幼苗根部的定殖率较高且明显促进植株生长的结果相一致。相关性分析表明,幼苗的生长形状、生物量与抗氧化酶活性等指标多呈显著正相关,由此表明,植物作为协调统一的有机体,各项指标间相互促进、互为影响,综合反映植株的品质与健康状况。
4 结论
本研究结合分子系统学和形态学鉴定了两株蒜头果内生木霉分别为T.gamsii和T.koningiopsis,同时确定了二者均具有产IAA 能力和解钾活性。接种试验表明两株菌对蒜头果幼苗生长、生物量增加、叶绿素含量提升及抗氧化酶活性增强有积极的促进作用,其中T.gamsii的促生效果更为显著,为蒜头果理想的促生菌。
