拮抗炭疽病的茶树内生菌筛选、鉴定及培养条件优化
2023-05-08郑世仲周子维陈晓慧蔡烈伟江胜滔刘盛荣
郑世仲,周子维,陈晓慧,蔡烈伟,江胜滔,刘盛荣
拮抗炭疽病的茶树内生菌筛选、鉴定及培养条件优化
郑世仲,周子维,陈晓慧,蔡烈伟,江胜滔,刘盛荣*
宁德师范学院生命科学学院,福建 宁德 352100
为筛选高效拮抗茶树炭疽病的内生细菌,以茶树健康叶片为材料,采用平板对峙拮抗法进行筛选,并对筛选到的菌株进行鉴定、抑菌效果评价及培养条件优化。从分离的162株内生细菌中筛选到1株对茶树胶孢炭疽菌有较好抑制效果的拮抗细菌X13。形态学、生理生化鉴定及16 S rDNA系统进化发育分析显示,分离的菌株X13为枯草芽孢杆菌()。菌株X13对病原菌菌丝生长抑制率为61.6%。生长曲线表明,菌株X13对数生长期为接种后2~14 h。响应面优化的培养条件为4.0%(质量百分浓度)玉米粉,1.0%(质量百分浓度)的硝酸钠,接种量3.5%(体积分数)。本研究结果可为茶树炭疽病防治及生防菌剂的开发提供重要参考。
茶树;炭疽病;内生细菌;枯草芽孢杆菌;培养条件
茶树()属山茶科山茶属的常绿双子叶木本植物,是我国重要的经济作物。炭疽病是茶树叶部的主要病害之一[1-2],且在福建省等湿热地区最容易发生和流行。茶炭疽菌病(Miyake)是由茶刺盘孢等炭疽菌属真菌引起的。茶炭疽菌属半知菌亚门、黑盘孢目、盘长孢属,胶孢炭疽菌()为茶树常见的一种炭疽病病原菌[3-4]。茶炭疽菌主要为害茶树叶片,从叶尖或叶缘开始发病,开始呈水渍状浅绿色,逐渐增大,形成形状不规则的大病斑,中后期引起大量叶片脱落,影响茶树生长,造成茶叶产量和质量下降,给茶园造成巨大的经济损失,危害茶产业发展[5-7]。
植物病虫害的防治主要有物理、化学和生物防治3种方法,但化学防治会引起环境污染和农残等问题。微生物制剂等生物防治法具有对人畜无毒、不污染环境和持效性长等优点,已受到广泛重视和开发利用,大量研究表明,利用拮抗微生物制备生防菌剂防治茶树等植物病害具有很大潜力[6,8-10]。
拮抗微生物主要通过土壤或植物体进行分离筛选,土壤筛选的拮抗菌多为产抗生素的放线菌[11-12]。内生细菌是植物内生菌群的重要组成,通过不同方式长期定殖寄生在植物体内,与寄主长期协同进化,促进植物生长,同时对抵御病害又起重要作用,因此,植物内生菌成为开发微生物农药防治植物病害的重要途径。植物内生菌的抑菌机理主要表现为合成水解酶、抗生素和植物生长调节剂等次生代谢物质,杀死或抑制病原菌生长,增强植物体自身抵抗力,或诱导植物免疫应答等途径来抑制病原菌生长,降低病原菌的侵染效率和致病性,而内生菌自身又对寄主植物生长没有危害甚至有生长调节作用[13]。植物内生细菌在茶树、油茶和花卉果树等植物生长过程的生理作用和病害防治中的作用已经被逐步发掘[14-16]。
茶树炭疽病病征主要表现在成叶,其危害在很多茶区没有引起足够重视,但茶树炭疽病的发生,不但影响茶树生长,甚至可能诱导茶树次生代谢物质发生变化,结果影响茶叶产量与品质。目前,国内外对茶树炭疽病开展了广泛研究,但主要针对炭疽病病原,而病害的生物防治研究较少。本研究以茶树分离到的胶孢炭疽菌为病原指标菌,从茶树叶片分离筛选对茶炭疽病病原菌具有较强拮抗作用的内生细菌,并对分离到的拮抗菌进行鉴定和抑菌效果评价,优化培养条件,为开发茶树炭疽病生防菌剂提供依据。
1 材料与方法
1.1 试验材料
供试炭疽病病原菌胶孢炭疽菌,为发生炭疽病病害的茶树叶片分离得到,保存于闽东特色生物资源福建省高校工程研究中心微生物研究室;健康茶树叶片从茶树种植基地(福建宁德)采集,作为内生细菌分离材料;基础液体培养基,其组成按质量分数为葡萄糖1.5%,蛋白胨1.0%,酵母膏0.5%,KH2PO40.15%,K2HPO40.1%,MgSO4·7H2O 0.05%,MnSO4·H2O 0.01%,FeSO4·7H2O 0.01%,CaCl20.15%配制,调pH值至7.0。
1.2 试验方法
1.2.1 菌株分离
取茶树成熟的健康叶片5.0 g,用70%乙醇溶液漂洗2~3次,10%的NaClO浸泡5 min,无菌水漂洗4~5次,晾干,50 mL无菌水研磨。研磨液稀释至10-4倍,吸取0.1 mL稀释液至牛肉膏蛋白胨培养基平板,涂布,37 ℃倒置培养,长出菌落后根据菌落形态特征挑取单菌落,进一步划线纯化、保种。
1.2.2 拮抗菌筛选
初筛,采用平板对峙培养法。PDA平板中心位置接种茶树胶孢炭疽菌菌饼(直径7.0 mm),周围10.0 mm等距离接种分离的细菌,以仅接种茶树胶孢炭疽菌菌饼为对照,25 ℃恒温箱培养。对照长至培养皿近边缘时,测量菌落直径,计算抑制率。抑制率=(对照炭疽菌菌落直径-处理直径)/对照炭疽菌菌落直径×100%。
复筛,采用琼脂扩散法。胶孢炭疽菌在PDA平板25 ℃培养5 d,无菌水洗涤,制备1×105CFU·mL-1孢子悬液,取100 μL孢子悬浮液涂布PDA平板,每平板上放置3个牛津杯,加入150 μL初筛菌株发酵滤液,以无菌水为对照,培养4 d,观察抑菌情况和测量抑菌圈大小。
1.2.3 拮抗菌的鉴定
形态学与生理生化鉴定,参照《伯杰氏细菌鉴定手册》[17]。显微镜观察形态,测试硝酸盐还原、吲哚试验、葡萄糖发酵等生理生化特性,对筛选的拮抗细菌进行初步鉴定。
16 S rDNA序列鉴定。EasyPure Genomic DNA Kit(全式金生物科技公司)基因组提取试剂盒提取细菌基因组DNA,微量核酸检测仪(Thermo Scientific)检测DNA浓度和纯度;引物27F/1492R(27F:5′-AGAGTTTGATCC TGGCTCAG-3′,1492R:5′-GGTTACCTTGT TACGACTT-3′)扩增16 S rDNA序列,PCR反应体系25 μL,扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸10 min。EasyPure® Quick Gel Extraction Kit(全式金生物科技公司)胶回收试剂盒纯化回收后克隆,阳性克隆子送华大基因测序。
测序结果进行NCBI-BLAST同源性序列比对分析,并从中下载相似度较高的序列,用MEGA 7.0软件(Neighbor-Joining,NJ邻位相连法)构建分子系统遗传进化树。
1.2.4 种子液制备
将活化后的分离菌株X13刮取1环接入50 mL灭菌的营养肉汤(250 mL三角瓶),37 ℃摇床200 r min-1培养20 h,即为液体种子液。
1.2.5 生长曲线测定
种子液按3.0%(体积分数)接种量接入装有50 mL基础培养基的250 mL三角瓶,摇床培养条件200 r·min-1和37 ℃,每2 h取培养液。以灭菌后的基础培养基为空白对照,分光光度计测定OD600值,3个平行培养作为重复。
1.2.6 响应面优化试验设计
(1)单因素试验:碳源筛选,供试碳源为可溶性淀粉、大豆粕、麸皮、甘露醇、蔗糖和玉米粉,按2.0%(质量百分浓度)添加量代替基础培养基中的葡萄糖,3.0%(体积分数)接种量接入X13种子液。发酵培养试验的装液量为250 mL三角瓶装50 mL培养基,37 ℃、200 r·min-1摇床培养,14 h后测试发酵液OD600值,筛选出最适碳源。设置最佳碳源浓度范围为1.0%~5.0%,采用相同方法确定适宜的浓度。每次试验3个独立的平行培养作为重复。
氮源筛选,大豆粕、硫酸铵、硝酸钠、尿素作为氮源,添加量2.0%(质量百分浓度),代替基础培养基中的蛋白胨,其他条件同上,确定最适氮源及合适浓度。
接种量确定,以最适碳源、氮源及浓度配制培养基,按2.0%、3.0%、4.0%、5%和6.0%(体积分数)接种量接种,其他条件同上,确定合适的接种量。
(2)Box-Behnken试验:单因素试验基础上,Box-Behnken试验设计进行响应面优化,试验设计采用Design-Expert 8.0软件。玉米粉浓度(A)、硝酸钠浓度(B)和接种量(C)3个因素为自变量,菌体生长量OD600值为响应值进行3因素3水平的Box-Behnken试验设计。试验因素及水平见表1。
以OD600值试验结果进行多元二次回归分析,建立自变量与响应值之间定量关系的数学模型,值检验评价模型的可靠性,相关系数(2)作为模型拟合程度的指标,值小于0.05视为变量显著。
1.2.7 数据处理
数据以平均值±标准差或平均值(Box-Behnken试验)的形式表示。采用Excel 2007和Design-Expert 8.0进行绘图及统计分析。
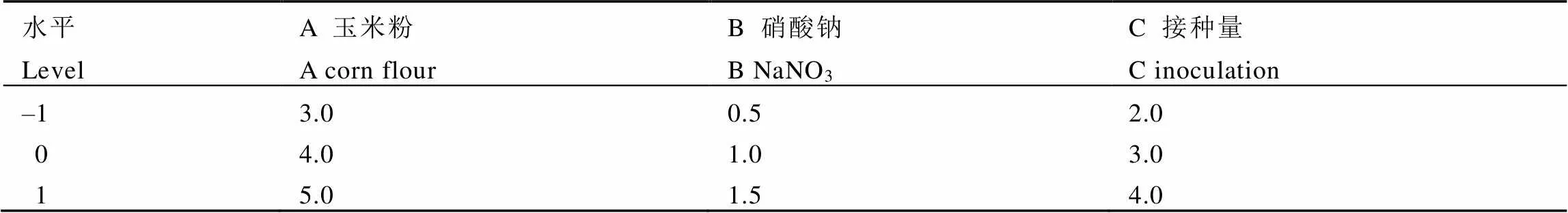
表1 Box-Behnken试验因素及水平
2 结果与分析
2.1 拮抗细菌筛选
从茶树叶片共分离到162株具有不同形态的茶树内生细菌菌株,并进一步初筛、复筛。其中,菌株X13对茶树炭疽病病原菌抑制率和抑菌圈直径最大,抑制率达到61.6%,抑菌圈直径17.9 mm。因此,选择X13菌株用于后续试验。图1为菌株X13与茶树炭疽病病原菌的拮抗作用图。
2.2 菌株X13的鉴定
2.2.1 形态学与生理生化鉴定
菌株X13菌落圆形,呈乳脂色,不透明,前期表面较光滑,后期有明显褶皱,边缘不整齐;革兰氏染色阳性,菌体杆状,有芽孢,无荚膜,周生鞭毛;好氧生长,能利用葡萄糖、甘露醇和木糖发酵产酸,可水解明胶,能利用柠檬酸盐,能分解色氨酸形成吲哚,硝酸盐反应和V-P检测阳性。参照《伯杰氏细菌鉴定手册》,初步确定X13菌株为芽孢杆菌属。
2.2.2 16 S rDNA鉴定
菌株X13的16 S rDNA序列长度1 449 bp,序列已提交保存于GenBank,NCBI登录号OP420513.1。基于16 S rDNA序列构建的系统遗传进化树见图2。由图2可知,X13菌株和枯草芽孢杆菌()YL1在进化树的同一分支,且根据NCBI数据库比对结果,X13菌株与YL1的16 S rDNA序列相似度为99.72%,因此,结合形态学与生理生化鉴定结果,确定分离的菌株X13为枯草芽孢杆菌。

注:A为试验组,B为对照组

图2 枯草芽孢杆菌X13系统进化树
2.3 菌株X13的生长曲线
菌株X13在基础培养基的生长曲线如图3所示,菌株的延滞期为2 h,2~14 h为对数生长期,14~24 h处于稳定期,24 h后开始进入衰亡期。说明菌株X13生长速度快,生长旺盛,对营养要求不严格,易培养。发酵接种时,种子液以培养10~14 h为宜,此时活性高、繁殖能力强,且活菌数高。
2.4 单因素试验结果
2.4.1 不同碳源和氮源对菌株X13生长的影响
如图4所示,在供试的6种碳源中,以玉米粉作为碳源时稳定期的菌体生长量最大(图4A);随玉米粉添加量不断增加,菌体生长量呈先增加后降低的趋势;添加量为4.0%时,菌株X13生长量最高(图4B)。因此,玉米粉为X13菌株的最适碳源,添加量为4.0%。

图3 菌株X13生长曲线
由图4C和图4D可以看出,硝酸钠(NaNO3)作为氮源时,稳定期X13菌株生长量最高。不同NaNO3添加量对X13菌株生长有明显的影响,菌体生长量随NaNO3添加量的增加呈先增加后降低的趋势,NaNO3添加量为1.0%时,X13菌株生长量达到最大值。因此,NaNO3为最适氮源,添加量为1.0%。
2.4.2 不同接种量对枯草芽孢杆菌X13菌株生长影响
由图5可知,接种量对X13菌株生长有一定的影响,接种量为3.0%时,X13菌株生长量达到最大值,进一步增加接种量,生长量呈现降低趋势,因此,最佳接种量为3.0%。
2.5 响应面优化
2.5.1 Box-Behnken试验结果及回归模型建立
Box-Behnken试验共有17组试验组合,试验结果见表2。以OD600为响应值(),利用Design-Expert 8.0软件对获得的数据进行多变量回归拟合,建立的回归方程为:=-14.7+4.47+8.53+3.21-0.22+0.15-0.47-0.592-3.232-0.502
模型回归方程的方差分析结果见表3,模型的F值为26.45,Prob>F值<0.01,表明模型极显著,可用于分析和预测不同培养条件下的菌体生长,失拟项值为0.188 6,不显著,表明模型与纯误差无关,模型可靠。模型的相关系数2=0.971 4,表明回归方程拟合度高,响应值的97.14%可由模型变量解释。
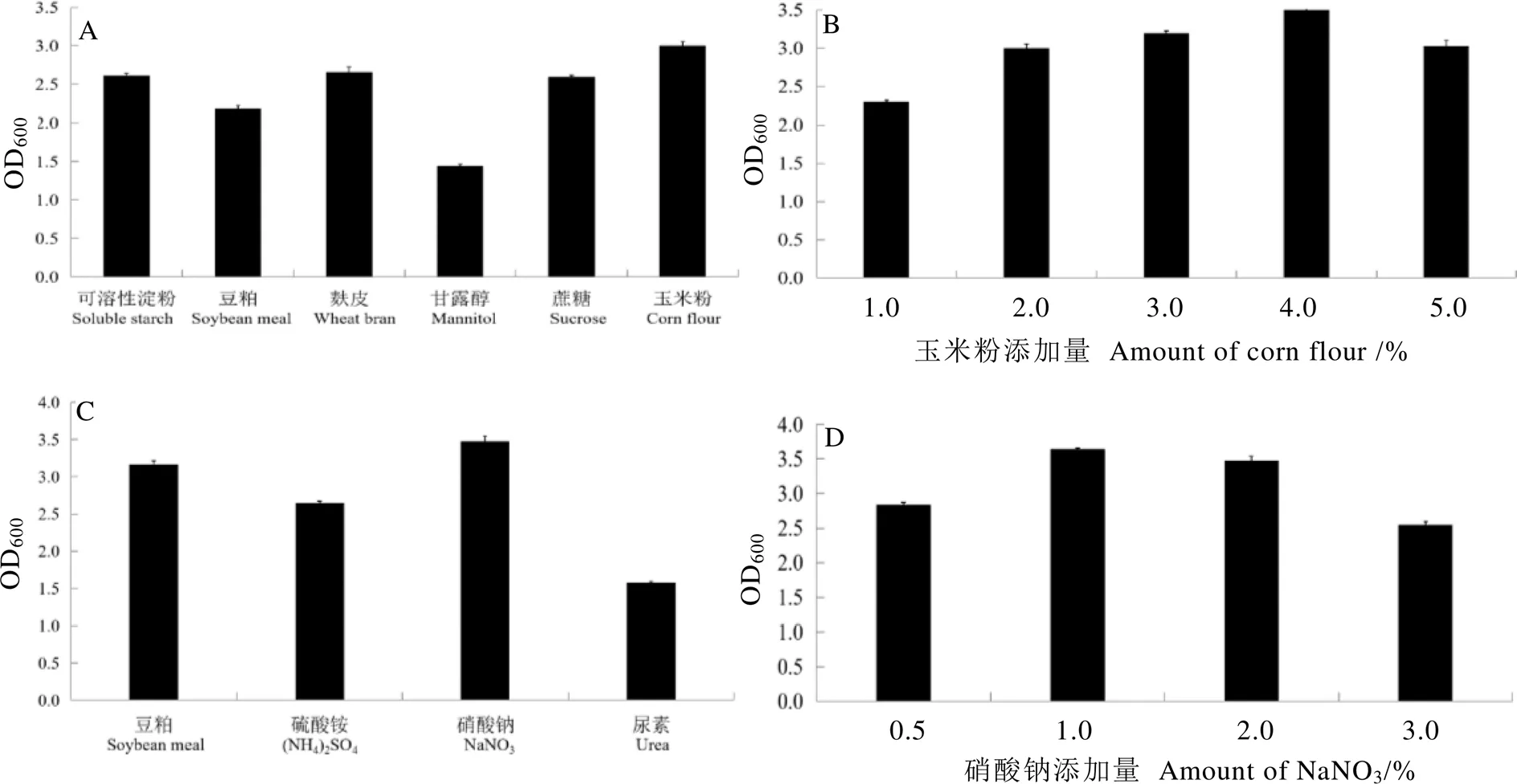
注:A,碳源;B,玉米粉添加量;C,氮源;D,硝酸钠添加量
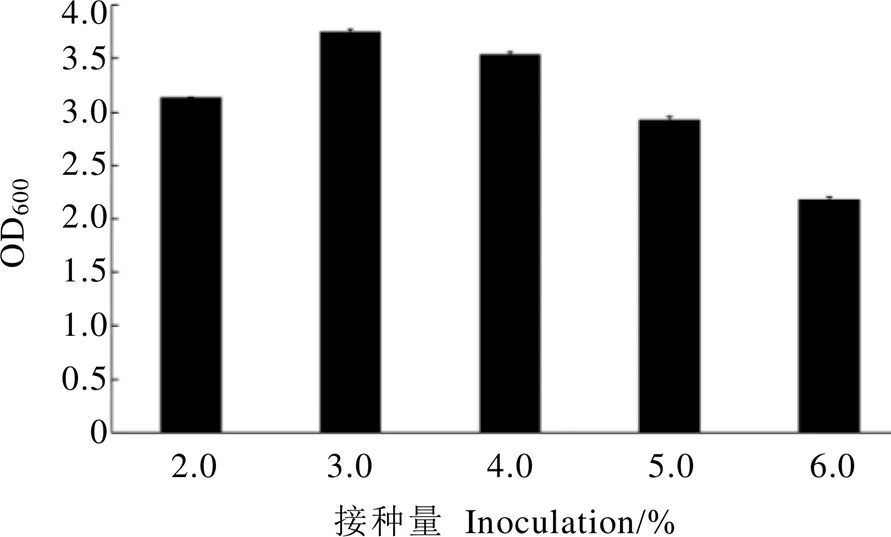
图5 接种量对枯草芽孢杆菌X13菌株生长影响
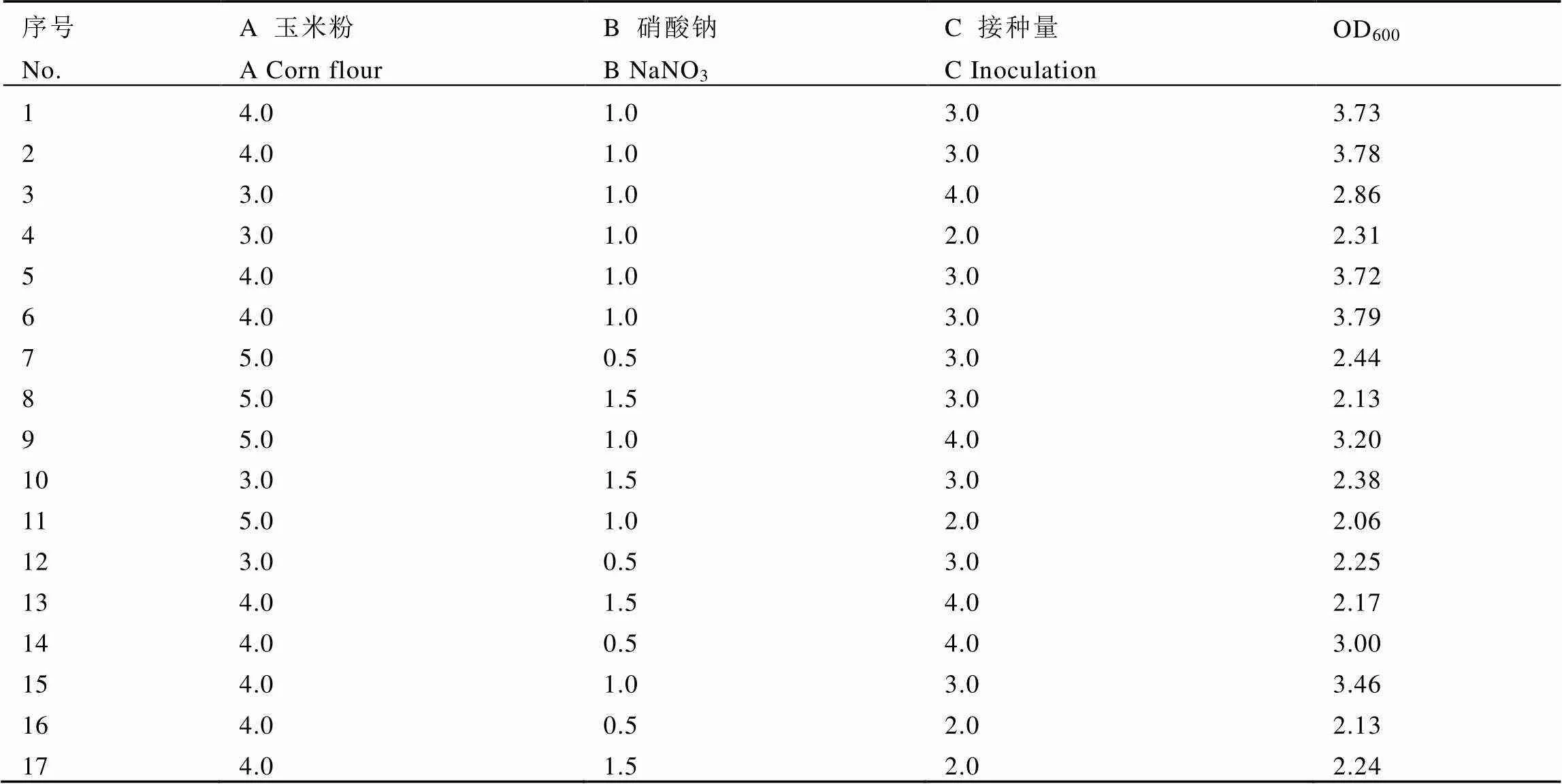
表2 Box-Behnken试验设计及结果
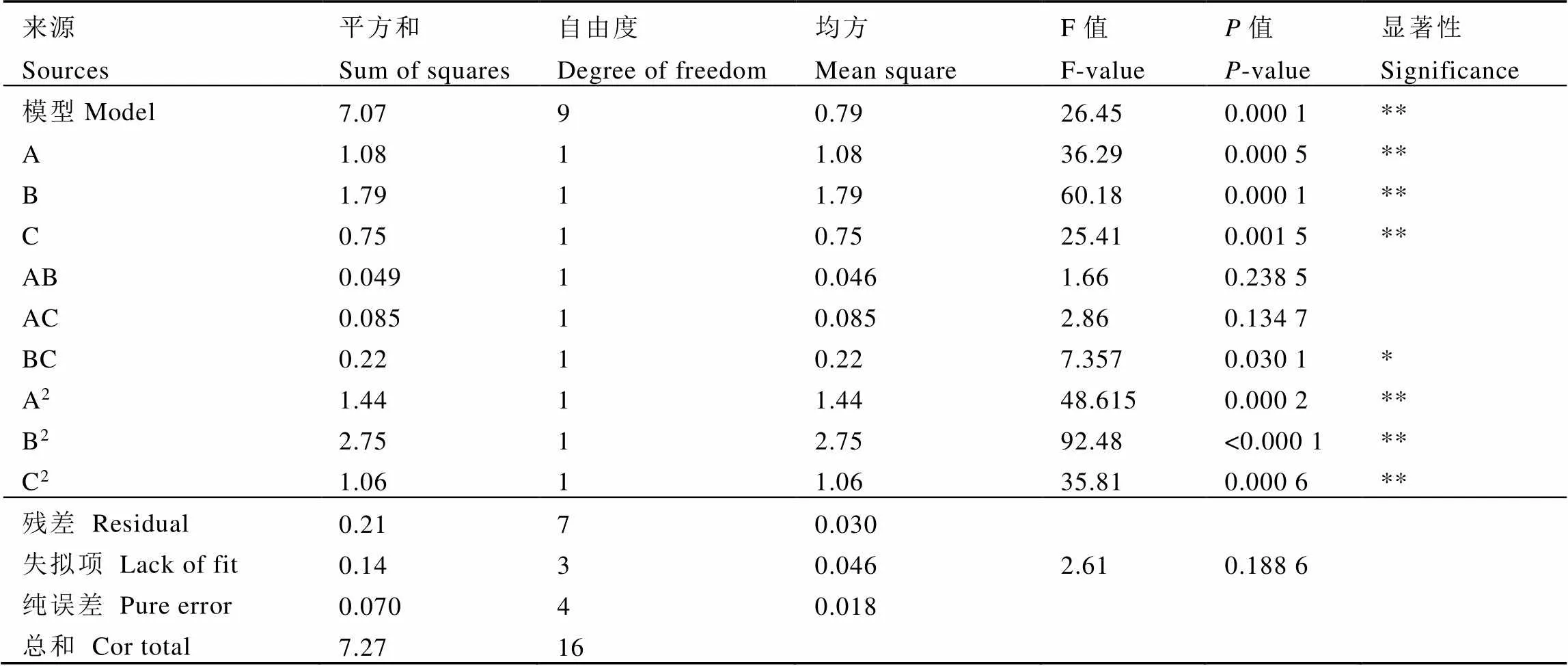
表3 回归模型的方差分析
注:**表示差异极显著(<0.01);*表示差异显著(<0.05)
Note: ** means highly significant difference (<0.01). * means significant difference (<0.05)
自变量A、B和C 3个因素对OD600值有极显著影响(<0.001),交互项BC的影响为显著(<0.05),平方项A2、B2和C2对结果有极显著影响(<0.001)。各因素对菌体生长影响大小为B(NaNO3添加量)>A(玉米粉添加量)>C(接种量)。
2.5.2 因素交互作用分析
回归模型的响应面曲面图和等高线图如图6所示。由图6A和图6B可以看出,接种量为3.0%时,OD600值随玉米粉添加量增加呈现先增加后下降趋势,硝酸钠添加量对菌体生长的影响同玉米粉相近,因此,两个因素均在0水平附近有最大的菌体生长量。两者间的等高线图呈圆型,表明两者间无显著的相互作用。
图6C和图6D为玉米粉与接种量对菌体生长影响的响应面和等高线图,可以看出,变量NaNO3添加量固定为1.0%,OD600值随接种量的增加呈现先增加后下降趋势,接种量为3.0%时达到最大;玉米粉添加量约4.0%时菌体生长达到最大,低于或高于该水平时,生长量下降。等高线图显示两因素间无显著相互作用。
接种量和NaNO3添加量对菌体生长的影响见图6E和图6F,自变量玉米粉浓度固定为4.0%。接种量增加可提高菌体生长量,高于3.3%开始下降;OD600值随NaNO3的添加量增加先增加而后减小。等高线图呈椭圆型,表明两者间有显著的相互作用。
软件优化的各因素最佳组合为玉米粉添加量4.06%,硝酸钠添加量0.94%,接种量3.35%,模型预测的OD600最大值为3.76。
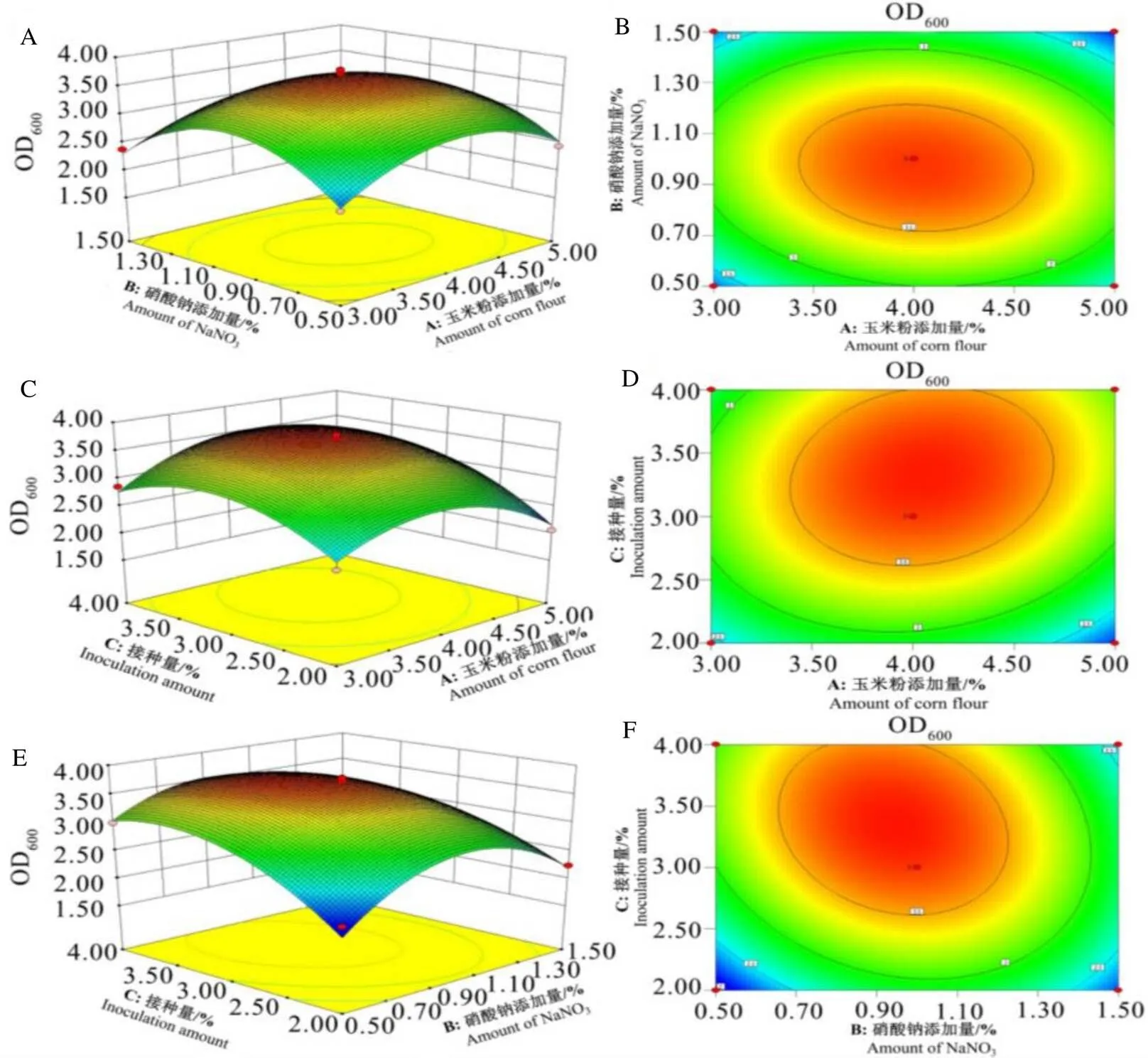
注:A和B分别表示玉米粉添加量与硝酸钠添加量交互作用的曲面图和等高线图;C、D分别表示玉米粉添加量与接种量交互作用的曲面图和等高线图;E、F分别表示硝酸钠添加量与接种量交互作用的曲面图和等高线图
2.6 回归模型的试验验证
为检验模型的可靠性,进行验证试验。考虑操作的方便性,将响应面优化的条件略作改进,即玉米粉添加量4.0%,硝酸钠添加量1.0%,接种量3.5%,3个重复。验证试验的OD600平均值为3.78,与模型的预测值3.76非常接近,证实所建立的模型可靠,可准确预测不同条件下菌株X13的生长。
3 讨论
植物发生的病害种类很多,引起的原因并不相同。迄今为止,使用化学合成农药仍是防治植物病害的主要措施,但伴随引起的农残超标和环境污染问题日益凸显。目前,安全高效的生物防治植物病害已经引起广泛重视,已开发出多种生物防治菌剂。已有报道表明,生防菌主要从土壤或植物根际进行分离筛选,大多数属放线菌和真菌,但土壤来源的微生物很难在植物体或植物表面对习居微生物获得竞争优势,从而影响防治效果,限制了生防菌剂的推广应用[18-19]。值得指出的是,由于细菌繁殖速度快,易人工培养,且营养要求低,生产成本低,因此,植物内生细菌可作为防治植物病害的重要天然资源,具有潜在研究价值和开发前景。
植物内生细菌分布于植物的不同组织,在长期的进化过程中已适应宿主植物体的体内生态环境,也能促进植物的生长,作为外源菌剂喷施于宿主植物,能快速适应宿主环境,易于植物附生和独立寄生繁殖,占据有利生态位,容易直接对病原菌发起攻击,分泌拮抗物质抑制或杀死病原菌,发挥生防作用,而植物自身的遗传特性和生长均不会受到影响[20-22]。已有的研究表明,利用茶树内生细菌开发的生防菌剂能最大程度发挥菌剂的生防作用,不仅能够高效抑制病原菌对茶树的病害,还可提高茶树的抗逆性,促进茶树生长[23-24]。
植物内生细菌种类繁多,其中芽孢杆菌属能产芽孢,对外界有害因子抵抗力强,是生防菌的重要来源,能通过分泌抗菌物质或者诱发植物自身的抗病潜能从而增加植物抗病性[25-26]。本研究从健康叶片中分离到1株对茶树胶孢炭疽菌有较强拮抗作用的茶树内生细菌X13,经形态学、生理生化及16 S rDNA系统进化发育分析显示分离的菌株X13为枯草芽孢杆菌。
本研究所分离到的菌株X13生长繁殖速度快,营养要求低,易培养。采用单因素试验和响应面试验对枯草芽孢杆菌X13的培养条件进行优化,优化后的培养条件为玉米粉添加量4.0%、硝酸钠添加量1.0%、接种量3.5%,该工艺发酵成本较低;从平板拮抗试验可知,菌株X13对茶树炭疽病病原菌抑制率达到61.6%,与陈百文等[27]及代亚锋等[28]分离得到的一些拮抗菌相比,具有更高的抑制率,且发酵粗提液也具有较好的抑菌作用。因此,菌株X13具有大规模开发为低成本生防菌剂的潜力,可用于茶树炭疽病的安全高效防治。
拮抗菌的生防机制主要表现为与病原菌竞争营养以及生长空间,或合成胞外水解酶以及一些抑菌的次生代谢产物。本研究主要开展了拮抗炭疽病的茶树内生细菌分离、鉴定及培养条件优化研究,已有的研究表明,产生各种水解酶是芽孢杆菌起抑菌作用的一种重要方式[29-30],菌株X13也属芽孢杆菌,是否与其他芽孢杆菌有相同抑菌机理有待进一步研究,包括真菌细胞壁水解酶产生、抑菌成分分离鉴定及对病原菌的菌丝和孢子生长的影响,以及与宿主茶树之间的互作关系。
[1] 张永乐. 山东省茶树主要叶部病害病原鉴定及生物学特性研究[D]. 泰安: 山东农业大学, 2018. Zhang Y L. Identificantion and biological characteristics of tea leaf diseases in Shandong province [D]. Tai'an: Shandong Agricultural University, 2018.
[2] 张瑾, 邢玉娴, 韩涛, 等. 茶树诱导抗虫性的研究进展[J]. 昆虫学报, 2022, 65(3): 399-408. Zhang J, Xing Y X, Han T, et al. Research progress of induced defense against insect pests in tea plant (s) [J]. Acta Entomologica Sinica, 2022, 65(3): 399-408.
[3] Guo M, Pan Y M, Dai Y L, et al. First report of brown blight disease caused byonin Anhui Province, China [J]. Plant Disease, 2014, 98(2): 284.doi: 10.1094/PDIS-08-13-0896-PDN.
[4] 刘威, 袁丁, 尹鹏, 等. 茶树炭疽病的研究进展[J]. 热带农业科学, 2016, 36(11): 20-26.Liu W, Yuan D, Yin P, et al. Research progress on anthracnose of tea plant [J]. Chinese Journal of Tropical Agriculture, 2016, 36(11): 20-26.
[5] 贡长怡, 刘姣姣, 邓强, 等. 茶树炭疽病病原菌鉴定及其致病性分析[J]. 园艺学报, 2022, 49(5): 1092-1101. Gong C Y,Liu J J,Deng Q, et al. Identification and pathogenicity ofspecies causing anthracnose on[J]. Acta Horticulturae Sinica, 2022, 49(5): 1092-1101.
[6] 刘荣, 姚玉仙, 周爽爽, 等. 茶炭疽病的症状识别与防治研究[J]. 福建茶叶, 2022, 44(2): 24-26. Liu R, Yao Y X, Zhou S S, et al. Identification and control ofMiyake [J]. Tea in Fujian, 2022, 44(2): 24-26.
[7] 刘守安, 韩宝瑜, 付建玉, 等. 茶炭疽病菌毒素的致病活性及理化性质初探[J]. 茶叶科学, 2007, 27(2): 153-158.Liu S A, Han B Y, Fu J Y, et al. Preliminary studies on pathogenic activity and physical and chemical characteristics of toxins from[J]. Journal of Tea Science, 2007, 27(2): 153-158.
[8] 陈雪芬. 我国茶树病害的发生趋势与绿色防控[J]. 中国茶叶, 2022, 44(6): 7-14.Chen X F. The occurrence trend and green control of tea diseases in China [J]. China Tea, 2022, 44(6): 7-14.
[9] 朱咏珊, 罗晓欣, 梁浩然, 等. 一株茶树根际细菌的鉴定与生防效果研究[J]. 茶叶科学, 2022, 42(1): 87-100.Zhu Y S, Luo X X, Liang H R, et al. Identification of a tea rhizosphere bacterium and its biocontrol of tea anthracnose disease [J]. Journal of Tea Science, 2022, 42(1): 87-100.
[10] Thakur R. Use ofspp. as biocontrol for disease management [J]. Indian Farmer, 2021, 8(1): 108-115.
[11] 李聪. 放线菌TR19040的次级代谢产物及其生物活性研究[D]. 兰州: 兰州交通大学, 2021. Li C. Secondary metabolites of actinomycete TR19040 and its biological activity [D]. Lanzhou: Lanzhou Jiaotong University, 2021.
[12] Christopher Y, Aguilar C, Gálvez D, et al. Interactions among, antagonistic microfungi associated with the fungus-growing antsymbiosis [J]. Journal of Fungi, 2021, 7(12): 1007. doi: 10.3390/jof7121007.
[13] Strobel G. Harnessing endophytes for industrial microbiology [J]. Current Opinion in Microbiology, 2006, 9(3): 240-244.
[14] 尚笑男, 刘君昂, 冯福山, 等. 油茶内生拮抗细菌的筛选、鉴定及防效[J]. 中国生物防治学报, 2021, 37(3): 575-583. Shang X N, Liu J A, Feng F S, et al. Screening, identification and antagonistic effect of endophytic antagonistic bacterial strains from[J]. Chinese Journal of Biological Control, 2021, 37(3): 575-583.
[15] Deka B, Babu A, Peter A, et al.: as a potential microbial biocontrol agent for tea mosquito bug,waterhouse (Hemiptera: Miridae) in Dooars and Darjeeling, India [J]. Egyptian Journal of Biological Pest Control, 2021, 31(1): 134. doi: 10.1186/s41938-021-00478-3.
[16] Alviz M L, Pérez G A, Pérez-Cordero A. Inhibitory effect of compound type metabolites of endophytes bacteria againstBurkholderia glumae [J]. Revista Colombiana de Ciencia Animal Recia, 2017, 9(5): 18-25.
[17] 布坎南, 吉本斯. 伯杰氏细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984: 661-870. Buchanan R E, Gibbons N E. Bergey's manual of determinative bacteriology [M]. 8th ed. Beijing: Science Press, 1984: 661-870.
[18] 易有金, 罗宽, 刘二明. 内生细菌在植物病害生物防治中的作用[J]. 核农学报, 2007, 21(5): 474-477. Yi Y J, Luo K, Liu E M. Effect of endophytic bacteria on biological control of plant disease [J]. Journal of Nuclear Agricultural Sciences, 2007, 21(5): 474-477.
[19] Trung D Q, Hang N T, Van D M,et al. Antagonic activity of endophytic bacteria isolated from man trau grass on stem rot disease of Pitaya () [J]. Vietnam National University Journal of Science: Natural Sciences and Technology, 2021, 37(2): 60-69.
[20] 何玲敏, 叶建仁. 植物内生细菌及其生防作用研究进展[J]. 南京林业大学学报(自然科学版), 2014, 38(6): 153-159. He L M, Ye J R. Endophytic bacteria: research advances and biocontrol applications [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2014, 38(6): 153-159.
[21] Wu W, Chen W, Liu S, et al. Beneficial relationships between endophytic bacteria and medicinal plants [J]. Frontiers in Plant Science, 2021, 12: 646146.doi: 10.3389/fpls.2021.646146.
[22] Pinto-Carbó M, Gademann K, Eberl L, et al. Leaf nodule symbiosis: function and transmission of obligate bacterial endophytes [J]. Current Opinion in Plant Biology, 2018, 44(4): 23-31.
[23] 黄晓琴, 张丽霞, 刘会香, 等. 抗茶树冰核细菌内生菌的筛选及鉴定[J]. 茶叶科学, 2015, 35(1): 97-102. Huang X Q, Zhang L X, Liu H X, et al. Screeining and identification of the endophytic bacterial strain against ice nucleation active bacteria of tea plant [J]. Journal of Tea Science, 2015, 35(1): 97-102.
[24] 王桥美, 严亮, 杨瑞娟, 等. 普洱地区茶叶内生细菌与根际土壤细菌群落结构分析[J]. 微生物学报, 2022, 62(2): 703-714. Wang Q M, Yan L, Yang R J, et al. Analysis on the community structure of bacteria in tea leaves and rhizosphere soil in Pu’er [J]. Acta Microbiologica Sinica, 2022, 62(2): 703-714.
[25] 吴孔阳, 娄亚芳, 杨同香, 等. 枯草芽孢杆菌功能及相关机制研究进展[J]. 黑龙江畜牧兽医, 2020, 63(23): 55-58. Wu K Y, Lou Y F, Yang T X, et al. Research advances in function and related mechanism of[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020, 63(23): 55-58.
[26] 马佳, 李颖, 胡栋, 等. 芽胞杆菌生物防治作用机理与应用研究进展[J]. 中国生物防治学报, 2018, 34(4): 639-648. Ma J, Li Y, Hu D, et al. Progress on mechanism and applications of bacillus as a biocontrol microbe [J]. Chinese Journal of Biological Control, 2018, 34(4): 639-648.
[27] 陈百文, 刘伟, 赵恬欢, 等. 对茶树炭疽病菌具拮抗作用的茶树内生细菌的筛选[J]. 福建农林大学学报(自然科学版), 2010, 39(4): 341-346. Chen B W, Liu W, Zhao K H, et al. Screening of endophytic strains to controlMiyake [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2010, 39(4): 341-346.
[28] 代亚锋, 吴楠楠, 郜振, 等. 茶树炭疽病拮抗内生细菌贝莱斯芽胞杆菌的筛选与鉴定[J]. 信阳师范学院学报(自然科学版), 2021, 34(2): 201-207. Dai Y F, Wu N N, Gao Z, et al. Screening and identificationof the endophytic bacteriaagainst tea anthracnose [J]. Journal of Xinyang Normal University (Natural Science Edition), 2021, 34(2): 201-207.
[29] 郝金辉, 包慧芳, 王宁, 等. 库尔勒香梨黑斑病菌拮抗菌筛选及其抑菌机理[J]. 微生物学通报, 2022, 49(9): 3709-3721. Hao J H, Bao H F, Wang N, et al. Screening and possible mechanism of strains against black spot of Korla pear [J]. Microbiology China, 2022, 49(9): 3709-3721.
[30] Xu T, Zhu T H, Li S J.-1,3-1,4-glucanase gene fromZJ20 exerts antifungal effect on plant pathogenic fungi [J]. World Journal of Microbiology & Biotechnol, 2016, 32(2): 26-34.
Screening, Identification and Culture Condition Optimization of Antagonistic Endophytic Bacteria AgainstMiyake
ZHENG Shizhong, ZHOU Ziwei, CHEN Xiaohui, CAI Liewei, JIANG Shengtao, LIU Shengrong*
College of Life Sciences College, Ningde Normal University, Ningde 352100, China
To screen the antagonistic endophytic bacteria againstMiyake, the healthy leaves of tea plants were utilized as materials, and the plate antagonistic method was used. The isolated bacteria were identified and evaluated for antimicrobial efficacy. The culture conditions were optimized using response surface methodology. One antagonistic bacterium X13 was screened from 162 strains of endophytic bacteria isolated, which had a good inhibitory effect on. The strain X13 was identified asthrough morphological observation, physiological and biochemical tests, and 16S rDNA phylogenetic analysis. Theinhibitory rate of strain X13 on the mycelial growth ofreached 61.6%. Thelogarithmic growth was between 2-14 h. The optimal culture conditions were 4.0% (masspercentage concentration) corn flour, 1.0% (mass percentageconcentration) NaNO3, and 3.5% (volume fraction) inoculation. This study laid a key theoretical foundation for the prevention of the tea pathogenand the development of its biocontrol agents.
tea plant,, endophytic bacteria,, culture condition
S517.1;S435.711
A
1000-369X(2023)02-205-11
2022-09-18
2022-12-06
福建省自然科学基金(2020J01425)、宁德师范学院校级中青年项目(2020Q101)、宁德师范学院人才引进项目(2020Y013)
郑世仲,男,副教授,主要从事微生物生化和园艺生物技术研究。*通信作者:fjhost@163.com
