睡菜水提液对小鼠的急性毒性实验研究
2023-05-08魏雪娇石松云毛楚涵刘呈雄陈剑锋贺海波黄文峰
魏雪娇 石松云 毛楚涵 何 婷 刘呈雄 陈剑锋 贺海波,2 黄文峰 邹 坤 程 凡
(1.三峡大学 生物与制药学院,天然产物研究与利用湖北省重点实验室(三峡大学),湖北 宜昌 443002;2.三峡大学 生物与制药学院,药食同源大健康产品开发利用宜昌市重点实验室,湖北 宜昌 443002;3.三峡大学 医学院,湖北 宜昌 443002)
睡菜(Menyanthes trifoliata L.)为龙胆科单种属植物,又名绰菜、瞑菜.在本草典籍中首现于《本草纲目》,《嵇含南方草木状》《段公路北户录》以及郭宪《洞冥记》中记载了睡菜的生长环境及药用价值:春夏生于池沼或田埂间,食之使人思睡,性寒,微苷,味苦[1].传统医学中,睡菜被广泛应用于多类型疾病如烧伤、头痛、肾炎、关节炎、风湿等的治疗[2].近些年研究发现,睡菜具有抗炎[3]、抗肿瘤、镇静催眠[4-5]药理作用,也可以用于健脾消食、清热利尿、润肺止咳、消肿、降血压等[6-7].分析其化学成分发现,睡菜中的化学成分丰富多样,包括萜类、黄酮类、香豆素类以及酚酸、糖类等多种化学成分[8-9].虽然林芳等[4]对睡菜醇提物对小鼠进行毒性实验研究,得到最大耐受剂量(maximum tolerated dose,MTD)大于10 g/L,仍无法得到较为准确的临床用药安全范围.由于临床主要用睡菜的水煎液,开展其毒性试验研究非常有必要.基于此,本实验将对睡菜水提液的短期口服毒性进行研究,初步评估睡菜水提液的毒性,为睡菜安全食用、药用提供理论依据.
1 实验材料
1.1 实验动物
SPF级昆明种小鼠,雌雄各半,体重(20±2)g,购自三峡大学实验动物中心,动物合格证:SCXK(鄂)2022-0012.饲养于三峡大学实验动物中心,雌雄分笼,室温(22±2)℃,湿度(60±5)%,动物设施使用证明:SYXK(鄂)2022-0061.
1.2 试验药物准备
睡菜药材于2018年9月采自湖北省神农架大九湖湿地,经三峡大学生物与制药学院王玉兵教授鉴定为龙胆科睡菜属植物睡菜M.thestrifoliateL.的全草.植物标本现保存于天然产物研究与利用湖北省重点实验室(三峡大学).
睡菜干燥全草(800 g)粉碎,用纯水回流提取3次(400 m L×3),每次2 h.将水提液减压浓缩干燥,得到睡菜水提总浸膏160 g,4℃保存备用.
1.3 主要试剂及仪器
生理盐水、氯化钠、磷酸氢二钠、磷酸二氢钾均为分析纯(国药集团化学试剂有限公司).Smart-S15UVF实验室纯水系统(上海和泰仪器有限公司),ADVIA2400全自动生化分析仪(德国西门子有限公司),TP1020 自动台式脱水机、EG 1150 H 包埋机(德国Leica Biosystems公司),YGQ-3128D 切片机(亚光医用电子技术有限公司),DP260 自动染色机(深圳达科为生物技术有限股份有限公司),XD30ARFL倒置荧光显微镜(宁波舜宇仪器有限公司).
2 实验方法
2.1 小鼠口服药物准备
称取适量睡菜总浸膏,用生理盐水溶解成大号灌胃针可吸取最大可溶质量浓度1 g/m L,对浸膏及样品前后质量进行称取计算得质量浓度为491 g/L,生药质量浓度为2455 g/L,4℃保存备用.小鼠灌胃前提前取出,稀释至适当浓度,并使温度升至室温.
2.2 预实验
取昆明小鼠40只,雌雄各半,适应性喂养7 d后禁食不禁水12 h,随机分为5组,以睡菜水提液最大可供灌胃质量浓度(2 455 g/L)为起始质量浓度,按组距75%递减,即睡菜水提液以2 455、1 841.25、1 380.94、1 035.70 g/L 的药物质量浓度,以0.4 m L/10 g的灌胃体积,12 h分2次灌胃.灌胃后及时观察小鼠状态及毒性反应,若有死亡尽快解剖.末次给药4 h后常规饲养,连续观察7 d.给药0.5 h后,除了活动稍见减少外,未见明显毒副反应或死亡情况,给药第1和2天睡菜给药组小鼠进食量相比对照组明显减少,第3天至第7天两组进食量、体重变化趋势无显著性差异(P>0.05),7 d后解剖发现脏器肉眼观察无病变,与空白组无明显差异.由于睡菜水提液浓度已达到可供灌胃的最大浓度,仍无法测出睡菜的半数致死量,故而采用最大耐受量方法进行试验.
2.3 MTD实验
取昆明小鼠40只,雌雄各半,随机分两组且雌雄分开,适应性喂养7 d,禁食不禁水12 h,以最大灌胃体积0.4 m L/10 g,给药组以大号灌胃针可吸取最大可溶质量浓度2 455 g/L生药,12 h分两次灌胃,空白组用等量生理盐水灌胃.灌胃后2 h 内观测小鼠状态,若有死亡及时解剖.末次给药4 h后恢复饮食,连续观察14 d.
2.3.1 小鼠一般状态观察
观察小鼠14 d内活动、饮食、体重、大小便情况,以及毛色是否顺滑洁净.观察各组小鼠是否有毒副反应,记录中毒反应起始时间、反应严重程度,以及逆转或死亡情况.
2.3.2 血液生化指标
给药后第15天禁食12 h,摘眼球取血,室温放置2 h,2 000 r/min冷冻离心10 min后小心吸取上清,-20℃保存备用.全自动生化分析仪检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、肌酐(CREA)、尿素(BUN)、白蛋白(ALB)、总胆红素(TBIL).
2.3.3 解剖及脏器指数测定
小鼠取血后脱颈处死,解剖,取小鼠心、肝、脾、肺、肾、胃、小肠,观察各组织色泽、形态有无异常.迅速用冷藏过的PBS清洗,剔除脂肪等多余组织后称重,计算小鼠脏器指数,脏器指数(%)=[脏器湿重(g)/体质量(g)]×100%[10].
2.3.4 组织病理检查
组织取出后4%多聚甲醛浸泡室温固定24 h以上,乙醇梯度脱水,石蜡包埋,切片(厚度4μm),伊红(HE)染色,多功能显微镜下检查小鼠组织病理情况.
2.4 统计方法
3 实验结果
3.1 睡菜水提液对小鼠一般状态的影响及毒性反应
给药后持续观察小鼠状态,发现睡菜最大浓度、最大剂量给药后无小鼠死亡情况,给药小鼠活动明显减少,表现为蜷缩、反应迟钝、眯眼抱团睡觉,给予声音刺激有反应,活动状态正常,毛色顺滑.给药第2天小鼠状态恢复正常,与空白组无差异,见表1.

表1 最大给药量实验睡菜水提液的急性毒性反应情况(n=20)
3.2 睡菜水提液对小鼠体重变化的影响
结果显示睡菜给药组雌性给药前、给药后14 d体重与空白组雌性小鼠无统计学差异(P>0.05),变化趋势相近.睡菜给药组雄鼠除给药第10天与空白组雄鼠体重出现差异(P<0.05),其余时间点无统计学差异(P>0.05),如图1所示.
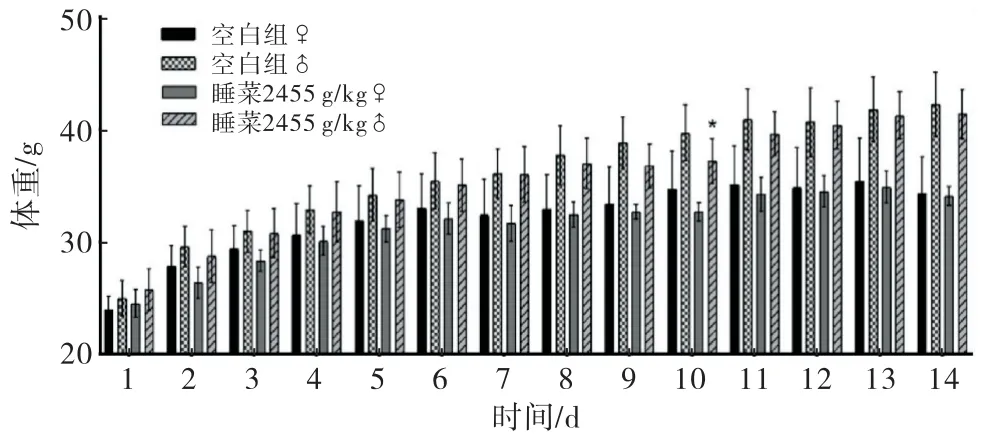
图1 睡菜水提液对小鼠体重变化的影响(注:*P<0.05)
3.3 睡菜水提液对小鼠脏器指数的影响
肉眼观察各组小鼠器官组织形态,未发现睡菜给药组与空白组有明显病变异常情况.睡菜给药各组小鼠与空白各组小鼠的心、肝、脾、肺、肾、胃组织的脏器指数无统计学差异(P>0.05),见表2.
表2 最大给药量实验下睡菜水提液对小鼠脏器的影响)
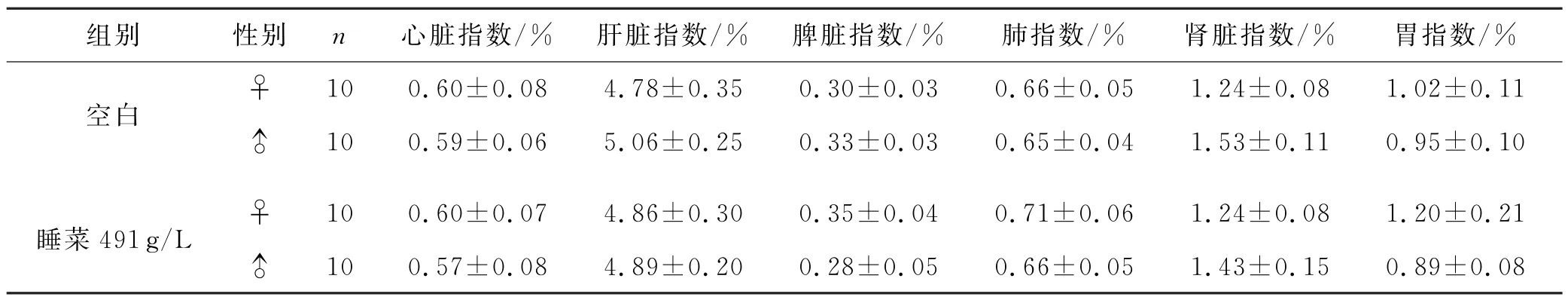
表2 最大给药量实验下睡菜水提液对小鼠脏器的影响)
3.4 睡菜水提液对小鼠血液生化指标的影响
睡菜给药♂组小鼠的血液生化指标ALT 与空白组相比减小,有显著性差异(P<0.05),AST、TBIL、ALB、ALP、UREA、CREA 均无统计学差异,见表3.
表3 最大给药量实验下小鼠血液生化指标()
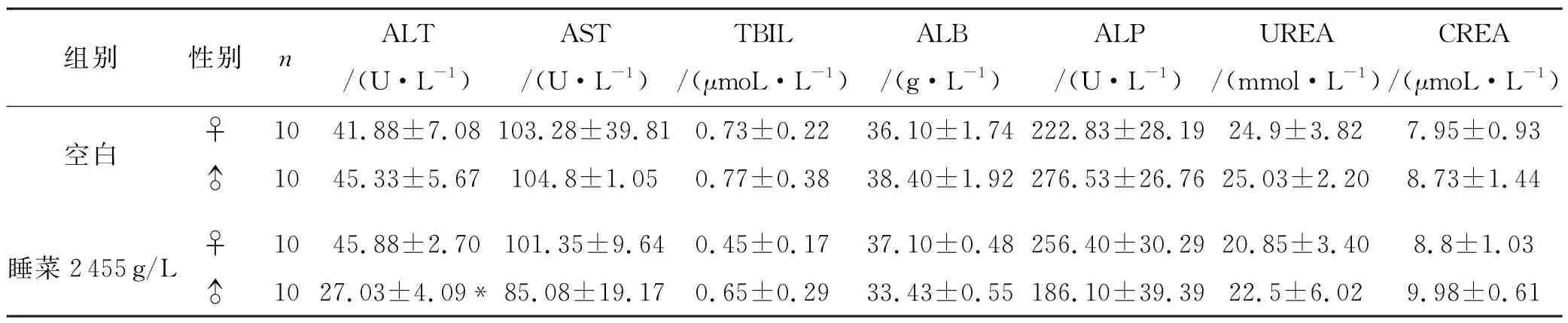
表3 最大给药量实验下小鼠血液生化指标()
注:与空白组比较,*P<0.05
3.5 睡菜水提液对小鼠脏器病理形态学的影响
对心、肝、脾、肺、肾、胃、小肠进行HE 染色,睡菜给药组心肌细胞形态正常,紧密排列,心腔内可见较多红细胞,无炎性反应及病变;肝小叶、门管区结构完整清晰,细胞排列紧密,胞核大小、形态正常,部分血管可见淤血,未见明显炎症,无实质性病变.

图2 睡菜水提液对小鼠心脏、肝脏、脾脏、肺、肾脏、小肠、胃病理形态的影响(×400)
脾脏可见被膜、白髓、红髓、小梁结构清晰完整,未见明显炎症,无实质性病变,给药及正常空白组小鼠白髓较多,可见少量红细胞,各组无显著差异,推测与饲养环境相关;肺部上皮、管壁细胞完整,肺泡干净,结构清晰,无炎性渗出;肾脏无肿胀,被膜、肾小体结构清晰完整,肾小球丰富,无明显异常;小肠管壁完整,上皮与固有层连接紧密,未见炎症及异常;胃壁组织结构清晰完整,胃腺排列紧密,数量丰富,睡菜2455 g/L组小鼠未见明显炎症及病变.睡菜2 455 g/L给药组雌性、雄性小鼠脾脏红髓较少,白髓较多,与正常空白组相比,无显著性差异.结果表明,睡菜2 455 g/L组雌雄小鼠的心脏、脾脏、肺、肝脏、肾脏、小肠及胃组织均没有病理改变.
4 讨论
近年来对睡菜的抗炎[11]、抗肿瘤[12]及神经保护作用[4-5]的药理活性研究较多,其化学成分的分析也较为全面,萜类、黄酮类、酚酸等主要化学成分的药理活性研究[13-14]也十分广泛.且睡菜生命力强,在我国生长分布广泛,黑龙江、吉林、辽宁、四川、云南、贵州、湖南等地区均有分布.具有一定的发展潜力,但其安全性方面的研究报道较少.
本文采用最大给药量实验,对睡菜进行急性毒性研究.结果得出,睡菜水提液的提取率在20%左右,小鼠灌胃的最大浓度2 455 g/L相当于成人临床剂量(15 g/70 kg体重)的100.6倍.在14 d的实验观察中,小鼠均未出现明显的毒副反应或死亡情况.以睡菜最大浓度给药情况下,睡菜给药组小鼠14 d内一般状态良好,体重及进食量情况与空白组无统计学差异(P>0.05).
脏器的状态也可反映药物对小鼠的影响,在解剖过程中,观察睡菜给药组小鼠的各组织器官形态、色泽无病理形态表现,脏器指数与空白组无统计学差异(P>0.05).
肝脏、肾脏是机体内的主要解毒器官[15],因此本实验对肝脏、肾脏指标进行重点监测,探究睡菜对小鼠肝、肾功能的影响,从而反映睡菜的毒性程度.睡菜给药组雌性的肝功能(AST、ALT、ALP、ALB、TBIL)、肾功能(CREA、BUN)与空白组无统计学差异.睡菜给药组雄性组的ALT 与空白组相比明显减少且有统计学差异(P<0.05),其他指标均无统计学差异.ALT 与毒性程度有较高的相关性,其升高程度与肝细胞受损程度成正相关,因此睡菜给药组雄性ALT 降低不能表示该组小鼠有肝功能损伤,这与HE染色结果相符合.
综上所述,在本实验条件下,睡菜灌胃给予小鼠的毒性小,最大耐受量大于2455 g/L,安全性高.本实验为睡菜的临床应用安全性提供一些科学参考,且为睡菜临床应用的进一步研究奠定了基础.
