山慈菇多糖对肝癌腹水荷瘤小鼠症状的改善机制
2023-05-07张志强魏毅强杨亚莉张晓菲
张志强,魏毅强,杨亚莉,张晓菲
1.新乡市第一人民医院消化内科一病区,新乡 453000;2.郑州大学第一附属医院消化内科,郑州 450000
肝癌是迄今为止已发现的肿瘤中异质性极强的恶性疾病[1],主要危险因素包括乙型肝炎/丙型肝炎病毒感染、饮酒、黄曲霉毒素B1和代谢紊乱等[2]。手术切除是治疗肝癌的首选方式[3];在转移性病例中,化疗是有效选择,但其在提高恶性肿瘤患者的生存率的同时,往往伴随着严重不良反应[4-5]。山慈菇具有抗炎、抗菌、抗肿瘤、抗血管生成等多种药理活性[6],可用于抗癌[7]。山慈菇多糖为山慈菇的主要生物活性成分,可提高机体免疫、抑制H22肝癌小鼠肿瘤细胞生长[8]。本研究拟通过构建肝癌腹水荷瘤小鼠模型,探讨山慈菇多糖的作用,并检测哺乳动物雷帕霉素靶蛋白(mammalian rapamycin target protein,mTOR)通路相关蛋白表达情况,以阐明山慈菇多糖对模型小鼠症状的改善作用机制。
1 仪器与材料
1.1 仪器
多功能酶标仪购自美国Thermo Fisher Scientific有限公司;化学发光凝胶成像系统(FluorChem FC3)购自美国Protein Simple公司。
1.2 试药
山慈菇多糖(质量分数≥90%,编号WKQ-0008303)购自四川省维克奇生物科技有限公司;环磷酰胺对照品(编号03121693)购自上海甄准生物科技有限公司;胎牛血清(编号12657-029)购自美国Invitrogen有限公司;Beclin1(编号PB9076)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)(编号BM0200)、Bcl-2相关X蛋白(Bcl-2 related X protein,Bax)(编号A00183)抗体均购自武汉博士德生物工程有限公司;血小板内皮细胞粘附分子1(platelet endothelial cell adhesion molecule 1,CD31,编号bs-0468R)、磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K,编号bs-6423R)、p-PI3K(编号bs-6417R)抗体购自北京博奥森生物技术有限公司;蛋白激酶B(protein kinase B,AKT,编号YT636)、p-AKT(编号YT637)抗体、mTOR(编号YT823)抗体购自北京百奥莱博科技有限公司;p-mTOR(编号sc-101738)抗体购自Santacruze公司;血管内皮生长因子(vascular endothelial growth factor,VEGF,编号AV202)抗体购自上海碧云天生物技术有限公司。
1.3 实验动物与细胞株
6周龄C57BL/6小鼠55只,SPF级雄性近交系,购自济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)2019-0003,小鼠体质量为(20±5) g;腹水型肝癌H22细胞株购自中国科学院上海细胞库。
2 方法
2.1 细胞培育与收集
H22细胞接种至RPMI 1640培养基(含100 mL·L-1胎牛血清及100 U·mL-1青-链霉素),于37 ℃、体积分数5%的二氧化碳培养箱内培养。收集细胞并调整其密度为2×106个·mL-1,吹打均匀后于5只小鼠腹腔内注射0.2 mL,7 d后抽取乳白色腹水,以1 000 r·min-1离心5 min,弃上清,生理盐水重悬并稀释细胞至密度为1×106个·mL-1,备用。
2.2 造模、分组及给药
小鼠于室温(22±2) ℃,相对湿度为50%~70%环境下普通饲养,12 h光照-黑暗交替,适应1周后,随机选取10只小鼠作为正常组,剩余40只小鼠用于构建肝癌腹水荷瘤小鼠模型[9]。吸取稀释后的H22细胞悬液0.2 mL,接种于右前腋皮下。小鼠放回笼内并持续观察,若接种部位触摸有实体样结节、腹部胀大即为建模成功,所有小鼠均成功建模。后随机分为模型组、山慈菇多糖低剂量、高剂量组及环磷酰胺组,每组各10只。山慈菇多糖低剂量、高剂量组[10]及环磷酰胺组腹腔注射给药量分别为200、400、20 mg·kg-1·d-1,正常组及模型组小鼠均腹腔注射等体积生理盐水0.2 mL,1天1次,连续14 d。
2.3 样品采集与处理
各组小鼠末次给药结束后,观察并称定质量;抽取小鼠腹水并记录腹水体积;眼眶静脉丛取血,血细胞计数板计RBC和WBC总数;脱颈致死后,迅速解剖剥离瘤体,清理并擦拭表面液体后称定质量;清理并擦拭脾脏、胸腺表面液体后称定质量;瘤体一部分保存于40 g·L-1多聚甲醛中,一部分置于液氮中保存,备用。
2.4 小鼠抑瘤率计算
用抑瘤率评估药物抗肿瘤活性,抑瘤率(%)=(模型组小鼠平均瘤质量-治疗组小鼠平均瘤质量)/模型组小鼠平均瘤质量×100%。
2.5 小鼠脏器指数计算
通过胸腺指数和脾脏指数评估治疗对免疫器官功能的影响。脾脏指数(mg·g-1)=脾脏质量/体质量;胸腺指数(mg·g-1)=胸腺质量/体质量。
2.6 肿瘤组织病理学染色
正常小鼠肝脏及造模小鼠肿瘤组织经多聚甲醛过夜固定,常规石蜡包埋,并制备为4 μm厚度组织切片,二甲苯、乙醇脱蜡至水,苏木素染液染核3 min,伊红染液染色30 s,梯度乙醇脱水,二甲苯透明,晾干后中性树胶封片,镜下观察并采集图片。
2.7 TUNEL染色检测肿瘤细胞凋亡指数
组织切片经二甲苯洗涤,梯度乙醇脱水,无DNase蛋白酶K溶液处理20 min,TUNEL反应液反应1 h,显色,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。见细胞质或细胞核中有棕色颗粒,即呈染色阳性,细胞凋亡指数=(TUNEL阳性细胞数/细胞总数)×100%。
2.8 免疫组化检测血管生成
组织切片经二甲苯和梯度乙醇脱蜡、水合,用过氧化氢溶液淬灭内源性过氧化物酶活性,抗原修复,山羊血清封闭,将切片与CD31抗体(1∶500稀释)于4 ℃孵育过夜,后于二抗溶液中孵育1 h,DAB显色,苏木精复染细胞核,乙醇脱水,Image-Pro Plus 软件观察并计数阳性染色细胞,评估血管生成情况。
2.9 检测瘤组织mTOR通路相关蛋白表达情况
取液氮中肝脏及肿瘤组织,称取100 mg并碾碎裂解,以12 000 r·min-1离心10 min,取上清。统一蛋白质量浓度并加热变性,用SDS-PAGE凝胶电泳分散蛋白(压缩胶60 V,20 min;分离胶120 V,65 min),转移蛋白至PVDF膜(200 mA,2 h);PVDF膜于脱脂乳中封闭2 h后直接与稀释后一抗(1∶1 000)于4 ℃孵育过夜;次日换液洗膜,辣根过氧化物酶标记的羊抗兔IgG(H+L)二抗(1∶8 000稀释)孵育2 h,洗膜,ECL发光液反应显影,用化学发光凝胶成像系统曝光并拍照记录。用Image J软件分析条带灰度值,以目的蛋白Beclin1、Bcl-2、Bax及VEGF蛋白相与内参GAPDH灰度值比值表示蛋白的相对表达量,以p-PI3K/PI3K、p-AKT/AKT及p-mTOR/mTOR比值评价蛋白活性。
2.10 统计学分析
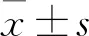
3 结果
3.1 小鼠体征及体质量
正常组小鼠饮食活动及精神状态正常,被毛光滑,皮肤、黏膜颜色未见异常;模型组小鼠反应迟缓,食物及饮水减少,腹胀、机体消瘦,皮肤暗沉,被毛无光泽,小便发黄;治疗组小鼠较模型组症状有所改善。体质量比较结果显示,5组小鼠体质量差异无统计学意义(P>0.05)。见表1。
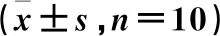
表1 各组小鼠治疗后体质量比较
3.2 小鼠腹水形成情况
抽取模型小鼠腹水,见模型组小鼠黏稠血性腹水,3个给药组小鼠腹水均呈不同程度的血色浑浊。模型组、山慈菇低剂量、高剂量组及环磷酰胺组小鼠腹水体积差异具有统计学意义(P<0.05)。与模型组比较,山慈菇多糖低剂量、高剂量组及环磷酰胺组小鼠腹水体积减少(P<0.05);与山慈菇多糖低剂量组比较,高剂量组及环磷酰胺组小鼠腹水体积减少(P<0.05),环磷酰胺组小鼠腹水体积最少(P<0.05)。见表2。
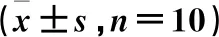
表2 各组小鼠腹水体积比较
3.3 小鼠外周血RBC、WBC总数
计数结果显示,5组小鼠外周血RBC、WBC总数差异具有统计学意义(P<0.05)。进一步两两比较结果显示,与正常组比较,模型组小鼠RBC总数减少,WBC总数增加(P<0.05);与模型组比较,3个给药组小鼠RBC总数增加,WBC总数减少(P<0.05);与山慈菇多糖低剂量组比较,高剂量组及环磷酰胺组RBC总数增加,WBC总数减少(P<0.05),环磷酰胺组小鼠RBC总数最高,WBC总数最低(P<0.05)。见表3。
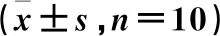
表3 RBC、WBC总数比较
3.4 小鼠肿瘤质量及抑瘤率
结果显示,4组模型小鼠肿瘤质量差异有统计学意义(P<0.05)。与模型组比较,3个给药组小鼠肿瘤质量降低(P<0.05);与山慈菇多糖低剂量组比较,高剂量组及环磷酰胺组小鼠肿瘤质量降低(P<0.05),环磷酰胺组小鼠肿瘤质量最低(P<0.05)。经抑瘤率计算,结果显示山慈菇多糖低剂量组抑瘤率最低(P<0.05)。见表4。
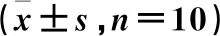
表4 各组小鼠肿瘤质量及抑瘤率比较
3.5 小鼠脾脏、胸腺指数
结果显示,5组小鼠脾脏指数、胸腺指数差异有统计学意义(P<0.05)。与正常组比较,模型组小鼠脾脏指数、胸腺指数均降低(P<0.05);与模型组比较,3个给药组小鼠脾脏指数、胸腺指数均升高(P<0.05);与山慈菇多糖低剂量组比较,高剂量组及环磷酰胺组小鼠脾脏指数、胸腺指数均升高(P<0.05),环磷酰胺组小鼠脾脏指数、胸腺指数最高(P<0.05)。见表5。
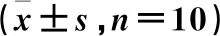
表5 各组小鼠脾脏指数、胸腺指数比较
3.6 小鼠肿瘤组织学观察
HE染色结果显示,与正常组肝组织比较,模型组肿瘤细胞结构完整,排列整齐,生长良好,异型性高,血管丰富;与模型组比较,3个给药组小鼠肿瘤细胞皱缩、破碎、凋亡,排列不规则,坏死区域逐渐扩大。见图1。
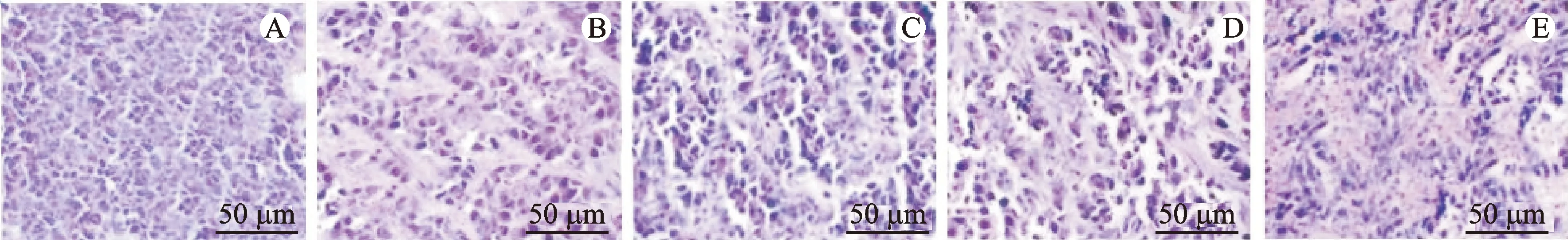
注:A.正常组;B.模型组;C.山慈菇多糖低剂量组;D.山慈菇多糖高剂量组;E.环磷酰胺组。
3.7 小鼠肿瘤细胞凋亡指数
TUNEL染色结果显示,3个给药组小鼠肿瘤组织见有明显凋亡阳性细胞。计量结果显示,4组小鼠肿瘤细胞凋亡指数差异具有统计学意义(P<0.05)。与模型组比较,3个给药组小鼠肿瘤细胞凋亡指数升高(P<0.05);与山慈菇多糖低剂量组比较,山慈菇多糖低剂量、高剂量组及环磷酰胺组小鼠肿瘤细胞凋亡指数升高(P<0.05),环磷酰胺组小鼠肿瘤细胞凋亡指数最高(P<0.05)。见图2、表6。
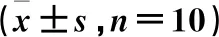
表6 肿瘤细胞凋亡指数比较
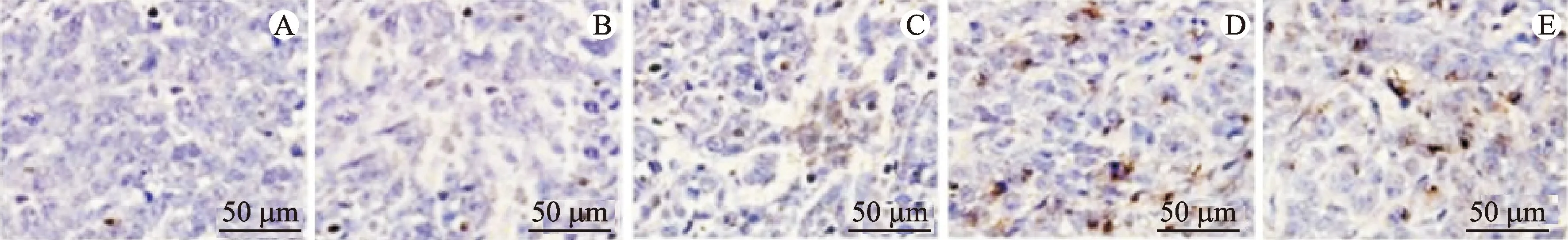
注:A.正常组;B.模型组;C.山慈菇多糖低剂量组;D.山慈菇多糖高剂量组;E.环磷酰胺组。
3.8 小鼠肿瘤组织血管生成情况
免疫组化结果显示,各组小鼠肝脏、肿瘤组织中CD31阳性血管数差异具有统计学意义(P<0.05)。与正常组比较,模型组肿瘤组织中CD31阳性血管数增多(P<0.05);与模型组比较,3个给药组小鼠肿瘤组织中CD31阳性血管数减少(P<0.05);与山慈菇多糖低剂量组比较,山慈菇多糖高剂量组及环磷酰胺组小鼠肿瘤组织中CD31阳性血管数减少(P<0.05),环磷酰胺组小鼠肿瘤组织中CD31阳性血管数最少(P<0.05)。见表7、图3。
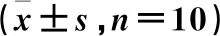
表7 各组小鼠CD31阳性血管数比较
注:A.正常组;B.模型组;C.山慈菇多糖低剂量组;D.山慈菇多糖高剂量;E.环磷酰胺组。
3.9 mTOR通路相关蛋白表达情况
Western blot结果显示,5组大鼠组织中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Beclin1、Bcl-2、Bax及VEGF蛋白相对表达水平差异有统计学意义(P<0.05)。与正常组比较,模型组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Bcl-2及VEGF蛋白相对表达水平升高,Beclin1及Bax蛋白相对表达水平降低(P<0.05);与模型组比较,3个给药组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Bcl-2及VEGF蛋白相对表达水平降低,Beclin1及Bax蛋白相对表达水平升高(P<0.05);与山慈菇多糖低剂量组比较,多糖高剂量组及环磷酰胺组小鼠肿瘤组织中p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR、Bcl-2及VEGF蛋白相对表达水平降低,Beclin1及Bax蛋白相对表达水平升高(P<0.05),环磷酰胺组改变最明显(P<0.05)。见图4、表8。

注:A.正常组;B.模型组;C.山慈菇多糖低剂量组;D.山慈菇多糖高剂量组;E.环磷酰胺组。
表8 各组小鼠肿瘤组织中mTOR通路相关蛋白相对表达水平
4 讨论
本研究用H22细胞腹水接种成功构建肝癌腹水荷瘤小鼠模型,经山慈菇多糖低剂量、高剂量治疗,结果显示,山慈菇多糖可降低肿瘤体质量,山慈菇多糖低剂量、高剂量抑瘤率分别为25.31%、45.57%,并可促进肿瘤组织中心细胞坏死,提示山慈菇多糖可有效抑制肿瘤生长,延缓癌症发展。
免疫系统在阻止肿瘤发展并抑制已形成肿瘤方面发挥重要作用,在免疫缺陷背景下癌症的增殖和转移更容易发生[11]。脾脏和胸腺指数反映了机体的免疫功能,指数增加表明免疫增强[12]。本研究结果显示,模型组小鼠脾脏指数及胸腺指数降低,且血液中WBC总数升高,提示机体免疫功能低下;而经山慈菇多糖低剂量、高剂量治疗后,脏器指数增加,WBC总数减少,提示山慈菇多糖具有抗肿瘤活性的免疫调节特性;恶性腹水治疗对于改善腹部恶性肿瘤的预后具有重要意义,本研究表明,模型组小鼠血性腹水量多,血液中RBC总数减少,提示机体贫血;经山慈菇多糖低、高剂量治疗后,出血性腹水减少,RBC总数增加,提示山慈菇多糖可改善机体机能,减少腹水形成,抑制不良病理进展。
转移是癌症发展的重要标志,涉及多种因素,如肿瘤血管生成、炎症性肿瘤微环境的发展和程序性细胞死亡的缺陷[13]。转移过程的成功依赖于恶性细胞逃避凋亡的能力[14],而细胞凋亡可通过杀死错位细胞阻止转移[15]。自噬在癌症转移中的作用复杂,可通过过度地自我消化和凋亡激活直接或间接诱导自噬细胞死亡,从而抑制肿瘤进展[16];自噬缺陷增加氧化应激、DNA损伤和基因组不稳定性,从而促进癌症的发生和发展[17]。CD31用于评估肿瘤血管生成,VEGF是一种重要的促血管生成因子,Bcl-2为抗细胞凋亡因子,Bax与Bcl-2作用相反,通过Bax过表达可促进肝癌细胞凋亡[18],Beclin1为自噬标记物。本研究结果显示,山慈菇多糖可显著减少CD31阳性血管数,降低Bcl-2及VEGF蛋白表达,促进Bax及Beclin1蛋白表达,提示山慈菇多糖可能通过减少血管生成、促进自噬及凋亡,从而抑制肿瘤生长。研究表明,自噬激活可抗血管生成,促进肿瘤细胞凋亡[19],而mTOR是自噬负调控和抗肿瘤药物的药理学靶点,PI3K/AKT/mTOR信号通路与肿瘤发生发展密切相关[20]。本研究结果显示,模型组小鼠PI3K/AKT/mTOR活性升高,山慈菇多糖可显著降低PI3K/AKT/mTOR活性,提示山慈菇多糖的抗肿瘤作用可能与抑制PI3K/AKT/mTOR激活、诱导自噬发生,进而抑制血管生成并促进肿瘤细胞凋亡有关。
综上所述,山慈菇多糖可抑制肿瘤生长、调节机体免疫,延缓癌症发展,有效改善模型小鼠病理症状,其机制可能与抑制PI3K/AKT/mTOR通路激活有关。
