阿替普酶溶栓后桥接替罗非班治疗进展性缺血性脑卒中的效果
2023-05-07刘富丽
刘富丽
(郑州市第七人民医院 全科医学科,河南 郑州 450000)
进展性缺血性脑卒中(progressive ischemic stroke,PIS)患者发病时首先出现轻度神经功能缺失症状,治疗2~3 d后病情仍呈进行性加重,直至神经功能严重缺损[1]。随社会结构逐渐趋于老龄化,PIS发病人数也随之增加,并具有病情重、致残率、致死率高等特点。因此,临床应给予PIS患者及时有效的治疗,以控制病情进展[2]。阿替普酶是一种常用的溶栓药,含有约526个氨基酸,主要成分为糖蛋白,主要于人体肝中代谢,其他通过赖氨酸残基与纤维蛋白结合,使纤溶酶原择性地转变为纤溶酶,被临床用于治疗急性心肌梗死和冠状动脉再通等[3-4]。替罗非班为抗血小板药物,通过抑制纤维蛋白、GPⅡb/Ⅲa受体结合,减少血小板聚集及形成,缩短出血时间,对颅内血管血栓性闭塞引起的脑梗死安全有效,甚至可缩小脑梗死的体积[5]。本研究纳入72例PIS患者作为研究对象,旨在探讨阿替普酶溶栓后桥接替罗非班治疗进展性缺血性脑卒中的效果。
1 对象与方法
1.1 研究对象回顾性选取2021年2月至2022年2月就诊于郑州市第七人民医院的72例PIS患者为研究对象,根据治疗方案分为两组,每组36例。对照组男16例,女20例;年龄61~77(68.27±3.67)岁;糖尿病6例,高血压15例。观察组男17例,女19例;年龄58~76(67.49±3.79)岁;糖尿病8例,高血压13例。两组上述资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准。
1.2 纳入及排除标准(1)纳入标准:PIS患者符合《中国急性缺血性脑卒中诊治指南》[6]诊断标准,且经检查确诊;病程<1周;可坚持按本研究方案进行治疗,且签署知情同意书;有完整的临床病历资料。(2)排除标准:对本研究使用药物过敏;有严重的精神障碍,无法配合沟通;肝、肾等器官功能不全;合并恶性肿瘤;凝血功能异常;合并出血性疾病如颅内出血、活动性内脏出血等。
1.3 治疗方法
1.3.1对照组 根据患者的个体差异,给予常规的对症支持治疗,如脑神经保护、扩血管、他汀类降脂、降糖、维持水和电解质平衡等。对照组患者接受注射用阿替普酶(Boehringer Ingelheim Pharma GmbH &Co.KG,国药准字SJ20160054)静脉溶栓,剂量为0.9 mg·kg-1,第1分钟内静脉推注总剂量的10%,剩余的药物在1 h内静脉滴注,最大剂量则应不超过90 mg,治疗1次。
1.3.2观察组 在对照组给药的基础上,采用盐酸替罗非班氯化钠注射液(石家庄四药有限公司,国药准字H20183523)静脉泵入给药治疗,剂量为9 mL·h-1,持续28 h,治疗1次。
1.4 疗效评估标准以美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评估患者患脑梗死以后的神经缺损程度。量表包含意识、语言、运动、共济运动、眼球运动、感觉、视野等。NIHSS评分拟定为无效(改善率<40%)、进步(改善率≥40%)、显著进步(改善率≥70%)、痊愈(改善率≥90%)。治疗总有效率为痊愈率、显著进步率与进步率的和;改善率为治疗前后NIHSS评分之差占治疗前NIHSSS评分的百分比。
1.5 观察指标(1)临床疗效。(2)凝血功能和血清因子水平。治疗前和治疗2个月后,采集患者的清晨空腹时候的肘部静脉血4 mL。以2 500 r·min-1的速率离心10 min(离心半径10 cm),收集上清液并保存于-70 ℃备用。以凝固酶法检测两组患者活化部分凝血激酶时间(activated partial thromboplastin time,APTT)、D-二聚体(D-dimer,D-D)、凝血酶原时间(prothrombin time,PT),采用免疫速率散射比浊法检测两组患者脂蛋白相关磷脂酶A2(lipoprotein associated phospholipase A2,Lp-PLA2)、高敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)。(3)神经功能缺损情况。采用NIHSS量表评价两组入院时、治疗后1、2、3、7 d神经功能缺损变化情况。NIHSS总分 0~42分。得分越低,表明患者的神经功能缺损恢复越好。(4)并发症。牙龈出血、消化道出血、恶心呕吐等。

2 结果
2.1 临床疗效观察组总有效率高于对照组,但差异无统计学意义(P<0.05)。见表1。
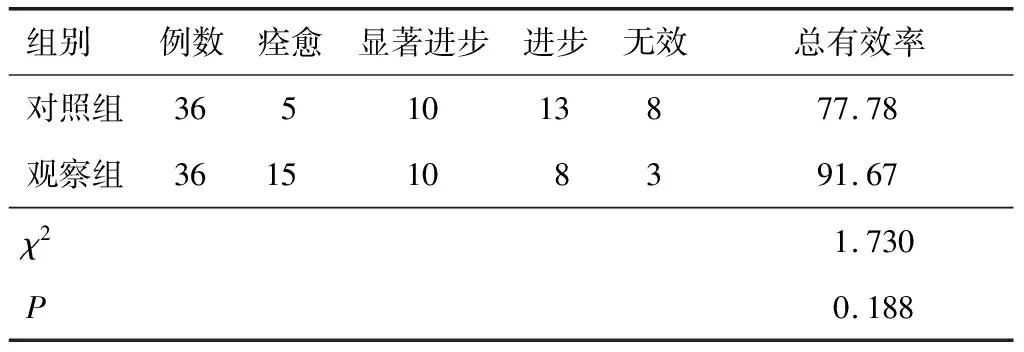
表1 两组治疗效果比较(n,%)
2.2 血清因子水平治疗前,两组Lp-PLA2、hs-CRP、ox-LDL水平比较,差异无统计学意义(P>0.05);治疗后,观察组Lp-PLA2、hs-CRP、ox-LDL水平低于对照组(P<0.05)。见表2。
表2 两组治疗后Lp-PLA2、hs-CRP、ox-LDL表达水平比较
2.3 凝血功能治疗前,两组APTT、D-D、PT比较,差异无统计学意义(P>0.05);治疗后,两组APTT、PT差异无统计学意义(P>0.05);治疗后,观察组D-D低于对照组(P<0.05)。见表3。
表3 两组治疗后APTT、D-D、PT比较
2.4 神经功能缺损两组不同时间、组间、交互作用下NIHSS评分比较,差异有统计学意义(P<0.05),治疗后1、2、3、7 d,观察组NIHSS评分降低,并且低于对照组(P<0.05)。见表4。

表4 两组不同时间NIHSS评分的比较分)
2.5 并发症观察组发生1例消化道出血、1例恶心呕吐、2例牙龈出血;对照组发生1例消化道出血、3例恶心呕吐、3例牙龈出血。两组并发症发生率差异无统计学意义(χ2=0.966,P=0.356)。
3 讨论
PIS是一种常见的神经内科高发疾病,临床症状多表现为胸闷气短、缺血缺氧,其致病因素复杂多样,起病紧急,病情发展迅猛,若未能得到及时有效的治疗,将危及患者生命[7]。PIS主要发病机制之一是血栓形成,因而调节血小板的功能、预防血栓在PIS治疗中非常重要[8]。
阿替普酶治疗PIS效果良好,可改善患者脑组织循环,恢复神经功能,改善患者的预后,但是溶栓后血管再通率较低,再闭塞率较高,且单独使用效果不佳[9-10],血管再闭塞后患者家庭经济负担和精神压力增加,因而预防溶栓后再闭塞十分关键。替罗非班为受体拮抗剂,可抑制纤维蛋白原与血小板GPⅡb/Ⅲa受体结合,切断血小板聚集通路,达到抑制血小板聚集的效果[11]。替罗非班起效较快,可快速促进微循环,提高血管的再通率,在高效溶解血栓的同时,预防机体内再次形成血栓[12-13]。本研究结果显示,观察组治疗总有效率高于对照组高,NIHSS评分低于对照组,提示替罗非班氯化钠联合阿替普酶治疗PIS效果确切,且可有效缓解PIS患者的神经功能缺损程度。这可能与替罗非班对于阿替普酶溶栓后再闭塞可以起到再通作用,可以改善神经功能有关。
血清因子Lp-PLA2、hs-CRP、ox-LDL水平、凝血功能APTT、D-D、PT与PIS的发生、发展密切相关[14]。Lp-PLA2由血管内膜中的巨噬细胞、T细胞和肥大细胞分泌,为新型的炎性标志物,产生致动脉粥样硬化作用,包括内皮细胞死亡和内皮功能异常,刺激黏附因子和细胞因子产生,这些物质可通过趋化炎症细胞进一步自我强化,生成更多促炎物质。hs-CRP作为众所周知的炎症标志物,在动脉粥样硬化的形成过程中起促进作用,且可影响斑块的稳定性。ox-LDL为动脉粥样硬化发生、发展过程中的重要因子,它不像LDL 那样容易降解,而是易于聚集在巨噬细胞内形成泡沫细胞,影响患者的凝血系统功能。有研究显示,PIS患者ox-LDL含量水平高于健康人群[15-17]。本研究结果显示,治疗后,观察组D-D、Lp-PLA2、hs-CRP、ox-LDL低于对照组,提示联合治疗后可有效降低机体炎症水平,改善患者的凝血功能。
综上所述, PIS患者采用替罗非班氯化钠注射液、阿替普酶联合治疗的效果显著,可显著改善患者的神经功能缺损情况,可以在一定程度上修复患者的凝血系统功能,降低炎性水平的同时实现抗炎、抗血栓功效,推荐临床医生根据患者的实际病情,酌情使用该治疗方案。本研究也有不足之处,样本量不大,且未对患者进行随访,无法获得患者的预后情况,未来研究可观察患者的短期和长期预后。
