miR-182-5p靶向TRIM52逆转卵巢癌SKOV3细胞对顺铂耐药的机制
2023-05-07郭慧张化莲张甜甜
郭慧,张化莲,张甜甜
(驻马店市中心医院 产科,河南 驻马店 463000)
卵巢癌是女性常见的恶性肿瘤,且起病隐匿,部分患者确诊时已经处于中晚期,给卵巢癌的治疗带来巨大挑战,顺铂(cisplatin,CDDP)是卵巢癌化疗的常见药物,其对卵巢癌的复发、转移具有十分重要的作用[1]。近年来,卵巢癌CDDP耐药已经成为卵巢癌治疗的难点,通过分子靶向治疗提高卵巢癌CDDP敏感性可能是提高卵巢癌患者预后的有效途径。
miRNA是一类广泛表达的小分子RNA,具有多种生物学效应[2]。研究显示,卵巢癌CDDP耐药与miRNA有关,miRNA在耐药卵巢癌患者中表达改变,其参与调控卵巢癌CDDP敏感性[3]。miR-182-5p定位在7q32.2染色体上,参与调控听力发育以及骨骼肌萎缩等过程[4]。大量研究显示,miR-182-5p参与肿瘤进展,miR-182-5p在胃癌、结直肠癌等肿瘤中发挥类似抑癌基因的作用[5-6]。还有研究发现,miR-182-5p在胃癌CDDP耐药中发挥抑制作用[7]。既往研究表明,miR-182-5p可以降低卵巢癌细胞恶性生长和转移能力[8]。目前对miR-182-5p在耐药卵巢癌细胞中的作用以及其对卵巢癌CDDP耐药性的作用还不明确。本研究以卵巢癌SKOV3细胞作为实验对象,探讨miR-182-5p对卵巢癌细胞CDDP耐药性的作用和可能机制。
1 材料与方法
1.1 材料卵巢癌SKOV3细胞购自上海弘顺生物公司;胎牛血清、胰蛋白酶购自美国Gibco公司;DMEM培养基购自深圳市百恩维生物公司;基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)抗体购自武汉艾美捷科技有限公司;CDDP购自大连美仑生物技术有限公司;miR-182-5p mimics、mimics control、TRIM52过表达载体(pcDNA-TRIM52)、阴性对照载体(pcDNA)均由上海吉玛制药技术有限公司构建合成;C-Caspase-3抗体、三结构域蛋白52(tripartite motif containing 52,TRIM52)抗体购自美国Santa Cruz Biotechnology;TRIM52-WT和TRIM52-MUT均由湖南丰晖生物科技有限公司构建。
1.2 研究方法
1.2.1qRT-PCR检测卵巢癌细胞中miR-182-5p水平 将对数生长期的SKOV3和CDDP处理的SKOV3细胞(SKOV3/CDDP)分别以1×106L-1的密度接种到6孔板中,培养24 h后,用Trizol试剂提取SKOV3和SKOV3/CDDP细胞中的总RNA,以紫外分光光度计检测A260/280在1.8~2.0。配制逆转录体系,体系为2 μL 5×miScript RT Buffer、0.5 μL miScript RT Mix、7.5 μL RNase-Free water、1 μg总RNA,总体积为10 μL,在37 ℃孵育60 min,95 ℃孵育5 min。取逆转录产物进行qRT-PCR反应,反应体系为5 μL 2×QuantTect SYBR Green PCR Master Mix、0.5 μL miScript U6/miR-182-5p Primer、3.5 μL RNase-Free water、0.5μL cDNA,总体积为10 μL,反应程序为95 ℃孵育15 s,94 ℃孵育15 s,58 ℃孵育20 s,72 ℃孵育20 s。以U6作为内参,分析miR-182-5p水平。引物序列如下:miR-182-5p F 5’-TTAGGAACCCTCCTCTCTC-3’,R 5’-CGGTGATGTGAAGAAGGA-3’;U6F 5’-GCTTCGGCAGCACATATACTAAAAT-3’,R 5’-CGCTTCAGAATTTGCGTGTCAT-3’。
1.2.2细胞转染和分组 将SKOV3细胞分成Control、miR-NC、miR-182-5p、miR-NC+CDDP、miR-182-5p+CDDP共5组,miR-NC、miR-NC+CDDP为转染mimics control的SKOV3细胞,miR-182-5p、miR-182-5p+CDDP为转染miR-182-5p mimic的SKOV3细胞,miR-NC+CDDP、miR-182-5p+CDDP在细胞转染后12 h,更换为含有20 mg·L-1CDDP的细胞培养液,Control为正常培养的对照细胞。细胞转染步骤参照Lipofectamine 2000转染试剂说明书进行。
1.2.3MTT测定细胞增殖 取对数生长期的SKOV3细胞按照Control、miR-NC、miR-182-5p、miR-NC+CDDP、miR-182-5p+CDDP分组方法接种到96孔板内(每孔100 μL),调整细胞密度为3×104mL-1,培养24 h,在每个孔中添加10 μL MTT溶液,37 ℃孵育4 h。弃上清,添加150 μL二甲基亚砜溶液,反应10 min,酶标仪测定490 nm的A值。A值表示细胞增殖能力。
1.2.4流式细胞术检测细胞凋亡 收集各组培养24 h的细胞,用胰蛋白酶将细胞消化,PBS洗涤细胞2次,加入结合缓冲液500 μL,添加5 μL Annexin V-FITC和PI染液,孵育15 min。使用流式细胞仪检测细胞凋亡情况。
1.2.5Transwell小室检测细胞迁移和侵袭 细胞侵袭实验前用Matrigel将小室湿化,用8 μm孔径的Transwell小室进行细胞迁移和侵袭实验。将SKOV3细胞按照分组方法以不含血清的细胞培养液将密度调整为1×106mL-1,在小室中添加200 μL的细胞悬浮液,在下室中添加600 μL的含有10%胎牛血清的细胞培养液,细胞培养24 h后,用PBS洗涤小室,添加95%的乙醇溶液处理5 min,然后用0.5%的结晶紫溶液染色10 min,用PBS洗涤。用棉签将没有穿膜的细胞擦掉,在显微镜下观察细胞穿膜数量即为细胞侵袭或迁移数目。
1.2.6Western blot检测MMP-9、C-Caspase-3蛋白水平 收集各组培养24 h后的细胞,在细胞中添加RIPA裂解溶液,放在冰上静置30 min,4 ℃、12 000g离心10 min。弃去沉淀,吸取上清,用BCA方法测定蛋白样品的浓度。在蛋白样品中添加5×Loading Buffer溶液充分混合,100 ℃煮沸5 min。分别制备100 g·L-1的分离胶和50 g·L-1的浓缩胶,在每个上样孔内添加30 μg的蛋白样品,以80 V的电压电泳30 min,再调整电压为120 V,继续电泳2 h。裁剪合适大小的PVDF膜,浸泡在甲醇中,然后放在转膜缓冲液中平衡10 min。设置200 mA恒流转膜1 h。把PVDF膜放在50 g·L-1牛血清白蛋白封闭液中孵育结合2 h,然后放在一抗稀释液中浸泡2 h,最后放在二抗稀释液中浸泡2 h。用ECL显色试剂盒显色。内参为GAPDH,分析目的蛋白表达变化。二抗以1∶4 000稀释,MMP-9、C-Caspase-3一抗分别以1∶1 000和1∶600稀释。
1.2.7靶基因预测和鉴定 用在线生物学软件targetscan预测靶基因,发现miR-182-5p和TRIM52 3’UTR端有互补结合位点。利用荧光素酶报告系统鉴定靶向关系。将TRIM52-WT和TRIM52-MUT分别与miR-182-5p mimics、mimics control共转染到SKOV3/CDDP细胞中,培养24 h后,用荧光素酶活性检测试剂盒检测细胞荧光素酶活性变化。TRIM52-WT为含有TRIM52 3’UTR端结合位点的荧光素酶报告载体,TRIM52-MUT为含有突变以后TRIM52 3’UTR端结合位点的荧光素酶报告载体。收集培养24 h后的Control、miR-NC、miR-182-5p组细胞,用Western blot方法测定细胞中TRIM52蛋白表达变化,步骤同1.7,TRIM52一抗以1∶1 200稀释。
1.2.8TRIM52过表达载体对miR-182-5p联合CDDP影响SKOV3/CDDP细胞恶性生物学行为的作用 SKOV3细胞中分别共转染阴性对照载体、miR-182-5p mimics和TRIM52过表达载体、miR-182-5p mimics,然后用含有20 mg·L-1CDDP的细胞培养液培养,分别记为miR-182-5p+CDDP+Vector、miR-182-5p+CDDP+TRIM52组,细胞培养24 h以后,MTT方法测定增殖(步骤同1.4),流式细胞术测定凋亡(步骤同1.5),Transwell小室测定迁移和侵袭(步骤同1.6),Western blot测定MMP-9、C-Caspase-3、TRIM52蛋白表达(步骤同1.7),结果比较以miR-182-5p+CDDP+Vector组作为参照。

2 结果
2.1 miR-182-5p在SKOV3/CDDP细胞中表达下调SKOV3/CDDP细胞中miR-182-5p表达(0.63±0.07)低于SKOV3细胞(1.00±0.12)(t=7.990,P<0.001),miR-182-5p在SKOV3/CDDP细胞中表达下调。
2.2 miR-182-5p mimics联合CDDP对SKOV3/CDDP细胞增殖、凋亡、侵袭和迁移影响转染miR-182-5p mimics和CDDP处理后的SKOV3/CDDP细胞增殖、侵袭和迁移能力降低,凋亡率升高,MMP-9蛋白水平降低,C-Caspase-3蛋白水平升高(P<0.001),见图1和表1。
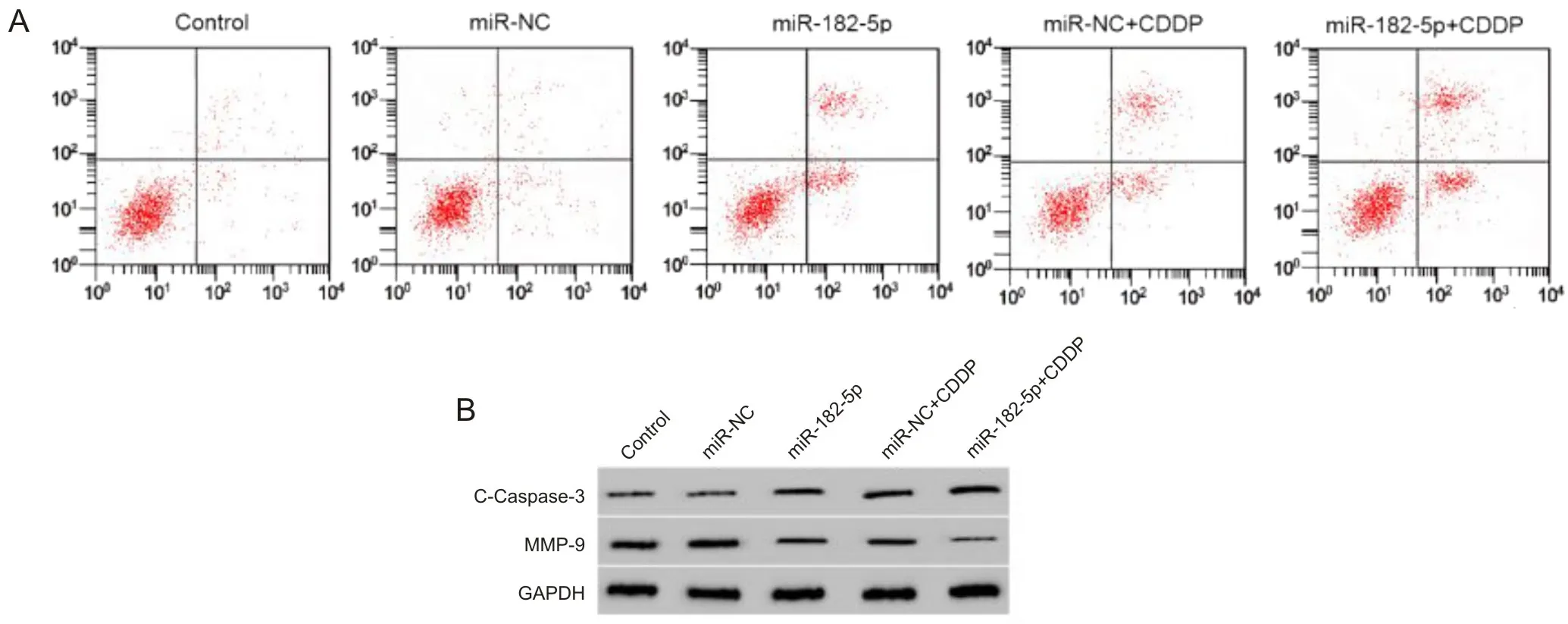
A为流式细胞术检测转染miR-182-5p mimics和CDDP处理后SKOV3/CDDP细胞凋亡变化;B为Western blot检测转染miR-182-5p mimics和CDDP处理后SKOV3/CDDP细胞中MMP-9、C-Caspase-3蛋白表达情况。
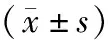
表1 5组SKOV3细胞中miR-182-5p表达水平及对增殖、凋亡、侵袭、迁移的影响
2.3 miR-182-5p和TRIM52互为靶向关系在线靶基因预测软件预测miR-182-5p和TRIM52 3’UTR端有互补结合位点,荧光素酶报告实验结果显示,WT和miR-182-5p mimics共转染后的细胞荧光素酶活性下降(P<0.001),见图2和表2。miR-182-5p和TRIM52互为靶向关系。

图2 在线靶基因预测软件预测miR-182-5p和TRIM52 3’UTR端结合位点
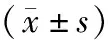
表2 荧光素酶活性
2.4 上调miR-182-5p抑制SKOV3/CDDP细胞中TRIM52蛋白表达转染miR-182-5p mimics后的SKOV3/CDDP细胞中TRIM52蛋白表达下降(P<0.001),见图3和表3。上调miR-182-5p可抑制SKOV3/CDDP细胞中TRIM52蛋白表达。
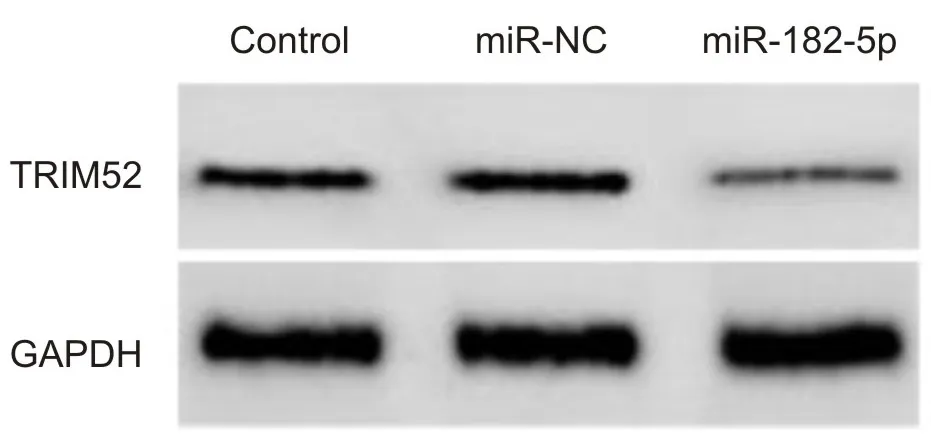
图3 SKOV3/CDDP细胞中TRIM52蛋白表达情况
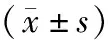
表3 转染miR-182-5p mimics后SKOV3/CDDP细胞中TRIM52蛋白表达
2.5 TRIM52逆转miR-182-5p联合CDDP对SKOV3/CDDP细胞增殖、迁移、侵袭和凋亡作用与共转染阴性对照载体和miR-182-5p mimics比较,共转染TRIM52过表达载体和miR-182-5p mimics后的SKOV3/CDDP细胞经过CDDP处理以后,细胞增殖、迁移和侵袭能力升高,细胞凋亡率下降,细胞中MMP-9蛋白表达水平增多,C-Caspase-3蛋白表达水平减少(P<0.001),见图4和表4。TRIM52逆转miR-182-5p联合CDDP对SKOV3/CDDP细胞增殖、迁移、侵袭和凋亡作用。

A为流式细胞仪检测SKOV3/CDDP细胞凋亡变化;B为Western blot检测SKOV3/CDDP细胞中TRIM52、MMP-9、C-Caspase-3蛋白表达水平。
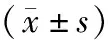
表4 共转染TRIM52过表达载体和miR-182-5p mimics经CDDP处理后SKOV3/CDDP细胞A值、凋亡率、迁移数目、侵袭数目和MMP-9、C-Caspase-3、TRIM52蛋白表达水平
3 讨论
miRNA在真核生物体内普遍存在,其无开放阅读框,因此几乎无编码蛋白质的功能。miRNA在胚胎发育、细胞分化、细胞衰老等过程中发挥关键作用[9]。miRNA不仅与机体正常的生理过程有关,还与疾病发生和进展关系密切,已知miRNA与关节炎、脓毒症、糖尿病等多种疾病的恶性进展有关,miRNA有望成为疾病治疗的分子靶点[10]。近些年来,miRNA与肿瘤的关系引起人们广泛关注,miRNA在肿瘤生长、转移、耐药等过程中扮演重要角色[11]。miR-182-5p在人体组织中表达,具有多种生物学作用,其参与肿瘤进展,并且在不同的肿瘤组织中发挥作用不同,在乳腺癌、结直肠癌中发现miR-182-5p可以抑制肿瘤进展,而在口腔鳞状细胞癌、白血病细胞中发现miR-182-5p可以抑制肿瘤细胞生长[5-6,12-13]。研究发现,miR-182-5p在卵巢癌组织中表达下调,miR-182-5p具有抑制卵巢癌细胞生长的作用[8]。miR-182-5p参与肿瘤CDDP耐药,miR-182-5p可提高胃癌细胞CDDP敏感性[7]。本研究结果显示,miR-182-5p在耐药卵巢癌细胞中表达下调,并且miR-182-5p联合CDDP抑制耐药卵巢癌细胞生长、侵袭和迁移能力,诱导细胞凋亡,miR-182-5p具有提高卵巢癌CDDP敏感性的作用,这与之前的报道相一致,均说明miR-182-5p参与肿瘤耐药发生。
本研究还发现,miR-182-5p联合CDDP可降低耐药卵巢癌细胞中MMP-9蛋白表达,提高C-Caspase-3蛋白表达。MMP-9是基质金属蛋白酶家族成员之一,其具有降解细胞外基质的作用,在肿瘤进展中发挥癌基因的作用,其表达越高,肿瘤转移能力也就越强[14]。C-Caspase-3是经过剪切活化以后的Caspase-3,Caspase-3是Caspase蛋白家族成员,是细胞凋亡有关的调控因子,Caspase-3位于凋亡反应的下游,其活化后标志着细胞凋亡进入不可逆的阶段[15]。本实验结果提示,miR-182-5p联合CDDP诱导耐药卵巢癌细胞凋亡并抑制细胞转移,这与细胞凋亡和迁移、侵袭检测结果一致。
miRNA发挥生物学作用与调控靶基因的表达有关,这也是miRNA功能多样的重要原因[16]。miRNA与靶mRNA的3’UTR端通过碱基互补的方式结合,并且同一个miRNA能够与多个目标mRNA结合,同一个目标mRNA也可以受到多个miRNA的调控作用,miRNA通过这种复杂的调控网络参与多种病理和生理过程[17-19]。本实验表明,miR-182-5p靶向抑制TRIM52表达。TRIM52位于5q35.3染色体上,其是TRIM家族成员之一,参与肿瘤进展[20]。TRIM52在肝癌、卵巢癌等肿瘤中发挥促进作用,其可以诱导肿瘤细胞生长和转移[21-22]。本实验结果显示,过表达TRIM52可以逆转miR-182-5p联合CDDP对耐药卵巢癌细胞生长、侵袭、迁移和凋亡的作用,提示miR-182-5p靶向TRIM52影响卵巢癌细胞药物敏感性。
综上,miR-182-5p在卵巢癌CDDP耐药中可能发挥抑制作用,其可以靶向TRIM52提高卵巢癌CDDP敏感性,这为提高卵巢癌CDDP敏感性提供了新方向,为研究卵巢癌CDDP耐药发生机制提供了理论数据。
