非小细胞肺癌免疫治疗相关超进展预测分析
2023-05-07张梦高佳男张国俊常静侠
张梦,高佳男,张国俊,常静侠
(郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 450052)
肺癌是全球病死率最高的恶性肿瘤,约85%的患者病理类型是非小细胞肺癌(non-small cell lung cancer,NSCLC),对于晚期NSCLC,传统放化疗治疗效果有限,患者的5 a生存率不足5%[1-2]。近年来,肿瘤迈入“精准治疗”时代,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的诞生改变了晚期NSCLC治疗的格局,ICIs主要通过阻断T细胞的程序性死亡受体-1(programmed death-1,PD-1)与肿瘤细胞表达的程序性死亡受体配体-1(programmed death-ligand 1,PD-L1)结合或细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte antigen 4,CTLA-4)抗体与CD80(B7-1)的结合,改变肿瘤细胞的微环境,恢复T淋巴细胞的免疫功能,从而抑制肿瘤的免疫逃逸。目前多个PD-1/PD-L1抑制剂已获批用于晚期NSCLC的一线、二线治疗[3-4]。虽然ICIs在晚期NSCLC治疗中的优势毋庸置疑,也有报道称部分患者会出现短期内肿瘤快速进展的现象,在2016年,Chubachi等[5]首次报道了1例NSCLC患者接受免疫治疗后短期内出现了疾病的迅速进展。在2017年,Champiat等[6]首次将免疫治疗后肿瘤出现迅速进展的现象命名为超进展(hyperprogressive disease,HPD)。先前多项研究通过治疗失败时间(time to treatment failure,TTF)及影像学评估肿瘤生长率对HPD进行定义[7-9],但此定义存在一定的缺陷,如临床实践中往往无法获得完整的3次(ICIs前6周内、基线时、ICIs后8周内)影像资料,且忽视了临床状况(如体力状态)的变化、不同进展模式如远处转移、或非靶病灶进展情况。后Lo Russo等[10]的研究将体力评分、非靶病灶变化情况纳入,制定了临床及影像学标准。HPD并不是免疫治疗特有的现象,但对接受免疫治疗患者的预后结局有影响。目前对于NSCLC免疫治疗相关HPD危险因素的研究较少,为了避免ICIs治疗过程中的潜在风险,有必要积极探索与HPD发生相关的危险因素,本研究探究了晚期NSCLC患者免疫治疗相关的HPD,并对一些临床参数进行回顾性分析,旨在构建预测HPD发生的列线图评分系统,为临床医生早期识别高危患者提供参考。
1 对象与方法
1.1 研究对象纳入2019年1月至2021年6月在郑州大学第一附属医院接受免疫治疗的316例晚期NSCLC患者为研究对象,按照第8版国际肺癌TNM分期标准[11]进行临床分期。该研究征得医院医学伦理委员会批准,伦理批号为2023-KY-0029。
1.2 纳入标准(1)患者≥18岁;(2)经病理组织学或细胞学确诊为NSCLC,肿瘤TNM分期为ⅢB~Ⅳ期;(3)规律连续应用免疫治疗至少2个周期;(4)有2次CT影像学资料(基线时、用药后8周内),2次评估至少间隔2周;(5)基于实体肿瘤反应评估标准RECIST 1.1[12]判断目标病变变化。CT扫描结果由2名资深放射科医生进行评估。
1.3 排除标准(1)合并其他部位的原发性恶性肿瘤;(2)有严重的免疫系统疾病或精神疾病等;(3)心、肾、肝等重要器官严重功能障碍;(4)孕期及哺乳期妇女。
1.4 HPD标准(1)TTF<2个月;(2)基线和第1次放射学评估之间靶病灶直径总和至少增加50%;(3)基线和第1次放射学评估之间已经受累的器官中出现至少2个新进展;(4)基线和第1次放射学评估之间出现新的器官转移病灶;(5)临床症状恶化,治疗后2个月内东部肿瘤协作组体力状态评分(Eastern Cooperative Oncology Group performance status,ECOG PS)降低≥2分[13]。满足以上至少3个临床或放射学标准的患者被定义为HPD患者,而根据RECIST 1.1评估为肿瘤进展,但不满足以上至少3个标准的患者被定义为非HPD的肿瘤进展患者[10,14]。
1.5 研究方法检索郑州大学第一附属医院病历系统,回顾性收集患者的一般资料、影像及实验室检查、治疗方案及预后信息等,随访采用电话随访的形式。总生存时间(overall survival,OS)定义为接受免疫治疗至患者因任何原因死亡或随访结束的时间;无进展生存期(progression-free survival,PFS)定义为接受免疫治疗开始到评估疾病进展、死亡或随访结束的时间;TTF定义为从免疫治疗开始到因任何原因(包括副反应、进展、患者选择新的治疗方法或死亡)而停止治疗的持续时间。

2 结果
2.1 HPD与临床病理特征的关系共有316例接受PD-1/PD-L1抑制剂患者纳入本研究,根据上述HPD评价标准将患者分为非HPD组和HPD组。非HPD组与HPD组患者的性别、年龄、吸烟史、组织学类型、PD-L1表达、临床分期、肝转移、脑转移、区域淋巴结转移、是否放疗、EGFR、ALK、KRAS基因突变状态等方面差异无统计学意义(P>0.05)。非HPD组和HPD组T分期、转移位置数目、骨转移、对侧肺及胸膜转移、治疗方式比较,差异有统计学意义(P<0.05)。见表1。
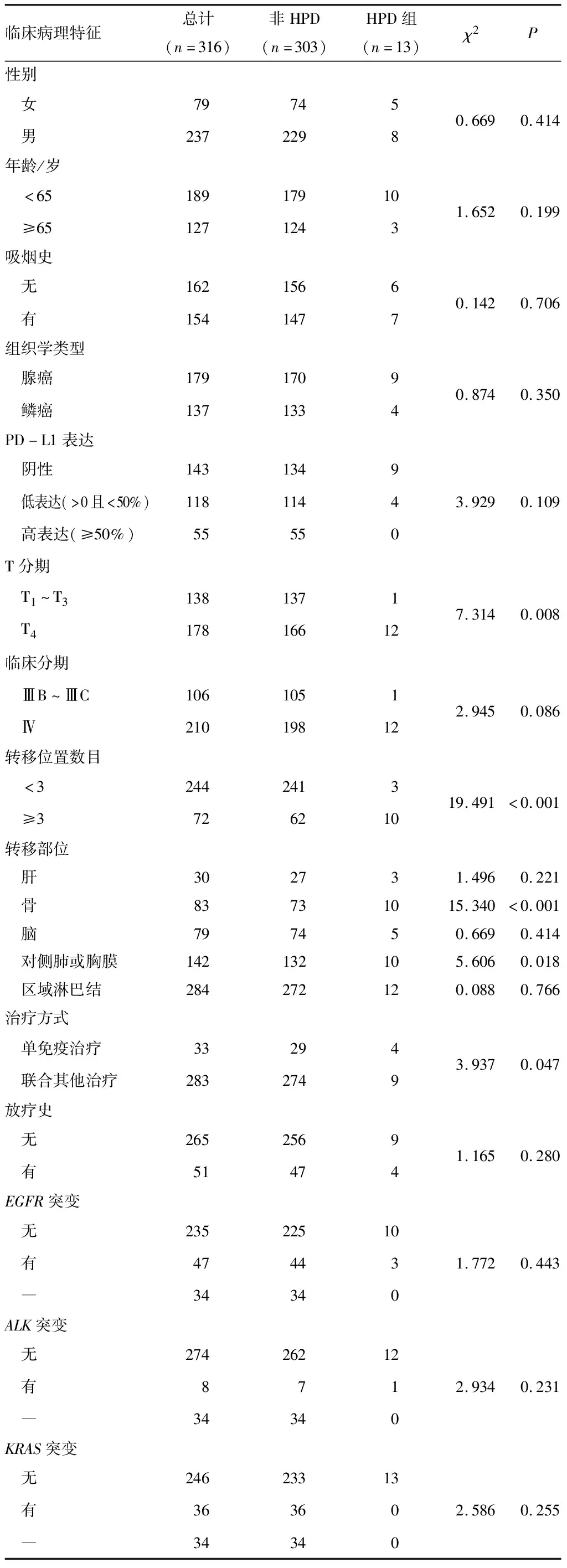
表1 HPD与临床病理特征的关系
2.2 各亚组生存及治疗反应状态HPD组的中位OS(4.0个月)较非HPD组(11.7个月)缩短(P<0.05)。非HPD组中疾病控制状态的患者中位OS为21.0个月,疾病进展患者中位OS为11.0个月,各亚组生存曲线见图1。ICIs治疗后首次评估显示,患者客观缓解率、疾病控制率分别为35.13%、86.08%,其中非HPD组患者1 a生存率为47.19%,HPD组患者的1 a生存率为7.69%。见表2。
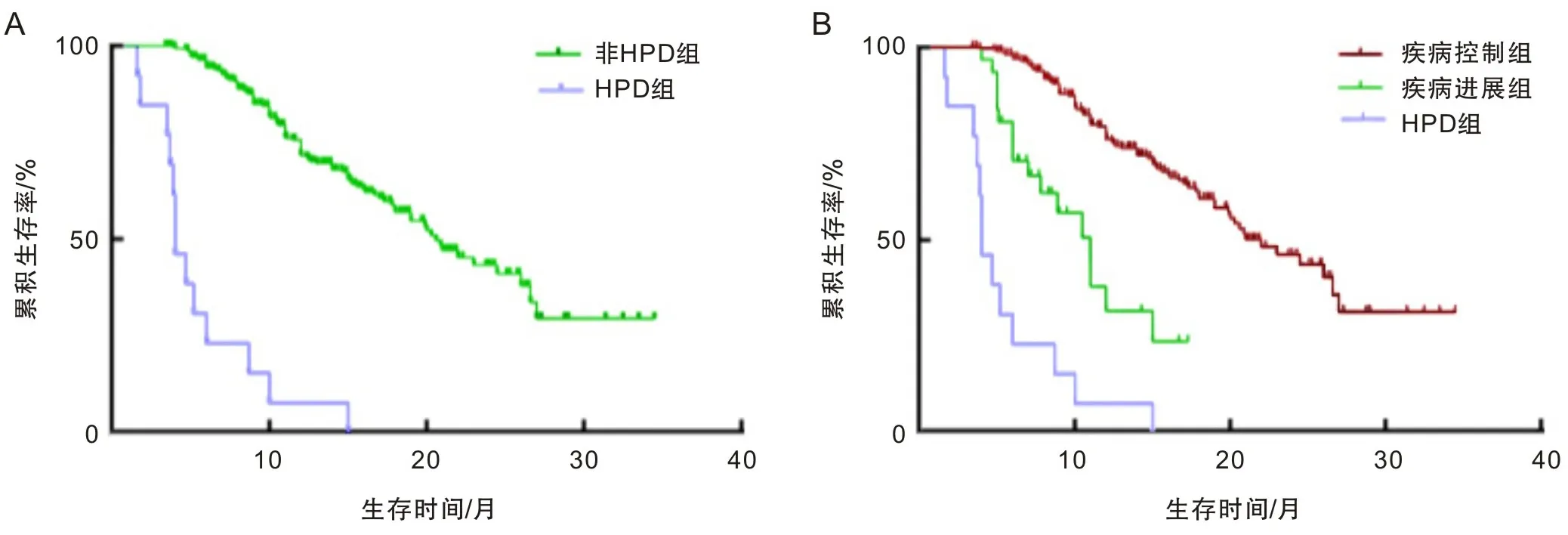
A为HPD组与非HPD组的Kaplan-Meier生存曲线;B为HPD组、疾病进展组和疾病控制组的生存曲线。
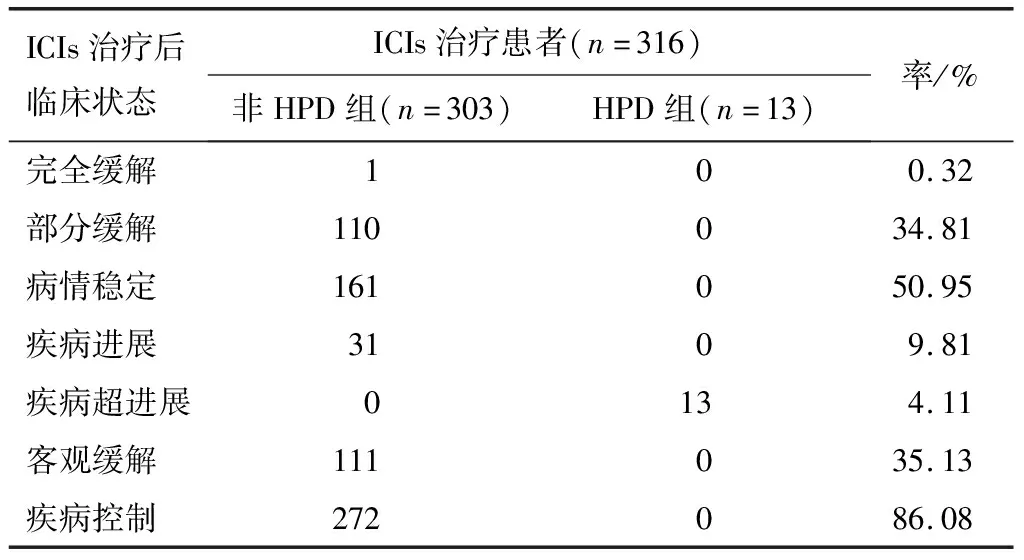
表2 ICIs治疗后首次评估患者的临床反应状态
2.3 晚期NSCLC患者免疫治疗相关HPD发生的影响因素单因素logistic回归结果显示,转移位置数目、乳酸脱氢酶(lactate dehydrogenase,LDH)基线值及变化量、糖类抗原125(carbohydrate antigen 125,CA125)、cyfra21-1基线值及首次评估时百分比变化、癌胚抗原(carcinoembryonicantigen,CEA)首次评估时变化率与HPD发生有关。对P<0.05的变量进行多因素logistic回归分析,结果显示转移位置数目≥3个、LDH变化量、CA125百分比变化是HPD发生的独立危险因素。见表3、4。

表3 自变量赋值情况说明
2.4 晚期NSCLC患者免疫治疗相关HPD的风险列线图建立及验证运用R语言对上述3个独立危险因素构建列线图预测模型。见图2A。ROC曲线分析列线图预测模型的预测能力,曲线下面积为0.95(95% CI为0.819~1.000),说明该模型预测能力良好。见图2B。使用Bootstrap对模型进行内部验证,获得校正曲线,3条曲线走向一致且靠拢,校正曲线表现良好,显示列线图模型与理想模型一致性尚可,并且经内部验证,结果显示模型具有良好的预测灵敏度。见图2C。
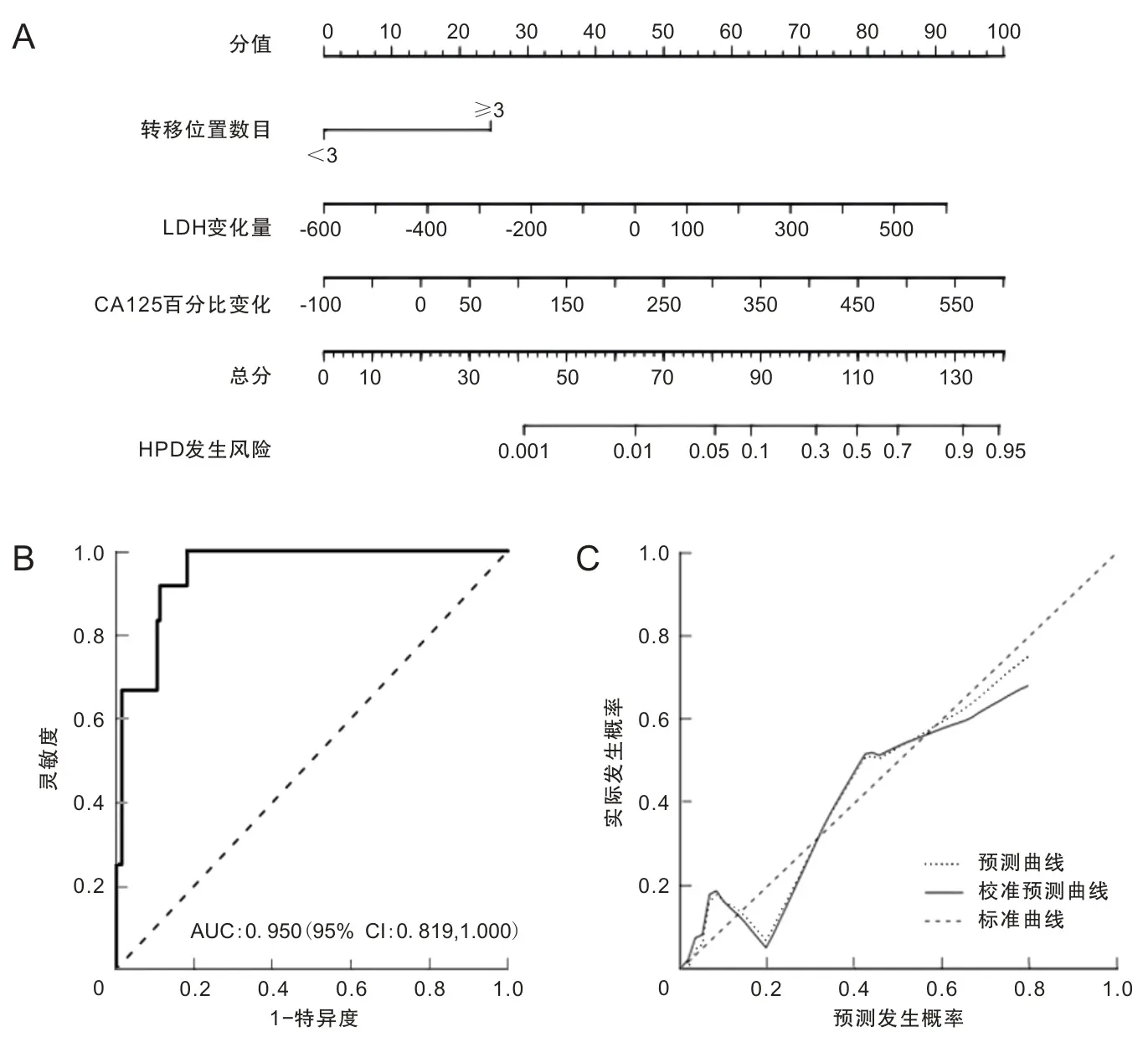
A为接受免疫治疗的NSCLC发生HPD风险的列线图;B 为HPD风险预测模型的ROC曲线;C 为HPD风险预测模型的校准曲线。
2.5 晚期NSCLC患者免疫治疗中的假性进展免疫治疗另一个特别的进展方式是假性进展,指初始评估时疾病进展,继续治疗达到完全或部分缓解或持续超过6个月的疾病稳定状态,病理主要表现为肿瘤周围免疫细胞浸润、水肿和坏死,一般不影响患者的生存结局[15]。本研究通过条形图描述了2种进展模式不同的治疗反应,结果显示316例接受免疫治疗的NSCLC患者有13例(4.11%)发生HPD,3例(0.95%)发生假性进展。见图3。
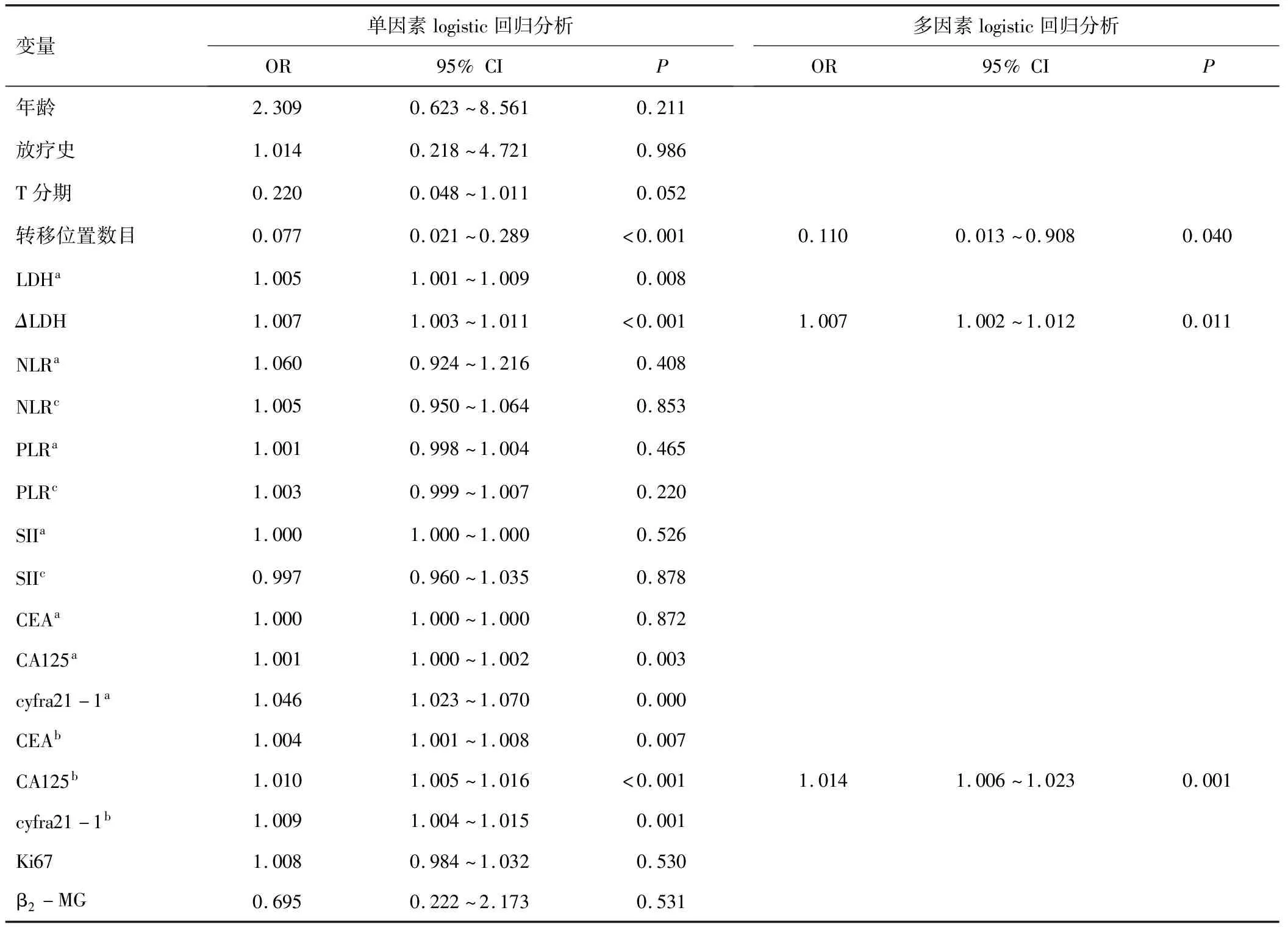
表4 晚期NSCLC的病理参数与HPD发生的单因素及多因素回归分析
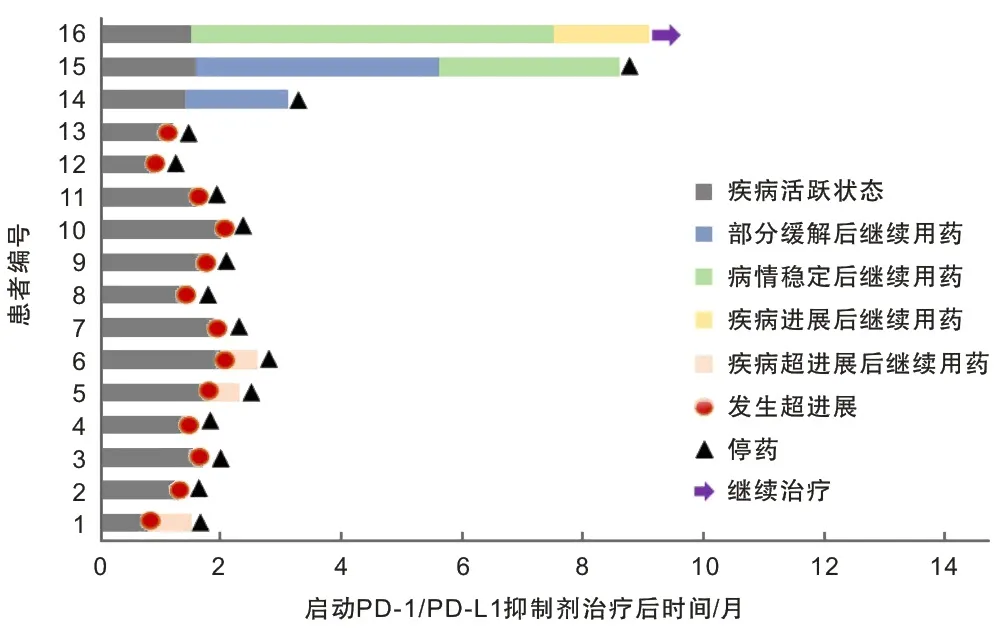
1~13为HPD患者,14~16为假性进展患者。
3 讨论
免疫治疗主要通过阻止肿瘤的免疫逃逸发挥作用,研究表明阻断PD-1/PD-L1通路能够恢复T淋巴细胞的活性,发挥免疫系统抗肿瘤的作用[16]。多项临床研究已经证明无论PD-1或PD-L1表达状态如何,晚期NSCLC患者均可在免疫治疗中获益[17-19]。
HPD是指ICIs治疗后短期内出现肿瘤负荷迅速增大或临床症状迅速恶化,组织病理学常表现为肿瘤细胞的增殖,发生HPD的患者往往预后极差[20]。HPD的发生可能与ICIs阻断PD-1/PD-L1后调节性T淋巴细胞上调、效应T细胞耗竭介导抑制性的肿瘤微环境、免疫抑制性细胞因子分泌增加以及致癌通路的激活直接影响肿瘤细胞等有关[15]。HPD的发生究竟是与免疫治疗相关还是只是肿瘤生长的自然现象尚存在争议。
Kim等[21]对多种恶性肿瘤免疫治疗期间的HPD现象进行荟萃分析,发现与HPD相关的临床病理指标分别是高于正常值上限的LDH、2个以上转移部位、肝转移、ECOG PS评分≥2分、PD-L1表达状态。在其他研究中,年龄≥65岁、实验室检查如NLR、LDH水平等也与HPD的发生相关[6,22-23]。本研究中转移位置数目≥3个、LDH变化量、CA125变化率是HPD发生的独立危险因素,同时根据上述危险因素构建预测HPD发生的列线图评分系统。已有研究证明基线时较高的LDH与抗PD-1/PD-L1治疗期间HPD的高风险相关,血清LDH升高已被确定是肿瘤预后不良的标志物,LDH升高反映肿瘤组织缺氧和细胞外环境的酸化,而高LDH水平和酸性的环境可能会导致肿瘤细胞增殖、抗凋亡能力增强,并影响抗体的功能和抗原的构象,从而影响ICIs的特异性和亲和力[24-25]。CA125是一种应用广泛的肿瘤标志物,NSCLC患者血清中CA125的阳性率较高,虽然多数患者会出现CA125的升高,但其短期内升高的百分比是预测HPD发生的有效预测因子,本研究发现接受免疫治疗的NSCLC患者短期内LDH及CA125升高程度可能对HPD的发展具有指示性作用。
多研究表明相较于联合化疗或抗血管治疗,单药ICIs治疗的患者HPD发生率较高,化疗及抗血管生成药物与免疫治疗具有协同作用,能够提高抗肿瘤活性[22,25]。对于HPD的高危患者应避免单药免疫治疗,联合化疗或抗血管治疗可能降低HPD发生的风险,此外发生HPD后的化疗和/或抗血管生成药物的挽救治疗可能为患者带来生机,对于HPD高危患者,评估间歇可适当缩短,并尽早进行影像学评估或病理活检,早期识别HPD现象能够最大限度地使HPD患者获益于免疫治疗后的挽救治疗。HPD的危险因素及发生率在现有不同研究中结果不完全一致,可能与样本量较小或评价标准不一致有关,对于免疫治疗相关的HPD现象需要更大样本的深入研究。
综上所述,本研究探索了晚期NSCLC患者免疫治疗相关的HPD,并对一些临床参数进行基线时和用药两周期动态评估,发现转移位置数目≥3个、LDH变化量、CA125百分比变化是HPD发生的独立危险因素,根据HPD发生的高危因素,构建了预测HPD发生的列线图预测模型,将有助于为临床医生的治疗决策提供参考。
