TiO2纳米管阵列负载依布硒缓释体系的优化构建及成骨活性初探
2023-05-06束长青姚正华
束长青,姚正华,邱 憬
如今种植义齿已成为缺失牙齿的重要修复方式, 而如何促进种植体表面更快更好地形成骨结合一直是国内外研究的热点。近年来,随着钛种植体表面改性技术的不断发展,在钛种植体表面构建有效的局部载药释放体系逐渐引起关注[1-2]。
相比于纯钛表面,采用阳极氧化法制备的TiO2纳米管(TiO2nanotubes,TNT)具有极佳的亲水性、更大的比表面积,能有效增强成骨细胞与钛表面的黏附[3-5]。同时,由于TNT具有整齐均一、疏松多孔的纳米级蜂窝阵列结构且底部自然封闭,管长、管径均可控,故可作为吸附药物以及其他生物活性分子的优良载体[1-2,6-7]。
依布硒(Ebselen,EB)是一种小分子有机硒化合物,具有还原活性,在医学研究中常作为谷胱甘肽过氧化物酶(GPx)出现[8-9]。EB可通过催化多个反应保护细胞免受氧化和自由基损伤[10]。作为一种多效性分子,它可直接或间接地与细胞内的许多分子靶点相互作用。已有研究表明,EB能参与多种生物学途径,如基因组稳定性[11]、细胞凋亡[12]、免疫调控[13]、细胞运输[14]。EB在许多疾病的治疗中取得了良好效果,如减缓缺血-再灌注引起的神经细胞死亡[15],治疗糖尿病相关疾病[16]、心脏疾病[17],适宜情况下还可作为有效的抗菌药物[18]和化疗药物[19]。Baek等[20]报道发现,EB可通过抑制RANKL诱导的破骨细胞分化和内毒素诱导的炎症性骨破坏预防骨丢失,提示EB具有潜在的骨再生调控作用。
然而,由于EB溶解度低等问题,临床试验中常以体内注射的形式给药,因而EB的使用受首关消除和血清白蛋白的影响较大[21-24]。针对这一难点,为了解决EB理化性质的局限性,更好地发挥其骨再生潜能,本研究拟在TNT优良载药性能的基础上,制备TNT-EB复合材料,检测载入不同质量EB后TNT的载药能力及缓释特征,并初步探究其促成骨性能,为新一代种植体表面药物缓释体系的构建和研发提供实验依据。
1 材料与方法
1.1 实验材料和设备
商业纯钛(99.5%,Alfa Aesar,英国),碳化硅砂纸(鹰牌,中国),无水乙醇、乙二醇、氢氟酸、氟化铵(分析纯,国药,中国),小鼠前成骨细胞系 MC3T3-E1细胞(中国科学院细胞库,中国),CCK-8(Beyotime,中国),α-MEM培养基、胎牛血清、青霉素-链霉素双抗溶液(Gibco,美国),RIPA裂解液(Leagene,中国),BCA试剂盒、碱性磷酸酶(ALP/AKP)试剂盒(南京建成,中国),分析天平(梅特勒,瑞士),可调直流稳压电源(Maisheng,中国),扫描电镜(SEM,Tescan MAIA 3 GMU,捷克),倒置显微镜(Leica,德国),紫外-可见光分光光度计(UV-6100S,上海元析,中国),多功能酶标仪(SpectraMAX M2e,MD,美国),化学发光凝胶成像系统(GE,美国),超声清洗机(PS-20,Duradsonic,中国),冻干干燥机(FreeZone,Labconco,美国)。
1.2 试件制备
将钛箔加工成10 mm×10 mm、厚度0.25 mm的1 cm2纯钛试件,用SiC砂纸按400、600、800、1 000、1 200、1 500目逐级打磨抛光,每次打磨至前1次打磨痕迹消失,去离子水超声清洗5 min。在阳极氧化之前,将纯钛试件在体积分数为1% HF溶液中浸泡30 min以去除天然氧化层,体积分数为75%乙醇溶液及去离子水交替超声清洗,每次5 min,置于氮气中干燥。在含有质量分数为0.3%(NH)4F + 2% (体积分数)H2O的乙二醇电解液体系中,以铂片为阴极在60 V恒压条件下阳极氧化1 h,随后立即用去离子水漂洗试件1 min,超声清洗1 min,置于氮气气流中干燥后备用。
1.3 实验分组和药物负载
将5 mg EB粉末溶解于1 mL二甲基亚枫(DMSO)中,再加入9 mL无水乙醇稀释成0.5 g/L的EB混合液。将适量EB混合液加载至TNT表面并铺展均匀,随后置入冻干干燥机中,抽真空,在-50 ℃温度下持续冷冻干燥1 h,重复以上加载EB的步骤,直至TNT负载EB的质量分别达到1、3、5、7、9 μg,置于4 ℃冰箱中密封备用。
1.4 材料形貌观察及元素分析
每组随机选择3枚试件,使用SEM观察试件表面的微纳米形貌,同时使用X射线光电子能谱仪(energy dispersive spectroscopy,EDS)分析负载EB后试件表面的元素组成。
1.5 药物释放检测
在室温下将负载EB的TNT钛片浸泡于4 mL磷酸缓冲盐溶液(phosphate buffered saline,PBS)中,在第2、4、6、8、10、12、18、24小时用移液枪吸取0.5 mL缓冲溶液于石英比色皿中比色,使用紫外-可见光分光光度计在259 nm波长处测定释放的EB浓度,每个时间点检测3个样本。
1.6 细胞培养
体外复苏MC3T3-E1细胞后,加入α-MEM完全培养基(含10% FBS胎牛血清、1%青霉素-链霉素双抗溶液),置于恒温培养箱(恒温37 ℃、湿度95%、5% CO2)中培养,每2~3 d换液,使用倒置显微镜观察细胞状态,当细胞密度达80%后传代。
1.7 CCK-8法检测细胞增殖活性
将MC3T3-E1细胞(3×104个/孔)接种于96孔板中,每孔加入100 μL含不同浓度EB的完全培养基(0、1、5、10、20、50 μmol/L),每组设4个复孔。培养1、3、6 d后,向微孔板内加入CCK-8液,恒温37 ℃孵育2 h。采用多功能酶标仪在450 nm波长处测定光密度(OD)值,OD值越高表示细胞增殖活性越好。
1.8 碱性磷酸酶(alkaline phosphatase,ALP)检测
将MC3T3-E1细胞(2×105个/孔)接种于12孔板中,每孔加入2 mL含不同浓度EB的完全培养基(0、1、5、10 μmol/L),每组设3个复孔,细胞培养7 d后,加入RIPA裂解液,冰上裂解0.5 h,使用细胞刮和移液枪收集裂解液,14 000 r/min离心后取上清液,使用BCA试剂盒测定蛋白浓度,再使用碱性磷酸酶试剂盒检测ALP活性。
1.9 茜素红染色(alizarin red staining)及定量
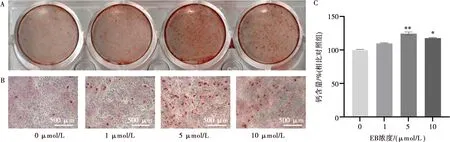
将MC3T3-E1细胞(2×105个/孔)接种于12孔板中,每孔加入2 mL含不同浓度EB的完全培养基(0、1、5、10 μmol/L),每组设3个复孔。在成骨诱导21 d后,PBS洗涤,用4%多聚甲醛固定30 min,双蒸水洗涤。在每孔中加入1 mL茜素红S显色剂,5 min后终止反应,双蒸水洗涤。对矿化染色结果进行摄影和显微镜观察。吸净双蒸水后室温晾干,每孔加入1 mL的10%氯化十六烷吡啶,室温孵育30 min,移液器转移至96孔板后采用多功能酶标仪在562 nm波长处测定各孔OD值,OD值越高表示钙含量越高,矿化越显著。
1.10 蛋白印迹法检测成骨功能蛋白表达
将MC3T3-E1细胞(2×105个/孔)接种于12孔板中,每孔加入2 mL含不同浓度EB的完全培养基(0、1、5、10 μmol/L),每组设3个复孔。培养7 d后,加入RIPA裂解细胞提取蛋白,使用BCA试剂盒测定蛋白浓度。采用蛋白印迹法(Western blot,WB)检测各组成骨细胞中Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、骨桥蛋白(osteopontin,OPN)、骨钙蛋白(osteocalcin,OCN)的表达水平,以GAPDH为内参。
1.11 统计学方法
使用SPSS 22.0统计软件对所获各组检测数据进行方差齐性检验,显示数据方差齐,进行单因素方差分析和SNK多重比较,当P<0.05时表示差异具有统计学意义。
2 结 果
2.1 表面微形貌
SEM观察各组试件表面的微纳米形貌如图1所示。低倍镜下,5组均可见少量微米级沟壑,随着EB加载量的增加,TNT表面逐渐出现EB晶体堆积。高倍镜下可见5组载药试件表面的纳米管阵列结构,管径约120 nm,1、3、5 μg组未见EB在管口堆积,纳米管拓扑结构完整清晰,而当EB加载量超过5 μg后,可见不同程度的EB结晶堆积。

A、F:负载1 μg EB组;B、G:负载3 μg EB组;C、H:负载5 μg EB组;D、I:负载7 μg EB组;E、J:负载9 μg EB组;K:TNT侧面观;A~E: ×10 000;F~K: ×100 000
2.2 表面元素组成
采用EDS检测各组试件加载EB后的表面元素组成,结果见图2。5组试件表面均以钛元素为主,并有少量金、碳和氧元素。金元素源于试件检测前的喷金处理,碳元素源于EB及检测时可能存在的碳污染。EDS分析显示,5组试件表面均存在微量硒元素,且含量依次递增。TNT负载EB后的EDS面扫分析图谱如图3所示,可见特征性硒元素均匀散在分布于纳米管表层结构内,结合SEM观察可知,硒元素的分布不影响纳米管拓扑结构。
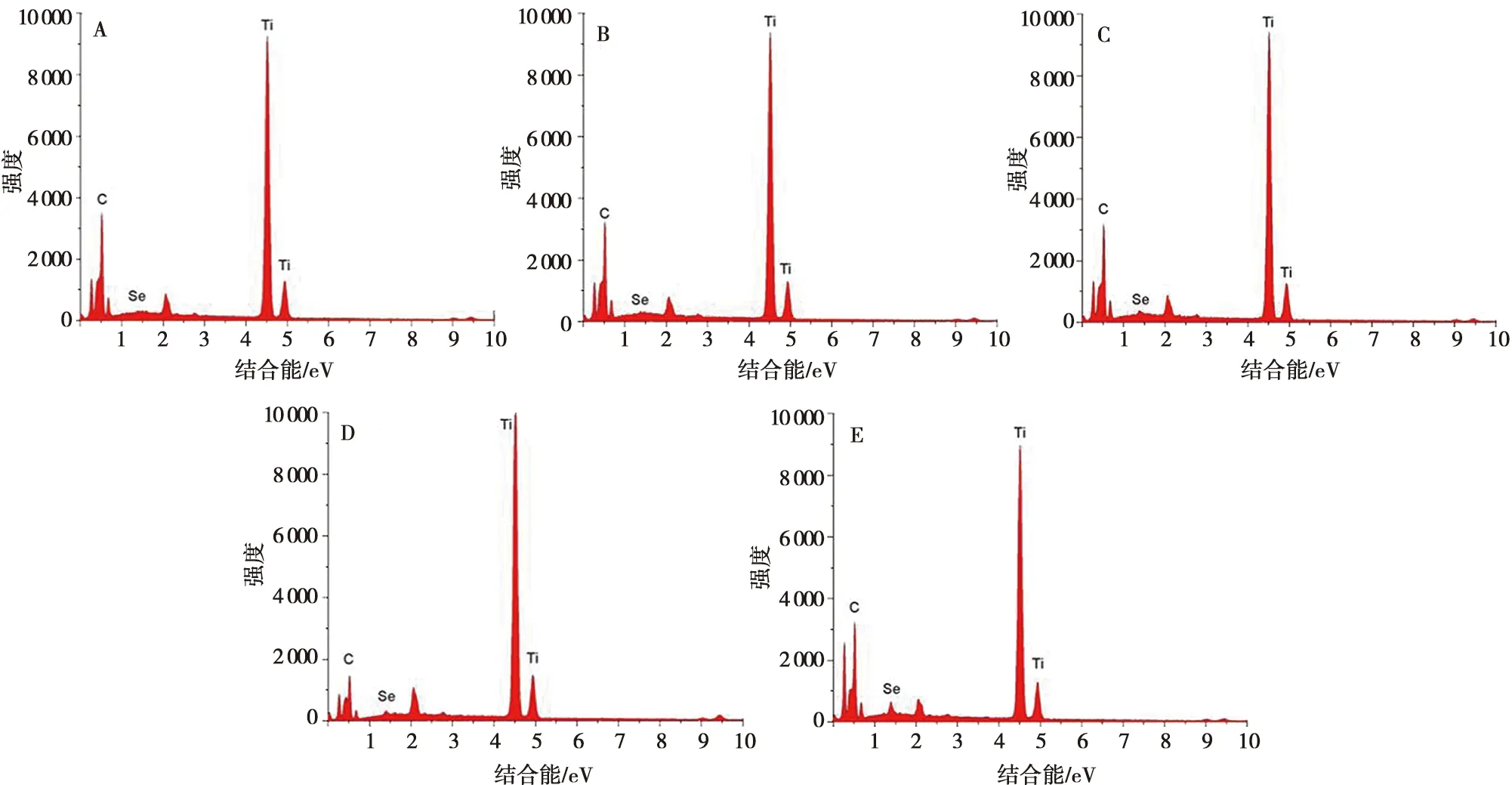
A:负载1 μg EB;B:负载3 μg EB;C:负载5 μg EB;D:负载7 μg EB;E:负载9 μg EB
2.3 药物释放曲线
如图4所示,在12 h以内EB的突释较为明显,释放量逐渐增加,第8至12 h期间EB释放速度有所减慢,第12至18 h期间仍有少量EB释放,至24 h EB接近完全释放。

图3 TNT负载EB后的EDS面扫分析代表性图谱( ×10 000)Fig.3 Representative EDS surface mapping image of TNT loaded with EB( ×10 000)
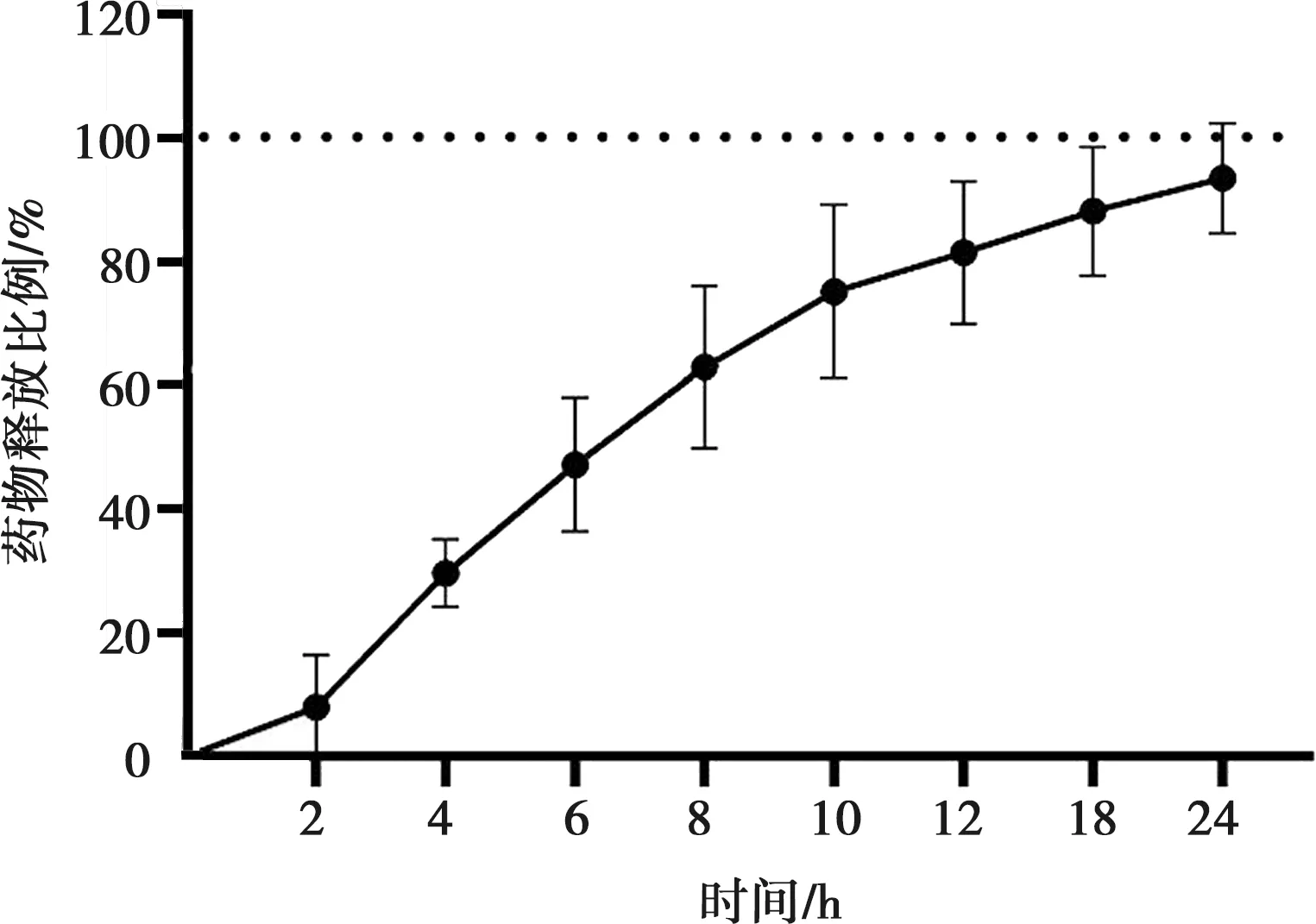
图4 磷酸盐缓冲液中的药物释放曲线Fig.4 Drug release diagram in phosphate buffered saline
2.4 细胞增殖活性
不同浓度EB条件下MC3T3-E1细胞增殖活性检测结果见图5。在细胞培养第1天,5 μmol/L组的OD值相对空白对照组有明显提升(P<0.01)。在细胞培养第3天和第6天,5 μmol/L组和10 μmol/L组的OD值均显著高于空白对照组(P<0.05),50 μmol/L组较空白对照组OD值降低(P<0.05),其中,5 μmol/L组的OD值最高(P<0.01),表明该组细胞的增殖活性最佳。
2.5 碱性磷酸酶(ALP)活性
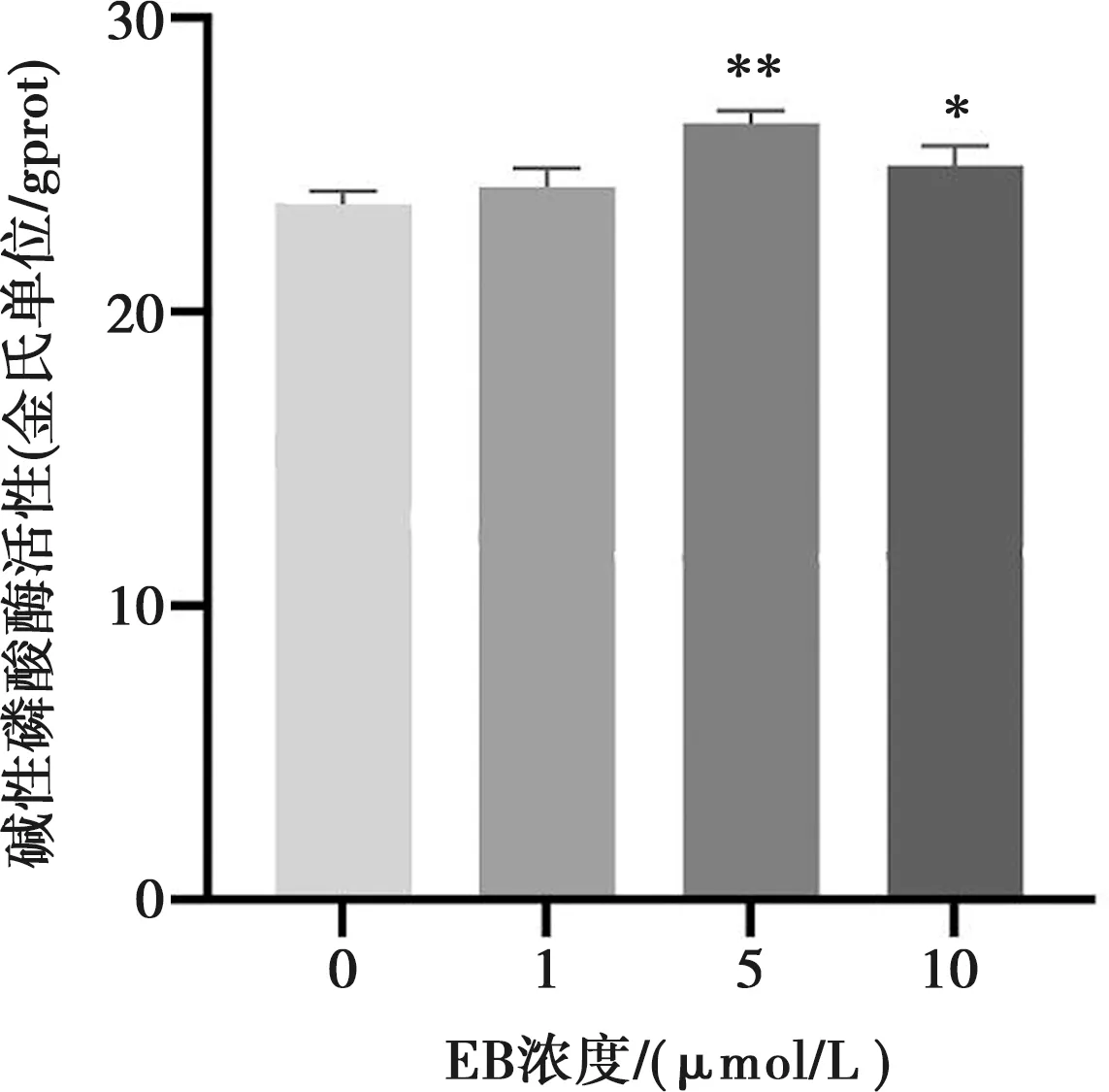
MC3T3-E1细胞的ALP活性检测结果见图6。培养7 d后,5 μmol/L组和10 μmol/L组ALP活性明显高于空白对照组(P<0.05),其中,5 μmol/L组的ALP活性更高(P<0.01)。
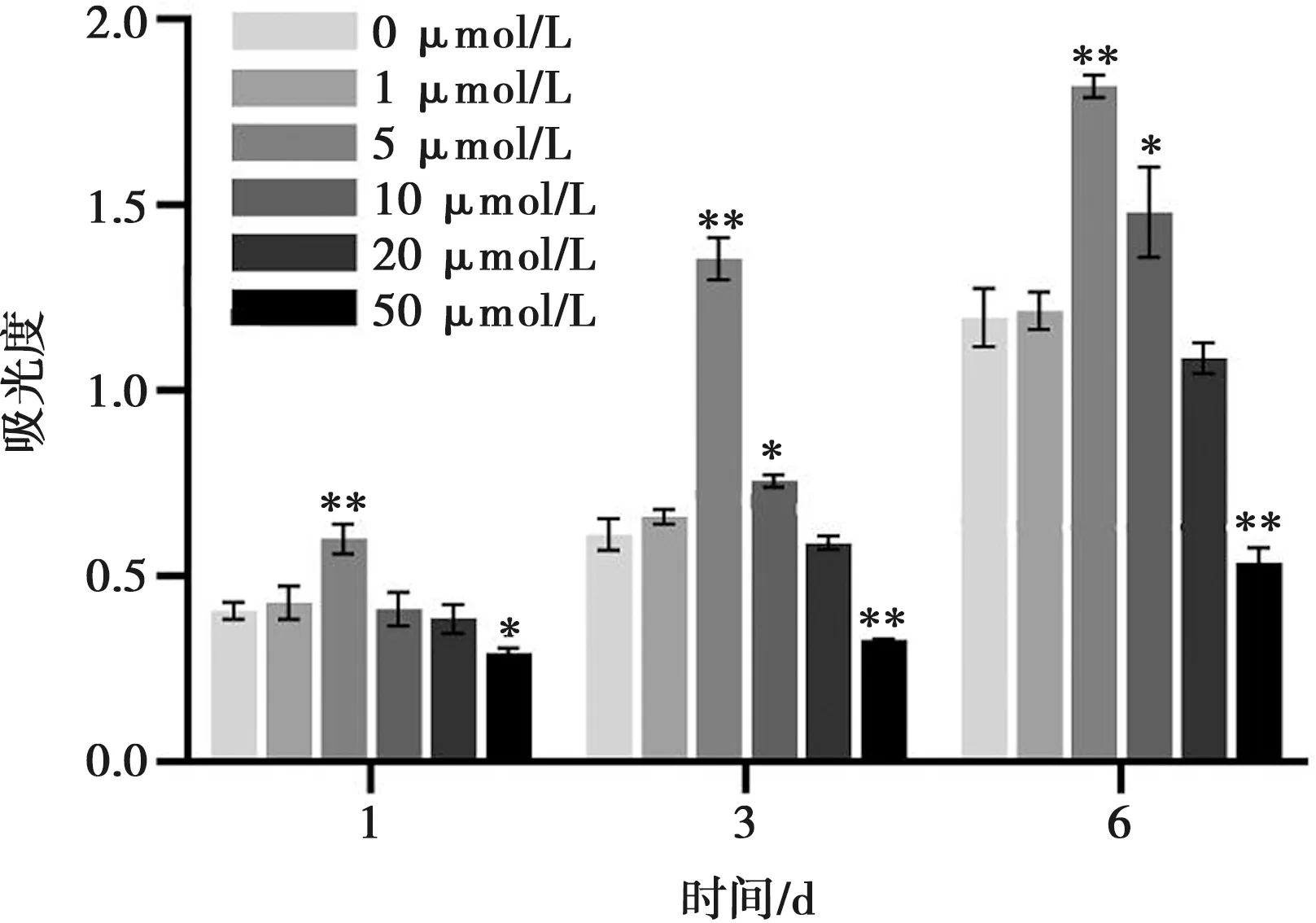
与0 μmol/L(空白对照组)比较,*:P<0.05;**:P<0.01,n=4
2.6 矿化结节染色及钙含量
矿化结节的茜素红染色结果见图7A~B,显微镜下可见各组细胞间均有橘红色的不透明矿化结节。相比于空白对照组,5 μmol/L组和10 μmol/L组均能够有效促进MC3T3-E1细胞的钙盐沉积和矿化,以5 μmol/L组效果最佳,矿化结节数量多且体积较大。不同浓度EB组的钙含量见图7C,5 μmol/L组和10 μmol/L组的钙含量均高于空白对照组(P<0.05),其中,5 μmol/L组的钙含量更高(P<0.01),表明其矿化程度更高。
与0 μmol/L(空白对照组)比较,*:P<0.05;**:P<0.01,n=3
2.7 成骨功能蛋白的表达
MC3T3-E1细胞在含不同浓度EB的完全培养基中培养7 d后的成骨功能蛋白表达见图8。1、5、10 μmol/L组的Runx2、OPN、OCN蛋白表达均明显高于空白对照组,其中,5 μmol/L组的成骨功能蛋白表达水平最高。
A:扫描仪图像;B:光学显微镜观察图像;C:钙含量分析结果;与0 μmol/L(空白对照组)比较,*:P<0.05;**:P<0.01,n=3
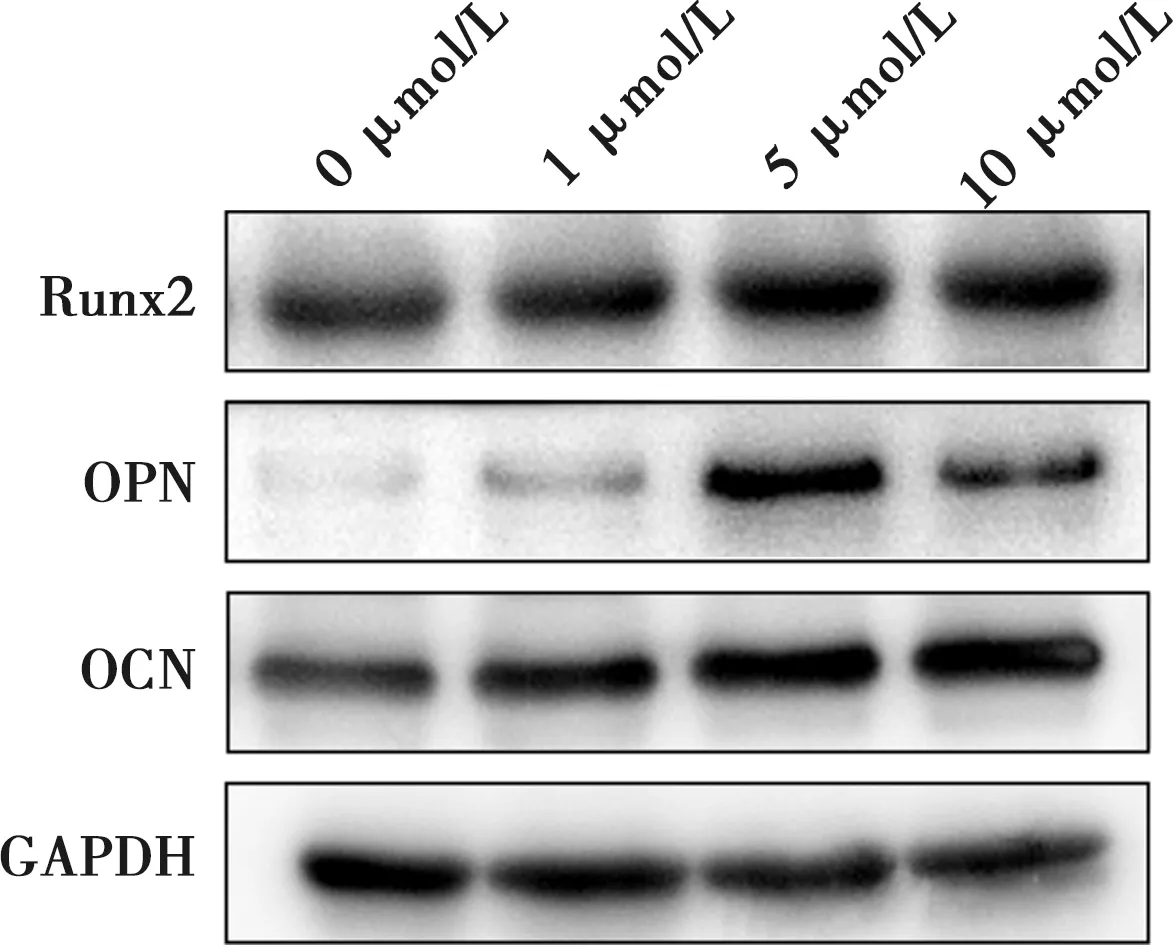
图8 不同EB浓度组MC3T3-E1细胞的成骨功能蛋白表达Fig.8 Osteogenic-related protein expressions of MC3T3-E1 cells in groups with different EB concentrations
3 讨 论
钛是用于制作口腔种植体的最常见金属,而在钛表面进行改性以促进种植体的骨结合一直以来是国内外研究的热点[25-26]。TNT具有纳米级多孔阵列结构,比表面积高,可促进成骨细胞黏附、羟基磷灰石沉积和骨结合。此外,因其管径、管长可控、机械刚性高、化学性能稳定等特点常被用于局部药物缓释体系的构建[6]。
EB是一种低分子质量有机硒化合物,在体内代谢过程中没有单质硒释放,避免了人们对其毒性的担忧[27]。有研究发现,EB能够抑制RANKL诱导的破骨细胞分化和内毒素诱导的炎症性骨破坏,这为其调控骨代谢过程的可能性提供了实验依据[20]。EB可催化多个基本反应保护细胞免受氧化和自由基的损伤[10],且低于25 μmol/L的EB及其衍生物对MC3T3-E1细胞无毒性作用。然而截至目前,有关EB直接促进成骨性能的研究尚鲜有报道,究其原因,可能是EB存在溶解度低以及易与血清白蛋白结合的局限性所致[21-24]。传统全身用药往往存在一些难点,如疗效低、生物利用度和生物分布差、缺乏选择性、非靶向组织的药物过量和毒性等。为了提高药物疗效,减少药物的全身不良反应,局部给药被认为是一种很有前景的替代方案。局部给药具备许多潜在优势,例如使其他部位的健康细胞或邻近组织不受影响,避免严重的不良反应,优化生物利用度,药物不会被迅速分解和清除,尤其是肝脏代谢[2,7]。因此,本实验构建的TNT负载EB缓释体系可有效发挥局部给药的优势,为探究EB的促成骨性能奠定了良好的实验基础。
TNT的载药能力可通过纳米管结构参数(管径、管长)和钛种植体的尺寸来调节[28],以满足不同的临床治疗需求,具体取决于药物、种植体、骨组织和药物靶向的特定条件。本实验为了最大化其载药能力,制备了孔径120 nm、长度2 μm的二氧化钛纳米管(图1)。我们使用冻干法,按载药量由低到高的顺序依次在TNT内成功加载了1、3、5、7、9 μg的EB,并通过SEM和EDS进行表征。结果显示,当EB加载量≤5 μg时 TNT管口未见结晶堆积,这确保了TNT纳米级多孔阵列结构的完整性。随后通过EDS面扫分析明确了EB在TNT表面分布的均匀性,因此,有理由认为5 μg/cm2以下是合理的EB负载范围。由于天然松质骨中充满三维网状孔隙,其中含有丰富的间质液体[7],我们采用磷酸盐缓冲液体系进行体外药物释放的模拟。从药物释放曲线可见,EB缓释体系具有先快后慢的特征,总体上趋于平缓,这一特点与Gulati等[29]的研究结果一致。值得一提的是,虽然本实验使用钛箔作为阳极氧化基底,但在医用钛或钛合金种植体表面可以同法制备TNT。
根据Singh等[30]的研究报道,我们设立了6组不同的EB浓度进行细胞增殖活性检测,结果显示,10 μmol/L以下浓度的EB对MC3T3-E1细胞的增殖活性具有促进作用,20 μmol/L以上浓度的EB则会抑制细胞增殖。我们分析了不同浓度EB培养条件下MC3T3-E1细胞对成骨功能蛋白的表达。Runx2、OPN、OCN分别是骨形成不同阶段的标志物,其中,Runx2和OPN在骨形成早期具有特征性作用[31-32],而OCN参与细胞外基质的沉积,被视为成骨细胞分化的晚期标志物[33]。WB的检测结果表明,1、5、10 μmol/L浓度EB培养条件下MC3T3-E1细胞对Runx2、OPN、OCN的表达均有所增加,其中5 μmol/L组细胞的蛋白表达水平上升最为显著。该发现与ALP活性检测以及茜素红染色实验结果保持一致,而ALP是前成骨细胞向成骨细胞分化的重要标志物[34]。对上述研究结果进行总结可知,5和10 μmol/L浓度的EB可有效促进成骨细胞分化,其中5 μmol/L浓度EB的促成骨效果更佳。
TNT负载EB缓释体系的体外实验明确了TNT的最大载药密度(5 μg/cm2)以及促成骨的EB最佳浓度(5 μmol/L),已知药物浓度取决于溶质质量和溶剂体积,因此,当1 cm2的TNT负载最大质量的EB后,理论上可在24 h内使3.65 mL组织液达到最佳促成骨浓度。有研究表明,成人新鲜骨松质内组织液占总质量的50%~60%[35],而成人骨密度约为1.2 g/cm3,基于该数据可以推测,每立方厘米的骨松质中,TNT表面的EB加载量为0.8~1.0 μg时,即可在24 h内达到最佳促成骨浓度且不影响TNT拓扑结构。
综上所述,我们通过阳极氧化法在钛基底表面制备出管径120 nm、管长2 μm的TNT,采用冻干法构建了TNT负载EB缓释体系,再通过体外实验进行优化筛选,发现当TNT负载EB<5 μg/cm2时纳米管拓扑结构完整,且EB浓度在5 μmol/L时体外成骨活性最佳。但该缓释体系的体内成骨活性还需进一步的动物实验予以验证。
