FBXW7过表达对棕榈酸诱导C2C12细胞萎缩及焦亡的作用及机制研究
2023-05-05付婉瑞古再丽努尔卡德尔何雅琦冯颖
付婉瑞,古再丽努尔·卡德尔,何雅琦,冯颖
复旦大学附属华东医院营养科,上海 200040
肌少症性肥胖(sarcopenic obesity, SO),即过度肥胖伴肌肉质量或功能低下,在65岁及以上老年人群的患病率已高达11%[1],作为一种肥胖与肌少症共存的疾病,两者互为因果,且与多种慢性非传染性疾病的高发有关。研究表明, SO是老年人衰弱、代谢紊乱、住院和死亡的独立显著的危险因素[2]。焦亡(pyroptosis)是一种新近发现的程序性细胞死亡方式,不同于细胞凋亡,其特征为细胞膜结构完整性的破坏,以及细胞内容物释放激活的强烈炎症反应。肥胖和衰老可激活焦亡通路,后者在SO相关的全身性低度炎症及众多并发症中扮演着重要的角色[3-4]。F框/WD-40域蛋白7(F-box and WD-40 domain protein 7, FBXW7)是一种拥有7串联WD40重复结构域的F-box蛋白,可直接识别并泛素化多种底物,作为肿瘤抑制因子得到了广泛的研究。而近年来不少的研究发现, FBXW7还可调节脂质代谢并发挥炎症抑制作用[5-6]。由此,探究FBXW7对焦亡通路的调节作用,可为SO防治策略提供新思路。
1 材料与方法
1.1主要试剂与仪器FBXW7过表达慢病毒及对照慢病毒载体(由上海吉凯基因医学科技股份有限公司构建);胎牛血清(美国Gibco, 10091148);高糖DMEM培养基(中国思拓凡, SH30243.01);马血清(中国美伦公司, MB2968);棕榈酸钠(美国sigma, P9767-5G); MG132(中国源叶公司, S42096); FBXW7抗体(美国Novus Biologicals, NBP2-50403);环己酰亚胺&ASC抗体(均购自美国CST, 2112S&67824T);GSDMD抗体(英国Abcam, ab209845); FBX32抗体&NF-κB p65抗体(均购自中国爱博泰克公司, A6825&A10609); SDS-PAGE凝胶制备试剂盒(中国雅酶公司, PG212); CCK-8试剂盒、苏木素与伊红染色液、改良油红O染色试剂盒、 RIPA、 GAPDH抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L)、牛血清白蛋白、β-半乳糖苷酶染色试剂盒、 NLRP3抗体、 CASP1抗体、 P21抗体(均购自中国碧云天公司,货号分别为C0038、 C0107 &C0109、 C0158M、 P0013B、 AF1186、 A0208、 ST025、 C0602、 AF2155、 AF1681、 AF5252);多功能酶标仪(美国Bio-tek);凝胶成像系统(美国Bio-Rad);倒置常规显微镜(日本尼康);共聚焦显微镜(德国徕卡)。
1.2细胞培养小鼠C2C12细胞系(小鼠成肌细胞, FH0345)购自上海富衡生物科技有限公司。C2C12细胞首先培养于完全培养基中(含10%胎牛血清, 1%青霉素-链霉素双抗的高糖DMEM培养基),当细胞达到80%汇合度时,更换为分化培养基(含2%马血清, 1%青霉素-链霉素双抗的高糖DMEM培养基)继续培养4~5 d。
1.3细胞活力检测CCK-8选用10%牛血清白蛋白(bovine serum albumin, BSA,不含脂肪酸与IgG)溶解棕榈酸钠(palmitate, PA),干预C2C12细胞24 h构建SO细胞模型[7]。
筛选PA的工作浓度。96孔板中有提前接种细胞(5 000 cell/100 μL/孔)及无细胞的接种孔,每孔加入200 μL不同浓度PA溶液或对照BSA溶液,干预24 h后进行CCK-8测量:弃去旧培养基,每孔加入10% CCK-8溶液200 μL,继续培养1 h,然后取出96孔板在450 nm波长下测定吸光度。细胞活力计算:细胞活力=[A(PA)-A(空白)]/[A(PA对照)-A(空白)]
A(PA):具有细胞、 CCK-8溶液和PA溶液的孔的吸光度。
A(空白):具有培养基和CCK-8溶液而没有细胞的孔的吸光度。
A(PA对照):具有细胞、 CCK-8溶液和PA对照溶液的孔的吸光度。
1.4FBXW7过表达使用FBXW7过表达慢病毒(FBXW7)及对照慢病毒载体(CMV enhancer-MCS-3flag-polyA-EF1A-zsGreen-sv40-puromycin, FBXW7-vec)转染C2C12细胞72 h后,使用含嘌呤霉素的培养基筛选已成功转染慢病毒的C2C12细胞;再选用嘌呤霉素浓度递减为工作浓度的1/2~1/4的培养基,继续对转染后的C2C12细胞进行筛选和扩增,收集稳定过表达FBXW7的C2C12细胞进行后续实验。
1.5苏木素伊红(hematoxylinandeosin,HE)染色培养皿中先加4%多聚甲醛室温固定15 min,再加苏木素染色液染色5~10 min,然后用蒸馏水洗去多余的染料。随后加盐酸乙醇分化液分化约30 s,再用蒸馏水冲洗约10 min;加伊红染色液染色30 s,再用70%乙醇洗涤2次后置于镜下观察、拍照。随机拍摄6个视野,测量每个视野中30个肌管的直径。
1.6油红O(OilredO,ORO)染色C2C12细胞用4%多聚甲醛室温固定15 min后,取适量染色洗涤液覆盖细胞约20 s后弃去;加适量油红O染色10~20 min,弃去油红O染色工作液后,再加染色洗涤液覆盖细胞约30 s后弃去;用PBS漂洗细胞约20 s后弃去,再加入新的PBS置于镜下观察、拍照。
1.7细胞衰老β-半乳糖苷酶(senescence-associatedβ-galactosidase,SA-β-gal)染色培养皿中加入β-gal染色固定液室温固定15 min,加PBS润洗细胞3次,每次3 min。弃去PBS,每孔加入适量染色工作液,置于37 ℃、无CO2恒温箱过夜,然后置于镜下观察、拍照。
1.8乳酸脱氢酶(lactatedehydrogenase,LDH)释放实验在“样品最大酶活性对照孔”中加入10%的LDH释放试剂,继续培养1 h。然后取各处理孔上清液, 400 g离心5 min,转移上清至新的96孔板中。按照说明书准备适量INT溶液(1X),然后按照乳酸溶液: INT溶液(1X)∶酶溶液=1∶1∶1配制LDH检测工作液。在96孔板各孔中分别加入60 μL LDH检测工作液及120 μL样品,混匀室温避光孵育30 min。然后在490 nm波长下测量吸光度。LDH相对释放量(%)=100×(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性孔的吸光度-样品对照孔吸光度)。
1.9免疫荧光使用4%多聚甲醛室温固定C2C12细胞15 min,加入免疫染色封闭液,封闭约1 h。加配制好的FBXW7一抗溶液(1∶100)及GSDMD一抗溶液(1∶100),于4 ℃孵育过夜。洗涤后根据一抗种属类型选择合适的免疫荧光二抗,避光孵育1 h,洗涤后加入适量DAPI染色液,染核15 min。最后加入一滴抗荧光淬灭剂,置于共聚焦显微镜下进行观察、拍照。
1.10免疫印迹(westernblot,WB)收集干预后的C2C12细胞,加入配制好的细胞裂解液(RIPA,含磷酸酶抑制剂及蛋白酶抑制剂),置于冰上充分裂解后,收集细胞裂解液, 13 000 rpm, 4 ℃离心15 min。收集上清液,加入蛋白上样缓冲液,置于干式金属浴仪器中, 100 ℃加热15 min使蛋白变性。配制10%的SDS-PAGE胶,加入蛋白样品, 120 V电泳1.5 h,然后收集凝胶,覆盖PVDF膜置于转膜夹中, 300 mA,冰浴转膜2 h。收集PVDF膜孵育一抗溶液: FBXW7(1∶1 000)、 GSDMD(1∶1 000)、 ASC(1∶1 000)、 NLRP3(1∶5 000)、 NF-kB p65(1∶1 000)、 CASP1(1∶5 000)、 FBX32(1∶1 000)、 GAPDH(1∶10 000), 4 ℃过夜,洗膜后加入二抗(辣根过氧化物酶标记山羊抗兔IgG(H+L), 1∶2 000)室温孵育1 h,漂洗后置于显影仪中进行曝光拍照。
1.11统计学分析所有实验至少重复3次。使用GraphPad Prism 软件进行数据处理,符合正态分布的计量资料以均数±标准误(mean±SEM)表示。使用ImageJ软件处理染色以及WB条带图像。2组比较时使用非配对双尾Studentt检验,多组比较时使用单因素ANOVA 及Bonferroni 事后检验进行分析。以P< 0.05为差异有统计学意义。
2 结果
2.1PA处理诱导C2C12细胞脂质积累及肌管萎缩衰老C2C12细胞在分化培养基中培养4~5 d后,可见C2C12细胞融合成多核肌管(图1A)。参照文献[7]及本研究CCK8的实验结果,最终选用250 μM作为干预C2C12细胞的PA工作浓度(图1B)。ORO染色结果显示PA处理组肌管内出现较多的脂滴,而BSA干预的对照组无脂滴聚集,说明PA干预成功诱导C2C12细胞发生了成脂分化(图1C)。另外,PA干预使C2C12肌管直径减小,说明PA干预诱导肌管发生了萎缩(图1D&E)。FBX32是肌肉萎缩的蛋白标志物, WB实验结果发现PA干预组细胞中FBX32蛋白表达水平上升1.75倍,进一步证明了肌萎缩的发生(图1F&G)。SA-β-gal活性增加是细胞衰老的常见标志,表现为蓝绿色细胞数量增加。结果显示, PA干预后的C2C12细胞SA-β-gal活性升高,即细胞老化程度上升(图1H&I)。P21是细胞周期抑制因子,是细胞衰老标志物。WB实验结果发现PA干预使细胞中P21蛋白表达水平上升1.68倍,进一步证明了细胞衰老的发生(图1J&K)。
2.2PA处理诱导C2C12细胞中焦亡相关蛋白降解半衰期延长为了探究脂质积累对焦亡通路蛋白稳定性的影响,本研究检测了PA干预C2C12细胞后焦亡相关蛋白的半衰期。环己酰亚胺(cycloheximide, CHX)是细胞内蛋白质合成的抑制剂。当细胞内蛋白质合成被抑制后,蛋白质水平会因为泛素化修饰诱导的蛋白酶体的蛋白分解作用下降。MG132是蛋白酶体抑制剂,可以抑制蛋白酶体的分解作用。WB实验结果显示, CHX干预后炎症标志物核因子κB(nuclear factor kappa-B, NF-κB)P65亚基以及焦亡标志蛋白核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3, NLRP3), 半胱氨酸蛋白酶1(caspase-1, CASP1), 消皮素D(gasdermin D, GSDMD),和凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD, ASC)的蛋白含量明显下降,但PA干预后,可见以上蛋白标志物半衰期的明显上升,表明PA可以明显抑制蛋白质的降解作用,这和MG132的干预效果类似(图2)。以上结果进一步说明PA引起炎症及焦亡的原因可能与蛋白质稳定性相关。
2.3PA处理降低C2C12细胞中FBXW7表达水平PA 干预在降低C2C12细胞中肌管直径和增加脂质积累的同时,可使FBXW7表达量下降(图3A-C),这说明PA可能是通过降低FBXW7表达水平来调节SO表型。为了研究FBXW7在SO发生发展中的调控作用,本研究采用慢病毒载体转染C2C12细胞来构建过表达FBXW7的稳定转染株:荧光图像显示,慢病毒载体成功进入C2C12细胞(图3D);WB显示,慢病毒成功介导了FBXW7在C2C12细胞中的过表达(图3E-F)。
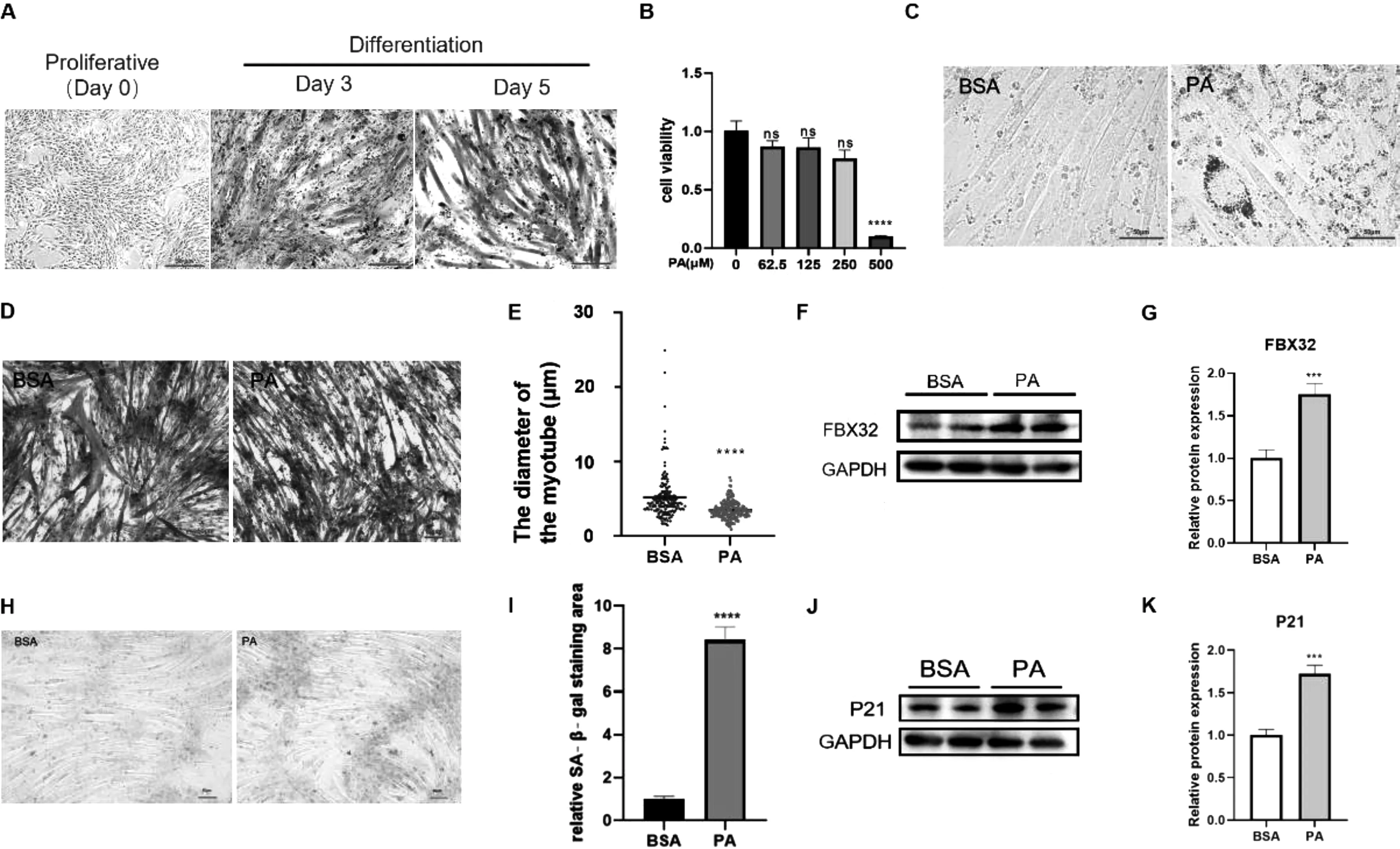
注: A:不同培养阶段C2C12细胞的HE染色; B:不同浓度PA干预C2C12细胞24 h后的细胞活力; C:工作浓度PA干预后肌管内中脂质积累(ORO染色); D&E.:工作浓度PA干预后肌管直径变化(HE染色); F&G:工作浓度PA干预后FBX32表达水平变化。H& I:工作浓度PA干预后肌管老化程度变化(SA-β-gal染色); J&K:工作浓度PA干预后P21表达水平变化。与对照相比, ns无统计学意义,***P< 0.001, ****P< 0.0001。图1 C2C12细胞的成熟分化, PA干预诱导C2C12细胞的成脂分化及肌管萎缩
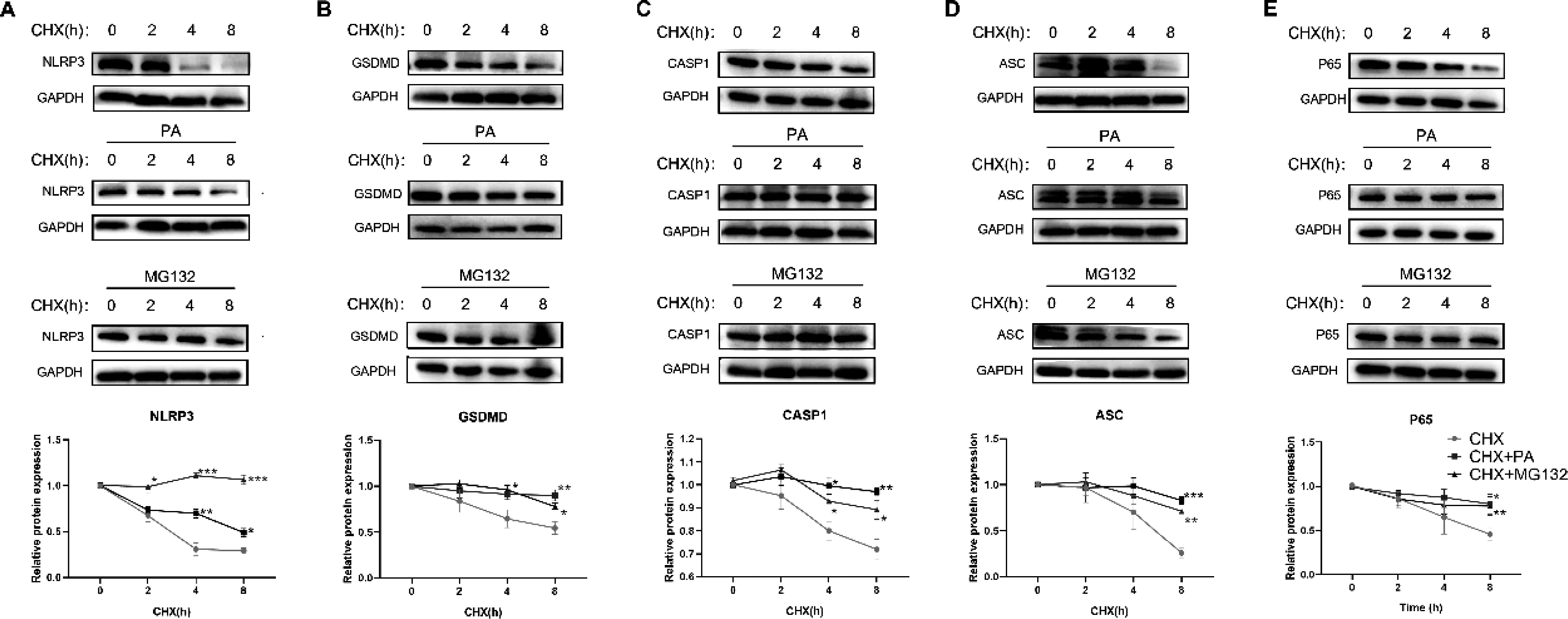
注: WB分析CHX(10 μM)、或CHX + PA、或CHX + MG132(10 μM) 处理后C2C12细胞中焦亡标志物: NLRP3(图A)、 GSDMD(图B)、 CASP1(图C)、ASC(图D),以及炎症标志物(P65,图E)的蛋白表达量。在相同时间点, CHX vs CHX+PA或CHX vs CHX+MG132, *P< 0.05, **P< 0.01, ***P< 0.001。图2 PA干预使炎症及焦亡的蛋白标志物稳定性增加
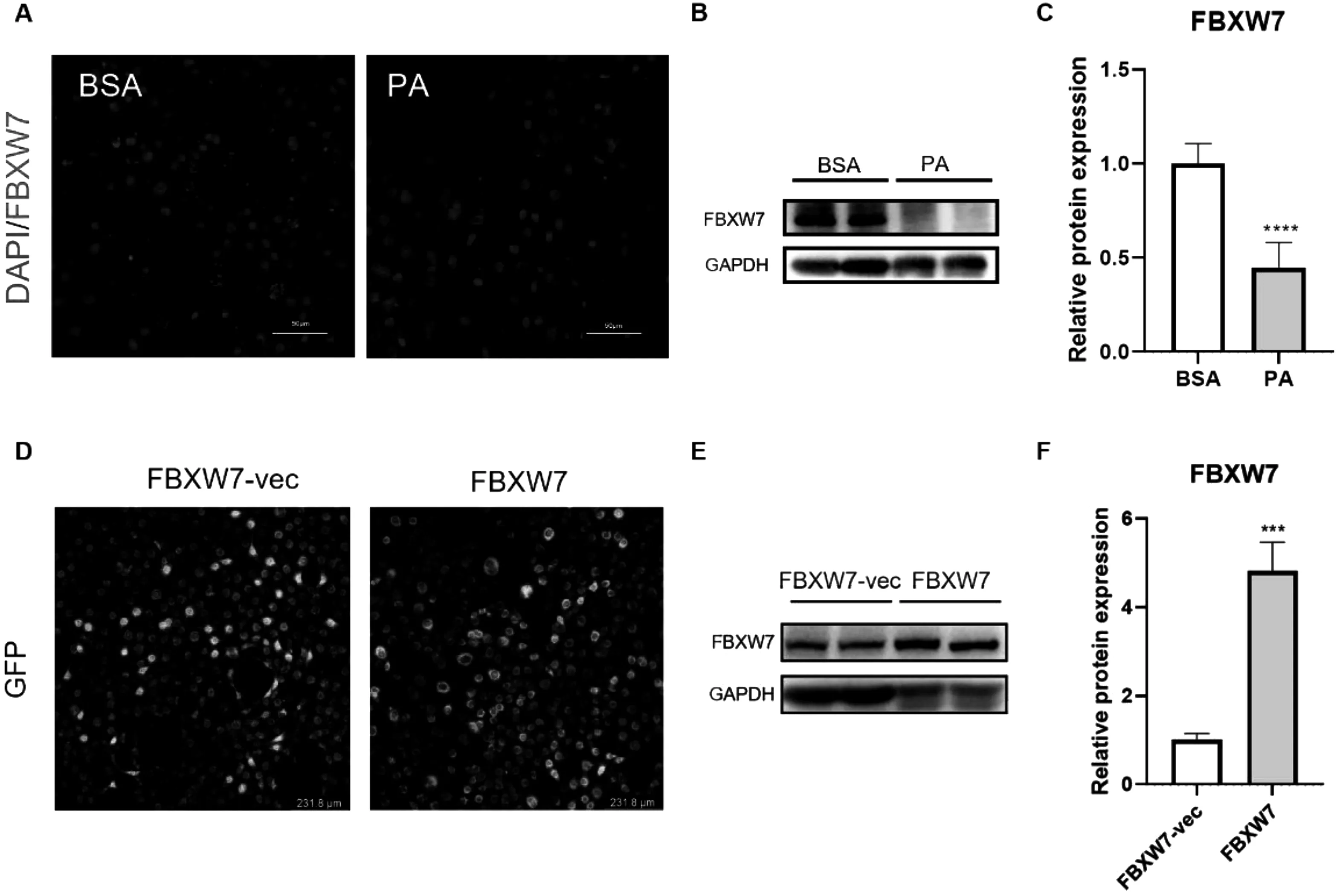
注: A: PA及BSA干预的FBXW7共聚焦图像(红色, FBXW7;蓝色,细胞核); B&C:工作浓度PA干预C2C12 细胞24 h后FBXW7表达水平; D-F:构建慢病毒转染的FBXW7过表达C2C12细胞株(共聚焦显像, WB)。与对照相比, ***P< 0.001, ****P< 0.0001。图3 PA干预FBXW7表达与FBXW7稳定过表达C2C12细胞株
2.4FBXW7过表达改善PA干预诱导的C2C12肌管萎缩及焦亡使用PA干预过表达FBXW7的C2C12细胞,发现FBXW7过表达能改善PA处理诱导的肌管萎缩(图4A&B)。焦亡的特征是细胞膜完整性丧失和胞质LDH的释放,因此测量LDH释放量可以反映细胞焦亡情况。LDH实验结果显示,FBXW7过表达可抑制PA诱导LDH释放,说明FBXW7可以改善PA诱导的C2C12细胞焦亡(图4C)。WB结果进一步证实PA干预可以诱导肌萎缩标志蛋白(FBX32)、炎症标志蛋白(P65)以及焦亡相关蛋白(ASC、 CASP1、 GSDMD、 NLRP3)上调,而FBXW7的异位表达可以抑制PA诱导的上述效应(图4D-E)。
2.5FBXW7与GSDMD存在共定位关系FBXW7通过其Cdc4磷表位(Cdc4 phosphodegron, CPD, S/TPXXS/T/D/E)与各种磷酸化底物结合,随后通过K48泛素化和蛋白酶体介导底物的降解[8]。本研究分析了GSDMD及其同家族GSDME蛋白序列,发现其含有CPD基序,推测FBXW7可能通过与GSDMD的CPD基序结合调控蛋白稳定性(图5A)。在PA干预后,本研究对C2C12细胞中的GSDMD蛋白及FBXW7蛋白进行了免疫荧光染色。结果显示, FBXW7聚集于焦亡细胞的特征性水泡中(图5B)。另外, FBXW7与GSDMD存在共定位关系,表明FBXW7可能与GSDMD直接结合发挥泛素化作用(图5C)。
3 讨论
肌少症性肥胖,虽可见于任何年龄段的肥胖人群,但增龄过程中,伴随骨骼肌质量与功能的逐步下降而出现的体脂的相对或绝对增加,仍不容忽视。脂肪组织关联性代谢紊乱而产生的负面影响,如氧化应激、炎症、胰岛素抵抗等,可使肥胖独立引起骨骼肌质量和功能下降;肌少症因能量消耗减少可直接促进脂肪堆积;因此,肥胖和肌少症可能会协同增强彼此的程度;此外,慢性非传染性疾病及其并发症、久坐少动等不良生活方式,也会增加SO的发病风险。有关SO定义、诊断的不断更新及发病机制的探究,是SO治疗的基石。
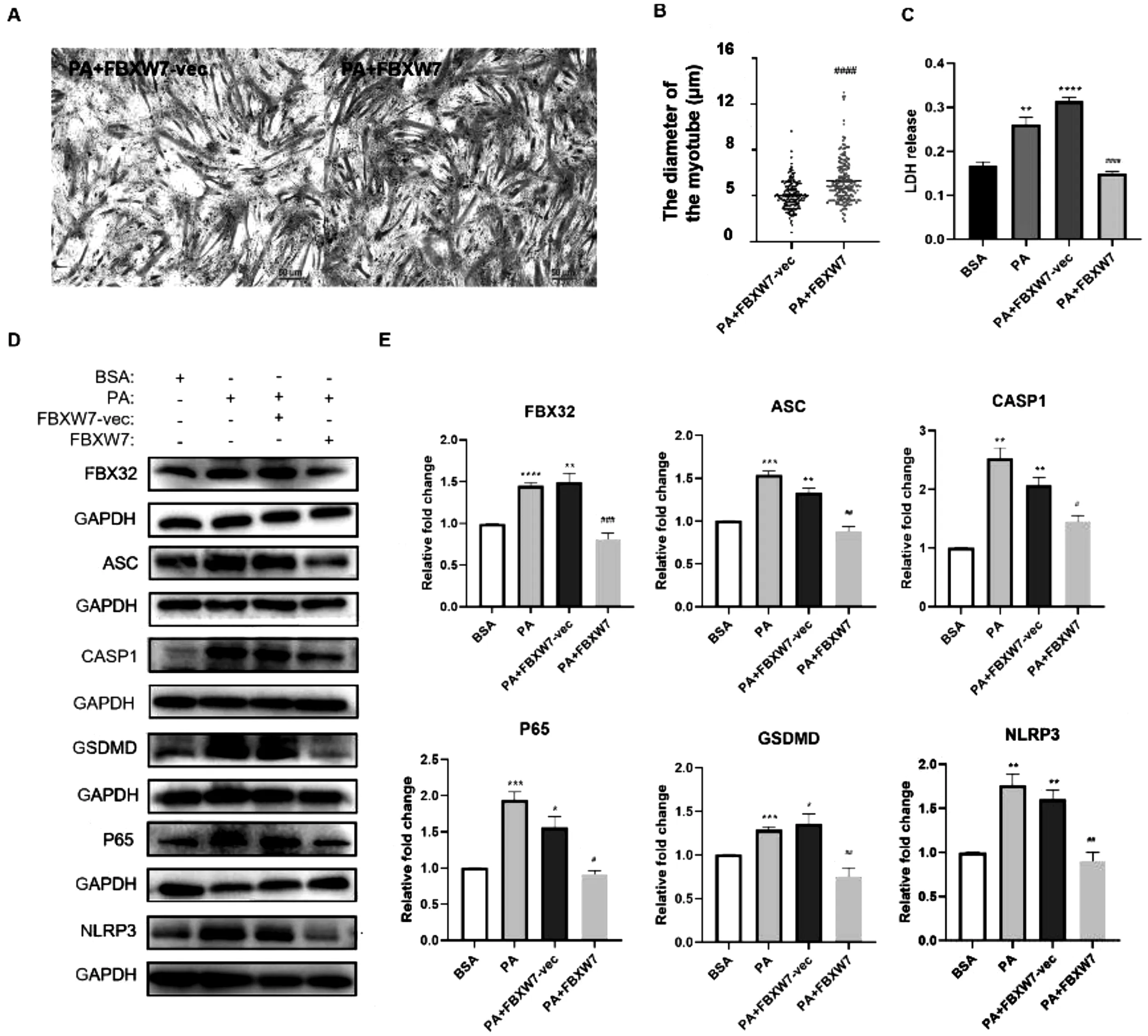
注: A&B: PA干预FBXW7过表达C2C12稳定转染株24 h后肌管直径变化(HE染色); C: PA干预FBXW7过表达C2C12稳定转染株24 h后细胞外培养基中的LDH水平变化(LDH释放实验,按“最大酶活性孔”的LDH水平作归一化); D-E: PA干预FBXW7过表达C2C12稳定转染株24 h后FBX32、 ASC、 CASP1、 P65、 GSDMD、 NLRP3的表达水平(WB)与BSA组相比, *P< 0.05, **P< 0.01, ***P< 0.001, ****P< 0.0001;与PA + FBXW7-vec组相比, #P< 0.05, ##P< 0.01, ###P< 0.001, ####P< 0.0001。图4 FBXW7过表达抑制PA诱导的C2C12细胞肌管萎缩、 LDH释放及焦亡相关蛋白表达
SO发生机制中,增龄以及肥胖引起的炎症和焦亡可能是骨骼肌萎缩和代谢失调的主要原因[9-11]。SO与炎症关系密切。在肥胖小鼠骨骼肌中,可以观察到肌萎缩和炎性细胞因子水平增加[9, 12- 13]。近期研究发现,高脂血症[14]或其他刺激可以诱导NLRP3炎症小体组装,活化CASP1并且切割GSDMD蛋白,形成GSDMD-N插入细胞膜形成膜孔,促使细胞胀破,诱导细胞焦亡。因此,在肥胖以及肥胖相关炎性疾病中,焦亡通路以及相关蛋白的致病作用已经为人所熟知,而且是治疗的潜在靶点之一[15-16]。另一方面,在快速老化小鼠大脑以及自然衰老的老年大鼠骨髓中,NLRP3、CASP1以及GSDMD表达的明显上升[17-18]。而在香烟烟雾诱导和地塞米松诱导的肌肉萎缩小鼠模型中,焦亡相关蛋白NLRP3、 CASP1以及GSDMD等表达水平提高,而且抑制GSDMD表达可以改善小鼠骨骼肌萎缩[19-20]。在本研究中,PA处理的C2C12肌管中有脂滴形成,并伴随肌管直径缩小、细胞衰老、LDH释放增加以及焦亡相关蛋白标志物的上调,表明焦亡参与了肥胖诱导肌萎缩的过程中。
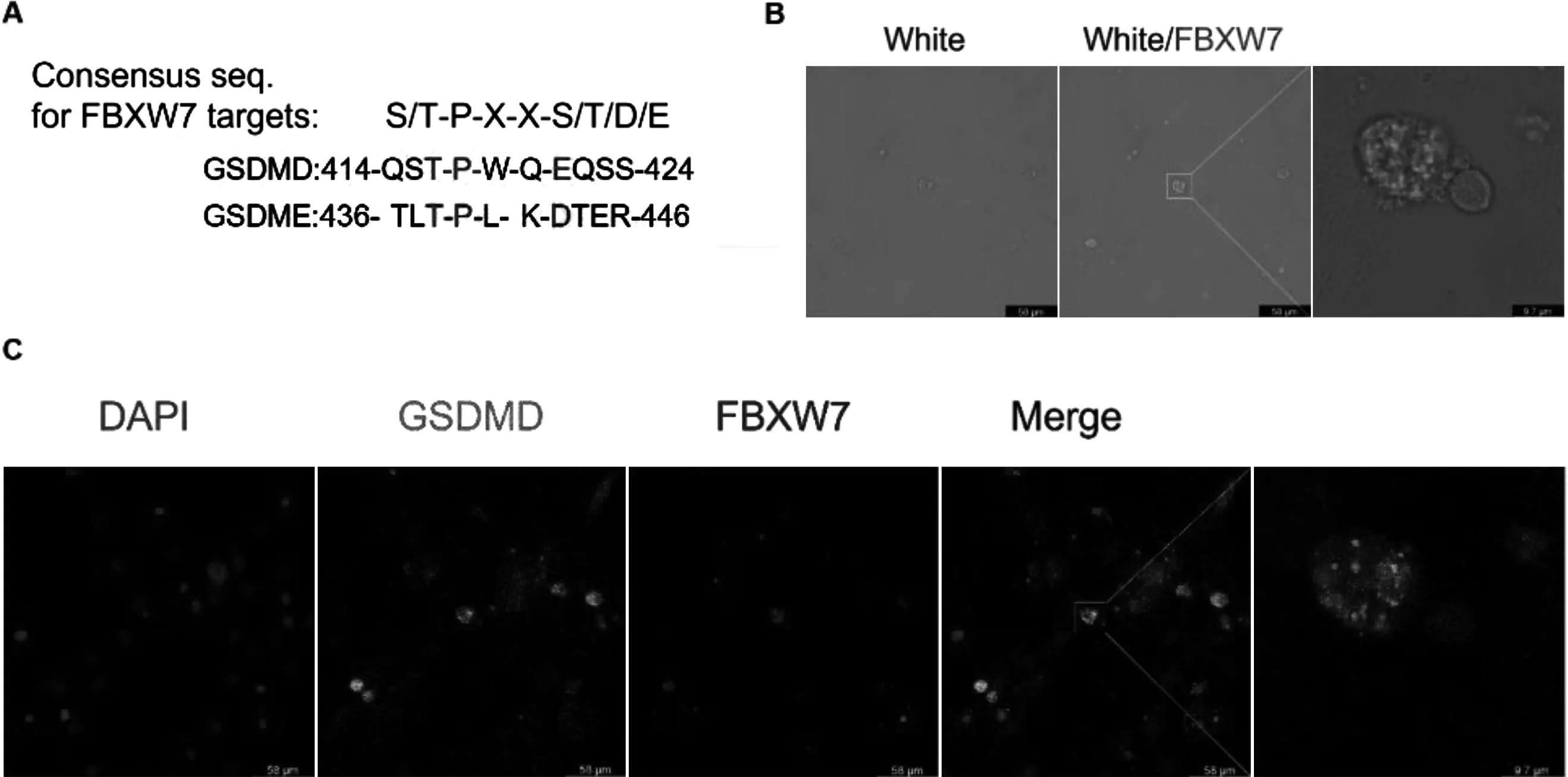
注: A: GSDMD和GSDME中CPD结构域的比对; B: PA干预后明场以及FBXW7的免疫荧光图像; C: PA干预后FBXW7与GSDMD的免疫荧光图像(红色, FBXW7;绿色, GSDMD; 蓝色,细胞核)。图5 FBXW7与GSDMD的共定位
焦亡相关蛋白的激活主要依赖于炎症小体途径,而蛋白的稳定与降解主要依赖于不同的翻译后修饰,如琥珀酰化修饰[21],氧化修饰[22],以及泛素化修饰[23]。其中,泛素化修饰是调控蛋白稳定性的主要途径之一。线粒体泛素连接酶(mitochondrial ubiquitin ligase, MARCH5)是一种定位于线粒体的E3泛素连接酶。研究发现,MARCH5上调可以抑制炎症性心肌病中GSDMD的表达,从而发挥保护心肌的作用[24]。另外,亚砷酸钠可以抑制GSDMD的K48以及K63泛素化,导致GSDMD的积累,促使焦亡发生[23]。以上研究说明,泛素化修饰是调节焦亡通路的重要方式。本研究发现PA可以延长焦亡相关蛋白的半衰期,而且FBXW7过表达可以抑制以上过程,说明泛素化调节在焦亡通路调控中起着重要作用。
FBXW7具有多种生物学功能,可以调控衰老[25], 脂肪生成[26-28], 以及炎症信号通路[29-31]。在葡聚糖硫酸钠诱导的结肠炎小鼠模型中,敲除小鼠肠上皮中FBXW7会激活NF-κB信号,导致促炎因子释放[32]。在脊髓损伤小鼠模型中,促进FBXW7表达可阻断NF-κB信号的激活,下调肿瘤坏死因子α和白介素1β[33]。FBXW7通过其CPD基序发挥泛素化修饰作用。研究发现,转录因子CCAAT增强子结合蛋白δ(CCAAT/enhancer-binding protein δ, C/EBPδ)可以促进衰老小鼠肌内脂肪浸润,从而引发肌少症[34]。而C/EBPδ蛋白序列中存在CPD基序,因此FBXW7可以通过调节C/EBPδ蛋白的稳定性使之降解[29]。目前, FBXW7与焦亡通路的关系尚未见文献报道。本研究首次发现上调FBXW7表达水平可以抑制PA诱导的肌管萎缩、 LDH释放、以及焦亡相关蛋白表达的升高;并且, FBXW7与GSDMD存在共定位关系,说明FBXW7可能通过与GSDMD直接结合,调控其蛋白稳定性,发挥调节SO中焦亡途径的作用。但尚需进一步的实验探究其具体的泛素化形式以及结合位点,以及进一步的体内实验验证FBXW7对SO的调节作用。
总之,本研究结果表明, PA可以通过延长焦亡相关蛋白的半衰期来提高细胞中的焦亡水平,而FBXW7是以上过程的抑制因子,其机制可能是通过泛素化修饰焦亡相关蛋白来改善肌细胞焦亡。因此, FBXW7在SO的焦亡调控中发挥着关键作用,是治疗SO的潜在靶点之一。
