珍稀濒危植物桫椤组培技术研究
2023-05-04范剑明陈新强黄锦荣朱昔娇温秀凤王溢豪谢金兰叶雪兰罗万业张冬生简耀彩
范剑明,陈新强,黄锦荣,朱昔娇,温秀凤,王溢豪,谢金兰,刘 丽,叶雪兰,罗万业,张冬生,简耀彩
(1.广东省(梅州)区域性林业试验中心,广东 梅州 514011; 2.梅州市农林科学院,广东 梅州 514021;3.湛江科技学院,广东 湛江 524094)
桫椤(Alsophilaspinulosa)属蕨类植物门(Pteridophyta)桫椤目(Cyatheales)桫椤科(Cyatheaceae)桫椤属(Alsophila)植物,是约1.8亿年前地球上最繁盛的植物,为“恐龙时代”标志植物,经过漫长的地质变迁,现仅在热带和亚热带地区中某些环境特别适宜的“避难所”残存,被世界自然保护联盟(IUCN)列入国际濒危物种保护名录(红皮书),是受国际保护的珍稀濒危物种[1-4]。桫椤的古老性和孑遗性对研究植物进化、植物地理区系及重现恐龙时代的古生态环境具有重要科学价值[5]。全世界现有桫椤科植物3属600多种,根据中国植物物种名录(2022版),我国有桫椤科植物3属18种,分别是桫椤属、黑桫椤属(Gymnosphaera)和白桫椤属(Sphaeropteris),主要分布在云南、广西、广东、海南、台湾等省区,均为国家二级重点保护野生植物[6]。为保护桫椤这一珍稀濒危植物,广东省于1998年在梅州市五华县建立了旨在保护桫椤群落的七目嶂省级自然保护区。
桫椤是高大木本蕨类植物,其植株形态优美,具有很高的观赏价值。开展桫椤的驯化繁育工作,既可以更有效地保护和扩大桫椤种群,同时也利于其资源的开发以满足人民对桫椤在观赏、药用等方面的需求。孢子繁殖是蕨类植物繁殖的重要手段,对于桫椤这类濒危物种具有重要意义。以孢子为外植体进行组织培养,是在无菌培养条件下模拟自然环境中孢子发育的过程[7]。近年来,我国对桫椤科植物的组织培养进行了一些基础研究。毕世荣等[8]用桫椤孢子体嫩叶诱导愈伤组织形成了植株,但由于孢子体材料通常包被鳞片较难消毒,因此,目前多数研究采用孢子作为外植体。程治英等[9]用GA3对桫椤孢子进行预处理以打破其休眠,但一些桫椤属植物如阴生桫椤(A.latebrosa)、大叶黑桫椤(A.gigantea)[10]等并不需要通过GA3处理来打破其休眠。多数研究选择MS或低浓度的MS培养基作为基本培养基,如黑桫椤(G.podophylla)[11]、笔筒树(S.lepifera)[12]、中华桫椤(A.costularis)[13]、海南白桫椤(S.hainanensis)[14]等的组培,少数采用改良的Knop’s固体培养基[15]或N6培养基[16]进行组培。这些研究显示,无机盐浓度对桫椤科植物组织培养的不同阶段会有不同的影响。在植物生长调节剂方面,朗月婷[17]在MS培养基中加入NAA、6-BA诱导阴生桫椤原叶体产生了绿色球状体,在MS培养基中加入IBA、NAA、KT、6-BA等诱导大叶黑桫椤原叶体产生了绿色球状体;徐艳等[18]将大叶黑桫椤原叶体转接到MS+0.1 mg·L-1NAA+0.1 mg·L-16-BA+0.7%活性炭培养基中诱导出了绿色球状体,并在此培养基上继代培养,再将球状体诱导形成了孢子体。此外,桫椤孢子繁殖还受很多因素影响,比如消毒、培养温度、光照、pH值等[19]。本研究在前人研究的基础上,以桫椤孢子作为外植体,开展组培快繁技术研究,为桫椤的大规模繁育提供参考。
1 材料与方法
1.1 试验材料
2019—2021年每年5—6月于梅州市五华县长布镇横江村采集桫椤孢子。该区地理位置为115°27′32″—115°27′48″E,23°46′44″—23°46′55″N,海拔220~510 m。采集时,将具有成熟孢子囊的羽片剪下放入纸袋中带回实验室,铺放在报纸上,于室内通风干燥处晾3~4 d,待孢子囊开裂散出孢子后,将孢子收集用牛皮纸包好,置于4 ℃冰箱中保存备用。
1.2 研究方法
1.2.1 孢子预处理试验 先将桫椤孢子置于10 mL离心管内,然后加50 mg·L-1GA3乙醇溶解液2~3 mL分别浸泡3、5、7、9 min,以5 000 r·min-1离心1 min,无菌水冲洗2~3次;再加入0.1%升汞溶液分别消毒12、10、8、6 min,离心1 min,最后用无菌水清洗4次;同时,以未经过GA3乙醇溶解液处理而仅以0.1%升汞溶液消毒12min的桫椤孢子作为对照。具体见表1。将消毒后的桫椤孢子接种于5号培养基(见表2)上,每种处理接种16瓶。培养室温度为25 ℃,日光灯光源,昼夜光照,光照强度为2 000~2 300 lx(下同)。30 d后观察孢子萌发率和污染率。
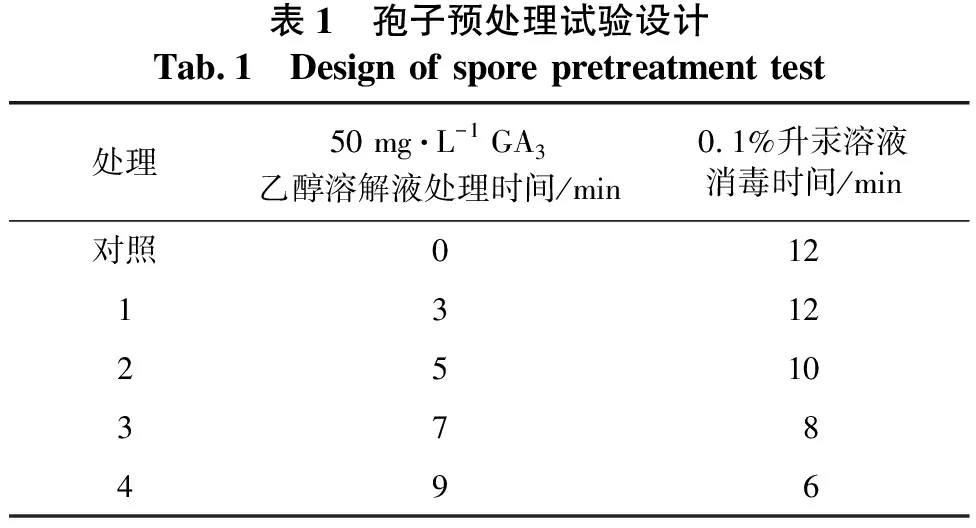
表1 孢子预处理试验设计Tab.1 Design of spore pretreatment test处理50 mg·L-1 GA3乙醇溶解液处理时间/min0.1%升汞溶液消毒时间/min对照01213122510378496
1.2.2 孢子萌发试验 孢子萌发的基本培养基及激素种类与浓度等见表2。
(1)培养基固化程度对孢子萌发的影响。将以50 mg·L-1GA3乙醇溶解液处理3 min,0.1%升汞溶液消毒10 min的桫椤孢子悬浊液接种至基本培养基及激素种类与浓度同培养基5,蔗糖含量为30 g·L-1,卡拉胶含量分别为5.5、6.0、6.5、7.0 g·L-1的培养基上,每种处理16瓶。接种后每周观察孢子萌发情况。
(2)无机盐浓度及植物生长调节剂对孢子萌发的影响。将50 mg·L-1GA3乙醇溶解液处理3 min,0.1%升汞溶液消毒10 min的桫椤孢子悬浊液分别接种至培养基1、2、3、4、5、6等6种培养基上。每种处理16瓶,接种后每周观察孢子萌发情况。

表2 孢子萌发培养基Tab.2 Spore germination medium培养基编号基本培养基及激素种类与浓度1MS21/2 MS31/6 MS41/8 MS51/6 MS+6-BA 0.04 g·L-1+IAA 0.02 g·L-161/8 MS+6-BA 0.04 g·L-1+IAA 0.02 g·L-1 注:以上培养基中蔗糖含量为30 g·L-1;卡拉胶含量为 6.5 g·L-1;pH值为5.8~6.2。基本培养基MS前的分数,如1/2、1/6和1/8 等指大量元素分别为MS的1/2、1/6和1/8,其他成分与MS的相同。下同。
1.2.3 原叶体增殖和分化 原叶体增殖和分化的基本培养基及激素种类与浓度见表3。将孢子萌发培养得到的原叶体分别转接到1、2、3、7、8、9、10、11、12、13、14、15、16、17号等14种培养基上。每种处理16瓶。转接后每周观察原叶体增殖生长情况,约30~40 d继转接1次,持续培育1年,观察原叶体分化情况。

表3 原叶体增殖培养基Tab.3 Culture medium for protophyll proliferation培养基编号基本培养基及激素种类与浓度1MS21/2 MS31/6 MS71/10 MS81/2 MS+6-BA 1.0 g·L-1+IBA 0.1 g·L-1+GA3 0.1 g·L-191/2 MS+6-BA 0.5 g·L-1+IBA 0.1 g·L-1+GA3 0.1 g·L-1101/2 MS+6-BA 0.5 g·L-1+IBA 0.05 g·L-1+GA3 0.1 g·L-1111/2 MS+6-BA 0.1 g·L-1+IBA 0.05 g·L-1+GA3 0.1 g·L-1121/2 MS+6-BA 0.2 g·L-1+IBA 0.05 g·L-1+GA3 0.2 g·L-1131/2 MS+6-BA 0.1 g·L-1+IBA 0.05 g·L-1+GA3 0.1 g·L-1141/2 MS+6-BA 0.04 g·L-1+IAA 0.02 g·L-1151/2 MS+6-BA1.0 g·L-1+NAA 0.2 g·L-1161/2 MS+6-BA 0.02 mg·L-1171/2 MS+NAA 0.2 mg·L-1
1.2.4 孢子体培育 将原叶体分化得到的孢子体幼苗接种到轻基质培养基(将泥炭∶珍珠岩∶蛭石按体积比2∶1∶1制成轻基质装进培养瓶中,加适量水使之湿润,然后消毒灭菌)中,以2号培养基作为对照,每种处理接种16瓶,接种后每周观察孢子体生长情况。
1.2.5 数据统计与分析 采用Microsoft Excel 2007软件进行数据统计与分析。
2 结果与分析
2.1 孢子预处理试验
孢子预处理试验结果见表4。由表4 可知:用50 mg·L-1GA3乙醇溶解液处理3min的桫椤孢子萌发效果最好,孢子萌发率达43.75%;随着处理时间的延长,孢子萌发率不断下降,当处理时间为9 min时,未见孢子萌发;未经过赤霉素乙醇溶解液处理的对照,其孢子30 d内未见萌发,至105 d才萌发,孢子萌发率为25.00%。说明以赤霉素短时间处理桫椤孢子,对其萌发具有促进作用,有利于打破其休眠,提高其萌发率,但处理时间过长会对桫椤孢子萌发产生抑制作用。使用0.1%升汞溶液对桫椤孢子进行消毒,处理6 min和8 min时,分别有5瓶和2瓶培养基上长出了真菌;处理10 min及以上时间,未见培养基发生污染。说明使用0.1%升汞溶液对桫椤孢子处理10 min便可以达到无污染的消毒效果。

表4 孢子预处理试验结果Tab.4 Results of spore pretreatment test处理预处理方法孢子萌发率/%孢子萌发天数/d污染率/%对照 GA3处理0 min+消毒12 min25.001050.001GA3处理3 min+消毒12 min43.75300.002 GA3处理5 min+消毒10 min37.50300.003 GA3处理7 min+消毒8 min12.503012.504 GA3处理9 min+消毒6 min0.00—31.25
2.2 孢子萌发试验
培养基固化程度对孢子萌发影响的试验结果(表5)显示,基本培养基、蔗糖含量及激素种类与浓度相同,卡拉胶含量分别为5.5、6.0、6.5、7.0 g·L-1的4种培养基中萌发瓶数为6~7瓶,萌发率为37.50%~43.75%,萌发天数约30 d,说明当培养基中卡拉胶含量为5.5~7.0 g·L-1时,培养基固化程度对桫椤孢子的萌发没有显著影响。

表5 培养基固化程度对孢子萌发的影响Tab.5 Spore germination effects on the solidification degree of culture medium培养基的卡拉胶含量/(g·L-1)萌发瓶数/瓶萌发天数/d萌发率/%5.563037.506.063037.506.573043.757.063037.50
无机盐浓度和植物生长调节剂对孢子萌发的影响结果见表6。表6结果显示:桫椤孢子在1、2号培养基中培养5个月,未能萌发;在3号培养基中培养4个月有1瓶萌发,萌发率为6.25%;在4号培养基中培养3个月有2瓶萌发,萌发率为12.50%;在5、6号培养基中培养1个月,分别有6瓶、5瓶萌发,萌发率分别为37.50%、31.25%。
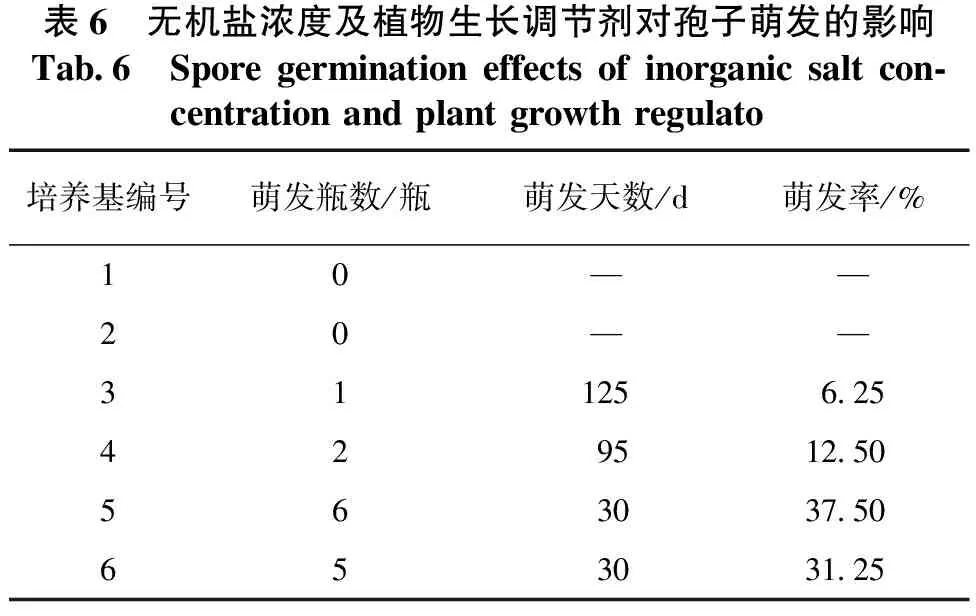
表6 无机盐浓度及植物生长调节剂对孢子萌发的影响Tab.6 Spore germination effects of inorganic salt con-centration and plant growth regulato培养基编号萌发瓶数/瓶萌发天数/d萌发率/%10——20——311256.25429512.50563037.50653031.25
说明无机盐浓度对桫椤孢子萌发有显著影响,无机盐浓度较高时不利于孢子萌发;在培养基中添加适量的植物生长调节剂,可以显著提高桫椤孢子的萌发率,缩短其萌发所需时间。
2.3 原叶体增殖与分化
将桫椤孢子萌发产生的原叶体(萌发过程见图1A、图1B、图1C)分别转接至1、2、3、7号等4种培养基上进行培养。结果发现:原叶体在3、7号培养基中培养20~25 d后颜色开始转黄绿色,需立即进行转接;在1、2号培养基中培养30~40 d,原叶体颜色浓绿,生长迅速,发育成了球状原叶体丛(见图1D)。表明较高无机盐浓度的培养基更适宜于原叶体增殖生长,这可能是因为当培养基中无机盐浓度较低时,其中所含营养成分不能满足原叶体生长发育的需要;原叶体在1、2号培养基中生长差异不显著,说明1、2号培养基所含营养成分均可满足原叶体30~40 d生长发育的需要。
将原叶体丛分别继代转接至8、9、10、11、12、13、14、15、16、17号等10种培养基上培养,以2号培养基作为对照。结果发现:原叶体在添加植物生长调节剂培养基中的生长速度均慢于其在未添加植物生长调节剂的2号培养基中的;在添加植物生长调节剂的培养基中培养30 d的原叶体丛,其大小约为3号培养基中的3/4;10种培养基中的原叶体丛颜色差异均不显著,均较浓绿。这说明植物生长调节剂会抑制桫椤原叶体的增殖。原叶体丛在2号培养基中继代培养,经4~5次转接后开始有幼孢子体(见图1E)分化出来,表明原叶体在没有外源激素干扰的情况下培养也能顺利分化出幼孢子体。幼孢子体继续增殖培养(见图1F),待其长出根系后(见图1G)即可转接培养。
2.4 孢子体培育试验
桫椤孢子体在2号培养基、轻基质培养基中的生长情况见图1H、图1I、表7。从图1H、图1I、表7中可以看出:不加激素的2号培养基和轻基质培养基均较适宜桫椤幼苗的生长。幼苗在该2种培养基中的生长速度无显著差异,平均生长速度约为0.6~1.0 cm·月-1,其中轻基质培养基中培育的桫椤幼苗在生长过程中有抽梢现象,根系生长也优于2号培养基中的,但使用轻基质培养基转接幼苗较难操作,生产中较难推广。
桫椤孢子体培育约4个月,当苗高约4 cm,长出4~6片叶,根系较发达时(见图1J),即可进行炼苗并移栽。炼苗时先将培养瓶放在自然光照下炼苗7 d,再打开瓶盖炼苗7 d。炼苗后可定植,培养基质为体积比为1∶1∶1的泥炭土、黄心土、蛭石混合基质,移栽成活率可达70%以上(见图1K~图1L)。

图1 桫椤组织培养生长过程Fig.1 Tissue culture and growth process of Alsophila spinulosa
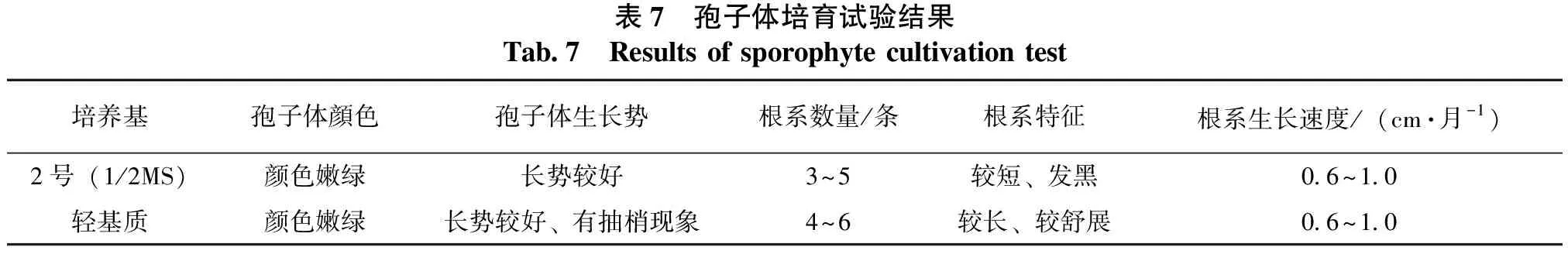
表7 孢子体培育试验结果Tab.7 Results of sporophyte cultivation test培养基孢子体顔色孢子体生长势根系数量/条根系特征根系生长速度/(cm·月-1)2号(1/2MS)颜色嫩绿长势较好3~5较短、发黑0.6~1.0轻基质颜色嫩绿长势较好、有抽梢现象4~6较长、较舒展0.6~1.0
3 结论与讨论
(1)本试验结果显示,桫椤孢子有休眠现象,不作任何处理时约需105 d才能萌发,萌发率为25.00%。用50 mg·L-1GA3乙醇溶解液处理3min的桫椤孢子萌发效果最好,其萌发率达43.75%,萌发所需时间缩短至约30 d。但随着赤霉素处理时间的延长,桫椤孢子萌发率不断下降。说明以低浓度赤霉素短时间处理桫椤孢子,对其萌发具有促进作用,有利于打破其休眠,提高其萌发率,但处理时间过长则会对桫椤孢子的萌发产生抑制作用。这一结果与程治英等[9]的研究结果相同。
(2)无机盐浓度对桫椤孢子萌发具有显著影响,较高的无机盐浓度不利于桫椤孢子萌发。桫椤孢子在MS、1/2 MS培养基中培养5个月都未能萌发。桫椤孢子在1/6 MS培养基中培养约120 d,萌发率为6.25%;在1/8 MS培养基中培养约100 d,萌发率为12.50%。在低浓度MS培养基(如1/6 MS或1/8 MS)中加入不同浓度的细胞分裂素和生长素可以显著提高桫椤孢子萌发率,并缩短萌发所需时间。本试验中,在1/6 MS和1/8 MS培养基中加入 6-BA 0.04 g·L-1+IAA 0.02 g·L-1,桫椤孢子萌发率达31.25%~37.50%,萌发所需时间缩短至约30 d。
(3)培养基固化程度对桫椤孢子的萌发没有显著影响,当培养基中卡拉胶含量为5.5~7.0 g·L-1时,桫椤孢子能正常萌发,萌发率为37.50%~43.75%,萌发天数约30 d,这一结果与程治英等[9]的研究结果不相同。程治英等认为,当琼脂含量为0.7%(琼脂固化程度较高)时,不利于桫椤孢子萌发,而当培养基中琼脂含量为0.5%(培养基能随三角瓶倾斜而移动)时,适宜桫椤孢子萌发。这种差异可能与培养基的其他成分不同有关。
(4)已有研究[10,17,19]表明,培养基中添加适宜浓度的细胞分裂素和生长素可以诱导蕨类植物的原叶体形成球状原叶体丛,即绿色小球体(GGB),然后用GGB来增殖。本试验在萌发培养基中添加了细胞分裂素(6-BA)和生长素(IAA),桫椤孢子萌发产生的原叶体发育形成了球状原叶体丛,但在原叶体增殖阶段使用未添加植物生长调节剂的1/2 MS培养基,转接后也发育形成了球状原叶体丛,其机理尚不明确。本试验结果表明,较高无机盐浓度的1/2 MS培养基更适合于原叶体增殖生长,在此培养基中培养30~40 d,原叶体颜色浓绿,生长迅速,而在1/6 MS或1/10 MS培养基中原叶体培养20~25 d后颜色开始转为黄绿色,其原因可能是培养基母液中氮素不足。在原叶体增殖分化过程中,添加植物生长调节剂会抑制桫椤原叶体的增殖;在没有外源激素干扰的情况下,原叶体在1/2 MS培养基中继代培养,经4~5次转接能顺利分化出幼孢子体;幼孢子体经过转接培养后能够增殖,并产生根系。
(5)不加植物生长调节剂的1/2 MS培养基和轻基质培养基均较适宜桫椤孢子体的生长,月平均生长量为0.6~1.0 cm,其中轻基质培养基中培育的桫椤幼苗在生长过程中有抽梢现象,其根系生长也优于1/2 MS培养基中的,但使用轻基质培养基转接幼苗较难操作,生产中较难推广。在桫椤幼苗移栽试验中,当培养基质的泥炭土∶黄心土∶蛭石体积比为1∶1∶1时,幼苗成活率较高,可达到70%以上。
