传统与光谱流式细胞仪对自发荧光样本检测的比较
2023-05-04陈家欢李丹丹王艺蕾刘晓玲
陈家欢,李丹丹,孙 艳,王艺蕾,王 铎,孔 杰,刘晓玲*
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室,北京 100005;2.中国医学科学院 北京协和医学院 北京协和医院 检验科,北京 100730;3.长治医学院,山西 长治 046000
某些组织、细胞容易被波长488 nm激光器激发而产生自发荧光,其发射光谱通常对异硫氰酸荧光素(fluorescein isothiocyanate,FITC)通道产生干扰[1-2],降低该通道的信噪比。流式细胞术(flow cytometry)主要通过采集荧光信号来解读生物学信息,自发荧光作为额外的荧光信号在传统流式细胞仪上不易被分析,从而影响流式结果。凋亡经常会导致FITC通道背景荧光增强。膜联蛋白V(annexin V,AV)联合碘化丙啶(propidium iodide,PI)染色是一种广泛应用的流式检测细胞凋亡的经典方法。因此本研究以凋亡作为模型研究自发荧光在不同流式细胞仪检测的异同。
流式细胞仪的配置是影响流式数据分辨率和准确性的关键因素。近几年推出的全光谱流式细胞仪(spectral flow cytometers)可将自发荧光作为一种单独的荧光信号来解析[3-4]。本研究旨在比较传统和光谱流式细胞仪对自发荧光样本凋亡数据解析的差异,同时为研究细胞凋亡提供方法学的参考,提高实验效率及其数据的准确性。
1 材料与方法
1.1 材料
人肝腹水腺癌细胞系(SK-hep-1)、RPM1640培养基、胎牛血清、0.05%胰蛋白酶、磷酸盐缓冲液、青链霉素(中国医学科学院基础医学研究所细胞资源中心)。FITC或别藻蓝素(allophycocyanin,APC)标记的annexin V/PI细胞凋亡检测试剂盒(BioLegend公司)。
1.2 方法
1.2.1 单细胞悬液制备:细胞汇合度达 80%~90%时进行单细胞制备(6 cm培养皿)。
方法一:1)去除上清,吸取2 mL 1×PBS加入培养皿中,润洗整个培养皿细胞,重复洗涤1次;2)培养皿中加 0.5 mL胰蛋白酶消化液,37 ℃消化2 min,加1.5 mL RPMI 1640完全培养基终止消化;3)2 mL PBS洗涤一次,重悬细胞。
方法二:与方法一相比,仅2)步有两个不同,一是胰蛋白酶消化液用量由0.5 mL增加至2 mL;二是吸弃胰蛋白酶消化液,再补加2 mL RPMI 1640 的完全培养基。
1.2.2 热激诱导凋亡:65 ℃水浴锅,分别0、1、2、3、5和8 min热激分装好的细胞,混合所有细胞,离心去上清,重悬并按照每管5×105个/400 μL均分细胞(即1.25×106个/mL)。
1.2.3 Annexin V/PI 染色:1)根据说明书建议分别将2.5 μL annexin V和5 μL PI加入到细胞悬液中,室温避光孵育15 min,上机检测。2)采用优化后的annexin V/PI染色方案,染色后样本分为两组,一组直接上机检测;一组离心洗涤,弃上清后,上机检测。
1.2.4 流式细胞术检测凋亡:传统流式细胞仪: C6 plus,带通滤光片配置为533/30 nm,585/40 nm, 675/25 nm;Cytoflex,带通滤光片配置为525/40 nm,585/42 nm,660/10 nm,对应检测荧光素为FITC、PI、APC。但Cytoflex具有显示自发荧光的功能。光谱流式细胞仪:SA 3800:前侧向信号与荧光信号合计共可同时采集34个通道信号并且可以生成不同亚群自发荧光光谱。SA3800采集420~800 nm的光谱信号,其405 nm、640 nm激光器共线,488 nm、561 nm激光器共线。Cytek Aurora:5激光64通道,可以检测420~830 nm波长的光谱,无共线激光器。数据分析软件:各流式细胞仪自带软件及Flowjo_V10.8.1。
2 结果
2.1 优化annexin V/PI染色方案
按照说明书推荐annexin V用5 μL,PI用10 μL,室温孵育15 min,Cytek Aurora检测发现荧光素FITC和PI光谱最高峰的平均荧光强度MFI(mean fluorescence intensity)超过Y轴高限(图1A)。优化条件后annexin V 1.25 μL室温孵育15 min后加入PI 0.5 μL即刻上机,并将Cytek Aurora电压参数设定为仪器自动优化后的10%,全部荧光信号均在仪器的检测范围内(图1B)。该条件下,传统流式细胞仪也可获得良好检测结果。后续实验均采取此方案。
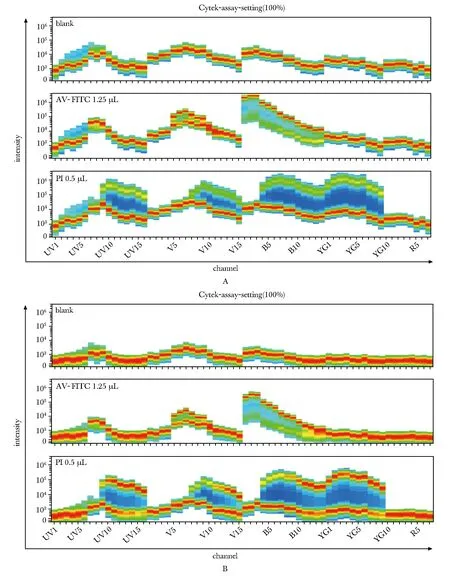
AV-FITC.annexin V-FITC; A.the full spectrum signal maps of SK-hep1 cells under cytek normal assay setting; B.the full spectrum signal maps of SK-hep1 cells under 10% of cytek normal assay setting; X-axis was the detectors on the Aurora.With these detectors, the fluorescent signal between 320 nm and 808 nm was detected; Y-axis was the mean fluorescence intensity(MFI) about a given antigen in different detectors
2.2 单细胞制备过程会产生自发荧光
图2A(方法一制备)的前侧向散点图比2B(方法二制备)多出一个明显的细胞群。利用SA3800自发荧光探测器分析发现该群内有自发荧光(图2C B群细胞):光谱拆分各群,得到它们的全光谱图,经过叠加,发现C、E、F细胞群光谱形状一致,C群细胞仅荧光信号略强,B、D群光谱形状与C、E、F存在显著差异,进一步证明D群内存在可产生自发荧光的细胞群B。Cytoflex分析也发现, FITC通道自发荧光本底相对较高,校正后,二维流式图呈现典型的横平竖直状态(图2D)。
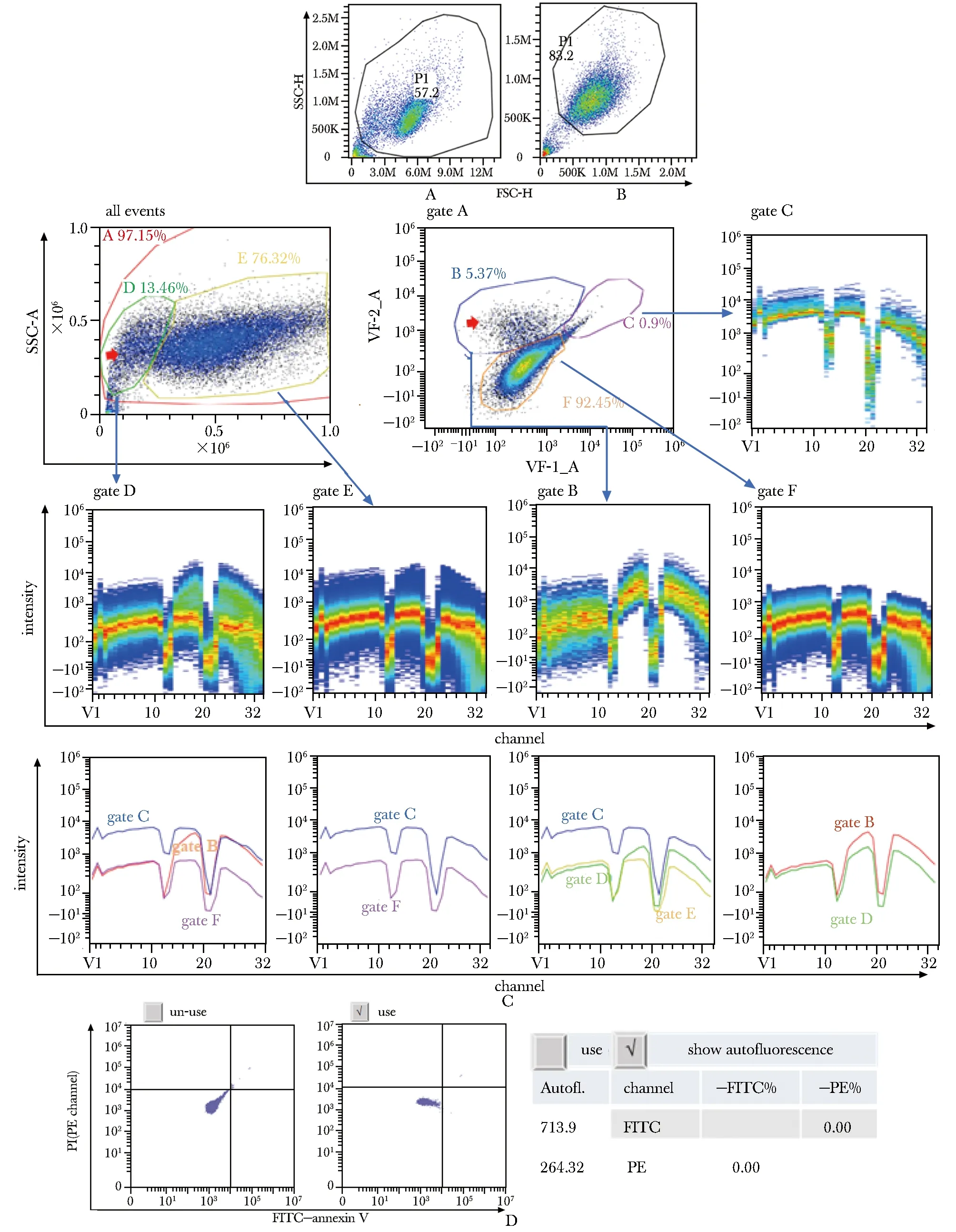
A.dead cell populations on the left side of 2D FSC-SSC scatter plots were observed when single cell populations prepared by the first method; B.there was only one distinct cell population when single cell populations prepared by the second method; C.full spectrum signal maps of every gate and spectral overlay diagram (red arrows: auto-fluorescent cell populations); D.auto-fluorescence was shown by Cytofle
2.3 传统流式细胞仪分析自发荧光样本FITC-annexin V/PI染色相对困难
由于FITC与PI发射光谱重叠,所以传统流式细胞仪利用FITC-annexin V/PI检测凋亡和坏死细胞,在分析数据前需要先进行补偿校正。图3A、3B分别为C6 plus和Cytoflex针对同一样本采集分析数据的结果。因为有自发荧光的存在,仅用FITC和PI单染样本校正补偿,C6 plus达不到补偿最佳状态“横平竖直”的效果,而Cytoflex因为有自发荧光的去除功能,故表现相对更好。此外,两台流式细胞仪由于原理的不同,Cytoflex用H信号,C6 plus用A信号作图的效果好。
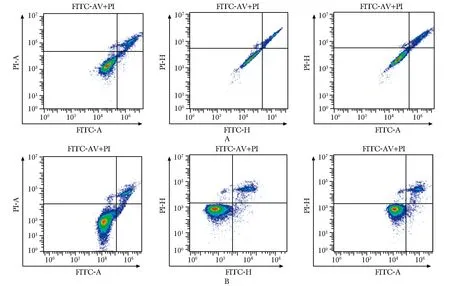
A.C6 plus;B.Cytoflex
2.4 传统流式细胞仪分析自发荧光样本APC-annexin V/PI染色相对容易
理论上APC与PI发射光谱无重叠,所以传统流式细胞仪利用APC-annexin V/PI检测凋亡坏死细胞,无需补偿校正。C6 plus(图4A)和Cytoflex(图4B)都可以清楚地辨析各个细胞群。但是Cytoflex效果更好,表现为PI单染组未向右偏移。
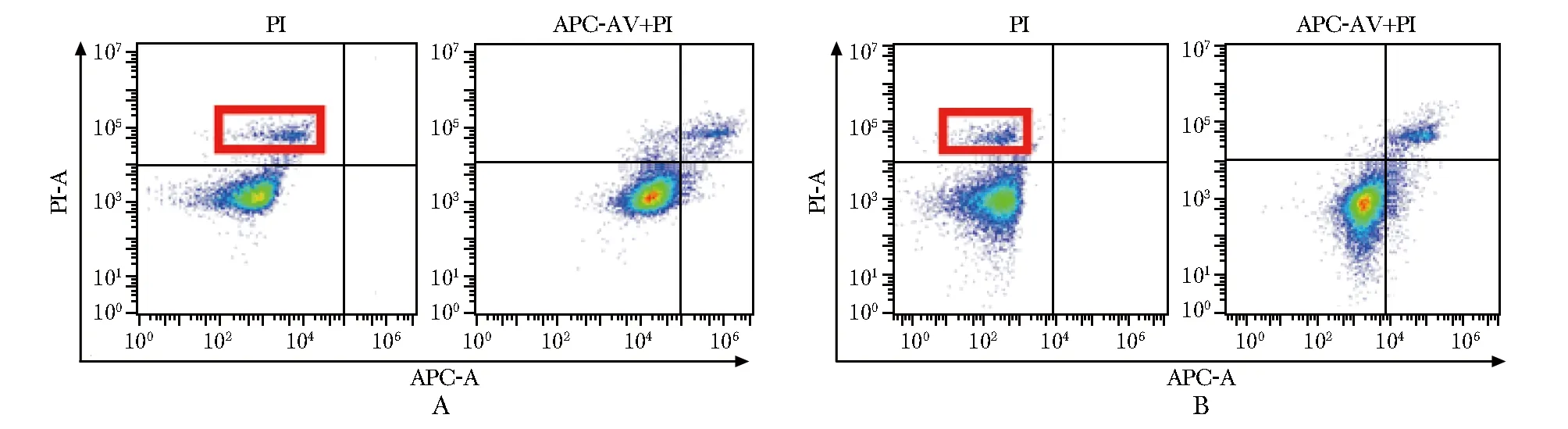
A.C6 plus;B.Cytoflex
2.5 光谱流式细胞仪分析自发荧光样本FITC或APC标记annexin V/PI染色结果良好
无论是5激光配置的Cytek Aurora还是激光器共线的SA3800,不仅可以清楚的辨析APC-annexin V/PI凋亡和坏死细胞群,同时可以很好的进行FITC-annexin V/PI 凋亡坏死染色分群(图5)。

A.SA3800; B.Cytek Aurora
2.6 离心洗涤过程增加annexin V-PI+单阳细胞群和annexin V+PI+双阳细胞群比例
虽然凋亡试剂盒说明书建议染料加完后,不洗涤直接上机检测,但是有很多实验者还是习惯将离心洗涤去除多余染料后再上机检测,本研究做了对比研究,发现离心洗涤后上机检测,PI+阳性细胞群比例均升高(图6)。
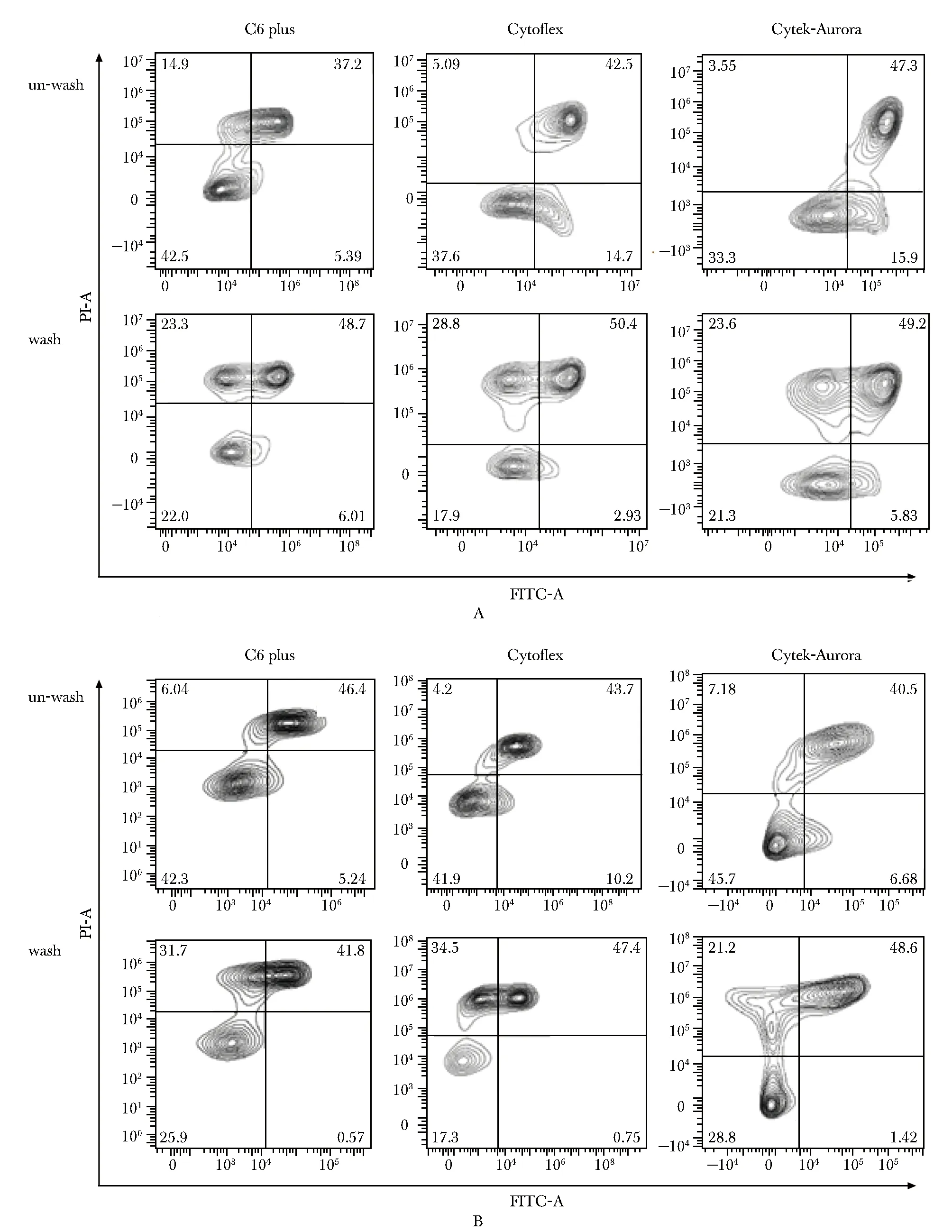
A.FITC-annexin V/PI;B.APC-annexin V/PI
3 讨论
流式细胞术通过采集样本的荧光信号来解读生物学信息,样本自发荧光的存在,会降低传统流式细胞仪在FITC通道的分辨率。annexin V-FITC和PI染色是流式细胞术检测细胞凋亡的经典方法。传统流式细胞仪难于分辨自发荧光和FITC通道荧光素,在检测细胞凋亡时建议优先选择APC-annexin V/PI染料,避免使用FITC通道荧光素。而全光谱流式细胞仪,即便选用FITC荧光素也可以很好地区分自发荧光、FITC荧光素和PI。分析原因一是光谱流式分析仪可以采集荧光素的全光谱信息,并可将自发荧光作为一种独立的荧光信号进行光谱拆分,与传统流式相比,不仅信号采集更全面,与补偿校正相比,光谱拆分是一种无监督聚类算法,拆分混合荧光信号中各荧光素独立表达强度和仪器背景噪音,可减少人为因素的干扰[5-6]。二是这两台仪器都配备561 nm激光器,FITC和PI分别用不同的激光器激发,降低了这两个染料之间的相互干扰,整体降低了实验的难度。如果传统流式细胞仪配备有独立排布的561nm激光器,PI染料用561 nm激光器激发,FITC/PI之间的补偿会相对减少,甚至没有,也可能得到清晰分群的结果,由于本实验室不具备配有561 nm激光器的传统流式细胞分析仪,该部分内容并没有得以验证。
此外,本研究提示样本自发荧光的产生与细胞消化方式有直接关系,忽略样本制备的细节操作可能导致产生自发荧光,对结果干扰较大,为实验者敲响了警钟!同时,发现离心洗涤后PI+阳细胞群比例升高,annexin V+/PI+和annexin V+/PI-分群更加清楚,可能与离心降低了细胞的活性有关。
综上所述,流式细胞术需要综合考虑仪器配置、样本特性以确定最优荧光素组合方案,分析时亦可尝试不同的数据表现形式以达到最佳检测效果。对于有自发荧光的样品,首选全光谱流式细胞仪,在无光谱流式细胞仪的条件下,尽可能选择具有自发荧光显示功能的传统流式细胞仪。本研究为具有自发荧光样品获得良好流式细胞术结果提供了方法学的参考,对于提高其数据的准确和可靠性,具有重要的意义。
