载脂蛋白E通过降低高尔基体膜蛋白73表达抑制小鼠肝癌细胞系增殖
2023-05-04侯孟杰黄富强王亚南刘芳铭
侯孟杰,赵 娜,2,黄富强,王亚南,刘芳铭*
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 生理学系,北京 100005;2.山东第一医科大学附属省立医院 输血科,山东 济南 250000
载脂蛋白E(apolipoprotein E, APOE)是两亲性血浆蛋白[1],主要在肝脏合成,功能主要是神经元修复、脂质稳态调节以及三酰甘油和胆固醇的运输和代谢[2]。APOE属于可交换载脂蛋白家族,通过结合膜受体介导循环脂蛋白和组织之间的脂质转移[1]。APOE缺乏会引起体内血脂浓度升高,导致动脉粥样硬化和非酒精性脂肪性肝病的发生[2]。
高尔基体膜蛋白73(Golgi protein 73, GP73)是一种高尔基体跨膜糖蛋白,通常存在于顺式高尔基体中。GP73在几乎所有上皮细胞中表达,但在正常肝细胞中低表达。研究发现GP73随酒精性肝炎、乙型肝炎、肝硬化等病情进展表达量逐渐增加[3],可作为肝脏疾病及肝癌诊断标志物[4]。近期研究表明GP73高表达可促进非酒精性脂肪性肝病的发生[5]。
尽管APOE与GP73都与非酒精性脂肪性肝病相关,但两者之间是否存在调控关系尚不清楚,本研究通过在线数据分析,利用小鼠组织、肝癌细胞系,探讨APOE与GP73之间的调控关系,为探索APOE或GP73异常相关疾病的发病机制和靶向治疗提供新的策略。
1 材料与方法
1.1 材料
1.1.1 实验动物:Gp73敲除(Gp73-KO)及其对照小鼠(本实验室保存)[6],Apoe敲除(Apoe-KO)小鼠及野生型(WT)小鼠(北京华阜康生物科技股份有限公司),饲养条件均为SPF级别,动物实验均符合“国际实验动物应用和管理条例”的规定和伦理要求(审批编号:ACUC-A01-2022-042)。
1.1.2 细胞系:人胚肾细胞系HEK-293FT、人源肝癌细胞系HepG2、Huh7、MHCC97H、SNU398、Li-7、PLC/PRF/5(本实验室保存);鼠源肝癌细胞系Hepa1-6(国家实验细胞资源共享服务平台)。
1.1.3 主要试剂:DMEM高糖培养基、RPMI 1640培养基(Corning公司);MEM培养基、胰蛋白酶、胎牛血清、LipofectamineTM2000(Lipo2000)转染试剂盒、LipofectamineTMRNAi MAX试剂盒(Invitrogen公司);过表达APOE(人源)质粒(北京擎科生物科技有限公司);过表达GP73质粒(广州市锐博生物科技有限公司);短发夹RNA-Apoe(short hairpin RNA-Apoe,shRNA-Apoe)(上海吉凯基因医学科技股份有限公司,序列见表1);小干扰RNA(small interference RNA, siRNA)(苏州吉玛基因股份有限公司,序列见表2);细胞增殖毒性检测试剂盒(上海翊圣生物科技有限公司);Actin抗体、人源APOE抗体(Cell Signaling Technology公司;鼠源APOE抗体、鼠源GP73抗体(武汉爱博泰克生物科技有限公司);人源GP73抗体(Proteintech公司);荧光兔二抗-800通道、鼠二抗-800通道(LI-COR公司);无内毒素质粒大提试剂盒(天根生化科技有限公司);雷帕霉素(rapamycin, Rapa)(Selleck公司);蛋白酶抑制剂和磷酸酶抑制(Roche公司)。

表1 短发夹RNA-Apoe序列Table 1 Short hairpin RNA-Apoe sequence

表2 小干扰RNA序列Table 2 Small interfering RNA sequence
1.2 方法
1.2.1 使用cBioPortal网站(http://www.cbioportal.org)分析TCGA数据库中肝癌组织APOE与GP73基因表达情况;使用Clinical Proteomic Tumor Analysis Consortium(CPTAC)网站(https://gdc.cancer.gov/about-gdc/contributed-genomic-data-cancer-rese-rch/clinical-proteomic-tumor-analysis-consortium-cptac)分析肝癌中APOE与GP73蛋白表达情况。两个分析网站的数据均在基因表达数据归一化处理后,采用Pearson correlation统计学方法得出。
1.2.2 小鼠分组及处理:饲养Gp73敲除小鼠及其对照鼠、Apoe敲除小鼠及野生型(wild type,WT)小鼠至3月龄,断颈处死,剖开腹腔,取新鲜肝脏、肾脏组织,后续检测相应蛋白质表达量。
1.2.3 慢病毒包装及细胞系构建:使用Lipo2000转染试剂将包装质粒PMD2G、PSPAX2和PLKO-shApoe或对照质粒PLKO-shNC以1∶2∶2转染到293FT细胞,8 h后换液,48 h后收集培养液上清,用0.45 μm滤膜过滤后分装,保存至-80 ℃。将Hepa1-6细胞铺在6孔板内,贴壁后,将病毒液和新鲜全培养基以2∶1加入6孔板内感染细胞,同时加入1 000×凝聚胺增加感染效率。感染48 h后利用2 μg/mL的嘌呤霉素筛选含抗性的细胞,得到Apoe敲低稳转细胞株及其对照细胞株。
1.2.4 细胞的分组及处理:用DMEM培养基(含10%胎牛血清和1%青霉素链霉素双抗)培养HepG2、Huh7、MHCC97H、Li-7、PLC/PRF/5细胞;用DMEM培养基(含10%胎牛血清,1%青霉素链霉素双抗和1%丙酮酸钠)培养Hepa1-6细胞;用RPMI 1640培养基(含10%血清和1%青霉素链霉素双抗)培养SNU398癌细,培养环境均为37 ℃、5% CO2培养箱。转染siNC、siGp73到Hepa1-6细胞中;转染shGp73和shNC到高表达GP73的Huh7;转染过表达GP73质粒及对照到Hepa1-6细胞中;转染过表达GP73质粒及对照到低表达GP73的HepG2细胞中;转染siNC和siApoe到高表达APOE的PLC/PRF/5;转染过表达APOE质粒及其对照到低表达APOE的Huh7、SNU398细胞中。其中siRNA利用RNAi MAX转染,过表达质粒利用lipo2000转染,转染方法分别按照说明书进行,于转染48 h后收集细胞蛋白质。
1.2.5 Western blot检测小鼠肝肾组织及肝癌细胞系内蛋白质的表达情况:小鼠肝肾组织用裂解液研磨破碎(30 mg/mL),之后离心取上清,置于98 ℃加热10 min,得到变性蛋白液。用加入溴酚蓝的裂解液进行稀释,置于-20 ℃保存,可直接用于电泳。用细胞裂解液处理细胞,可直接提取蛋白液用于电泳。用SDS-PAGE,之后转膜,封闭。根据目的蛋白选择一抗4 ℃孵育过夜,用TBS清洗3遍,加入对应二抗室温孵育2 h,用TBS清洗3遍,在OdysseyCLX双色红外激光成像系统显影,使用ImageJ软件分析,以内参蛋白为标准,对蛋白质的表达情况进行定量。
1.2.6 CCK8法检测细胞增殖能力:将稳定低表达APOE的Hepa1-6细胞株及其对照细胞接种于6孔板,待细胞贴壁后用RNAi MAX转染siRNA, 24 h后将细胞接种于96孔板,每孔接种3 000个细胞,每组设置5个复孔,待细胞贴壁开始算作0 h, 加入CCK8,2 h后检测各孔在450 nm波长的吸光度值, 后续检测24 h, 48 h。用GraphPad Prism 8 分析评估细胞活力。
1.2.7 CCK8法检测药物处理对细胞增殖影响:将稳定低表达APOE的Hepa1-6细胞株及其对照细胞接种于96孔板,每孔接种3 000个细胞,每组设置5个复孔,待细胞贴壁加入雷帕霉素(1 nmol/L),同时设置空白组。24 h后加入CCK8,2 h后检测各孔在450 nm波长的吸光度值,用GraphPad Prism 8分析评估细胞活力。
1.3 统计学分析
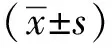
2 结果
2.1 APOE与GP73在肝癌中负相关
在人肝癌样品中APOE与GP73的表达存在负相关关系,RNA相关性R值为-0.26,P<0.001(TCGA,图1A);蛋白相关性R值为-0.27,P<0.001(CPTAC,图1B)。APOE和GP73在MHCC97H、Huh7、HepG2、PLC/PRF/5、Li7、SNU398多种肝癌细胞系中的蛋白表达存在明显的负相关关系(图1C)。
A, B.Pearson correlation analysis was performed to analyze the correlation between gene expression level of GP73 and APOE according to the TCGA database (n=372 in hepatocellular carcinoma) (A) and the CPTAC database (n=159 in hepatocellular carcinoma) (B); C.Western blot was used to analyze APOE and GP73 expression in liver cancer cell lines
2.2 敲除小鼠体内Gp73不影响APOE表达
与对照组WT小鼠相比,Gp73敲除小鼠肝脏、肾脏中GP73几乎不表达,且APOE蛋白表达量未发生改变(图2A, B)。

A, B.Western blots were used to analyze APOE and GP73 expression of WT(wild type) and Gp73-KO mouse liver (A) and kidney (B); *P<0.05 compared with the control group
2.3 肝癌细胞中GP73改变不影响APOE表达
在小鼠肝癌细胞系Hepa1-6中,与对照组siNC相比,Gp73敲低组GP73表达量明显减少, APOE蛋白的表达量并未发生改变(图3A)。同样,在人肝癌细胞系Huh7中,敲低GP73也不会影响APOE的表达(图3B)。在Hepa1-6及HepG2细胞中过表达GP73同样不改变APOE蛋白表达量(图3C, D)。

A-D.Western blots were used to analyze APOE and GP73 expression in multiple cells: Hepa1-6 siNC and siGp73-1,-2 cells (A); Huh7 shNC and shGP73 cells (B); Hepa1-6 NC and GP73-over-expression (OE) cells (C); HepG2 NC and GP73-OE cells (D); *P<0.001 compared with the control group
2.4 敲除小鼠体内Apoe导致GP73表达上调
与对照组WT小鼠相比,Apoe敲除小鼠肝脏组织中GP73表达明显上调(图4)。

*P<0.001 compared with the control group
2.5 敲低肝癌细胞系中APOE促进GP73表达
在小鼠肝癌细胞系Hepa1-6中,与对照组shNC相比,shApoe组的APOE表达降低,同时GP73表达明显上调(图5A)。在人肝癌细胞系PLC/PRF/5中,与对照组siNC相比,siAPOE组的APOE表达降低,同时GP73水平明显上调(图5B)。
2.6 肝癌细胞系中过表达APOE抑制GP73表达
在人肝癌细胞系Huh7和SNU398中,与对照组相比,APOE过表达组的GP73表达量明显减少(图5C, D)。

A-D.Western blots were used to analyze APOE and GP73 expression in multiple cells: Hepa1-6 shNC and shApoe-1,-2 cells (A); PLC/PRF/5 siNC and siAPOE-1,-2 cells (B); Huh7 NC and APOE-OE cells (C); SNU398 NC and APOE-OE cells (D); *P<0.01, **P<0.001 compared with the control group
2.7 Apoe敲低促进肝癌细胞增殖
与对照组shNC相比,shApoe组的Hepa1-6细胞增殖速度明显加快(图6)。
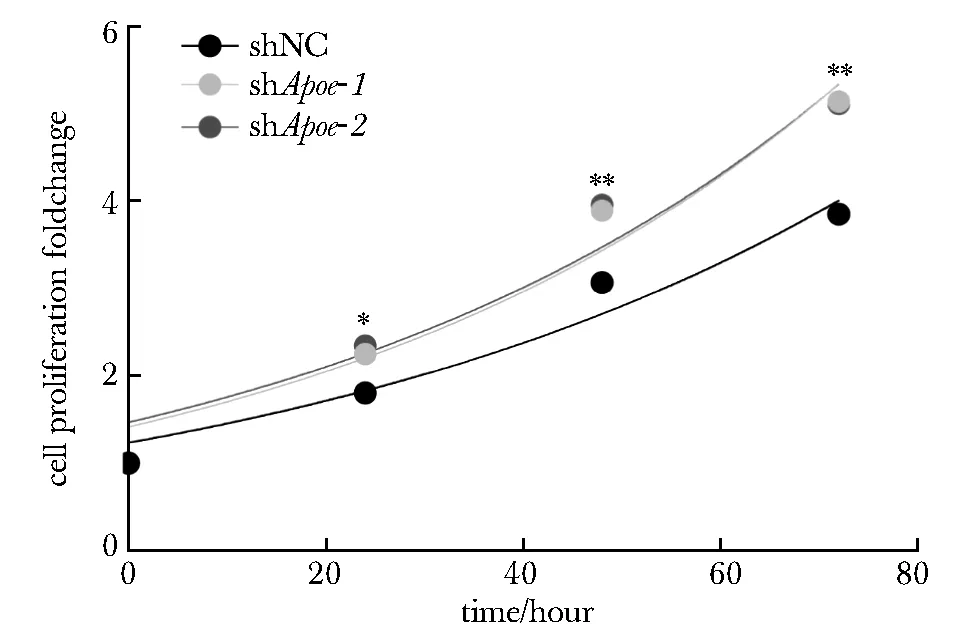
*P<0.01, **P<0.001 compared with the control group
2.8 下调GP73能够逆转敲低Apoe促进的细胞增殖
在Hepa1-6细胞中,与对照组 shApoe相比,shApoe-siGp73中GP73表达量下降(图7A),且细胞增殖速度减缓(图7B)。与对照组相比,雷帕霉素处理抑制GP73表达(图7C),并对Apoe敲低细胞的增殖有更明显的抑制作用(图7D)。

A.Western blot was used to analyze APOE and GP73 expression in Hepa1-6 shApoe cells treated with siNC or siGp73; B.effect of Gp73 knockdown on the proliferation of Hepa1-6 shApoe cells; C.Western blot was used to analyze APOE and GP73 expression in Hepa1-6 shNC and shApoe cells treated with control or rapamycin (1 nmol/L); D.effect of rapamycin on the viability of Hepa1-6 shNC and shApoe cells; *P<0.01, **P<0.001 compared with the shNC group; #P<0.001 compared with the shApoe group
3 讨论
肝癌与代谢性疾病密切相关,非酒精性脂肪性肝病是一种由过量三酰甘油在细胞质滞留引起的慢性肝病,病情进展会发展为肝纤维化、肝硬化、乃至肝癌[7]。GP73作为新兴“明星”诊断分子,在多种肿瘤包括由非酒精性脂肪性肝进展到肝癌的过程中随病情进程逐渐增加[4]。同时,研究表明GP73高表达能够引起非酒精性脂肪性肝病和肝癌的发生[5]。APOE的研究目前多集中在中枢神经系统,包括神经元增殖、膜修复和重塑及阿尔兹海默病发病关联性等[8]。此外,APOE还具有促进胆固醇反向转运的功能[9],APOE缺失会导致小鼠血清三酰甘油和胆固醇水平增加,在高脂高胆固醇饮食喂养下加速非酒精性脂肪性肝、肝炎及纤维化的发生[10]。本研究中,通过数据库分析发现APOE与GP73负相关,进一步探究两者之间的调控关系,对APOE降低或GP73活化引起的非酒精性脂肪性肝病、肝癌及其他疾病的治疗有重要意义。
已知HCV感染导致GP73升高,此时GP73与APOE存在相互作用和共定位[11],但两者之间的调控关系尚不明确。本研究结果显示,GP73的改变不影响APOE的表达,而APOE抑制GP73的表达,该结果显示两者之间存在单向调控关系。已知APOE可以易位到细胞核,作为一个直接转录因子,参与营养支持,突触功能,微管组装相关基因的转录调节[1]。在发现APOE负调控GP73的基础上,之后可以进一步探究两者之间调控的具体机制。
研究表明,APOE缺乏可上调AMPK/mTOR通路增强线粒体功能导致非酒精性脂肪性肝[12],但目前并没有相关的针对APOE缺失引起的非酒精性脂肪性肝乃至肝癌的靶向治疗。此外,靶向APOE治疗阿尔兹海默病的研究也尚未进入临床阶段[8]。在本研究APOE下调GP73的基础上,APOE降低引起的疾病可能通过靶向GP73治疗。已知雷帕霉素可通过靶向mTOR抑制GP73的表达[6,13],因此其对Apoe敲低引起GP73高表达的细胞增殖有更好的抑制作用。雷帕霉素作为一种FDA批准的药物,可很快应用于临床试验。本研究明确了APOE对GP73的负向调控,而抑制GP73可逆转由Apoe敲低促进的细胞增殖,可能是肝癌的一个病理机制和潜在的治疗靶点。
