奥贝胆酸对高脂喂养的C57BL/6J小鼠糖脂稳态的影响
2023-05-04王星,郭楠
王 星,郭 楠
1.川北医学院 药学院,四川 南充 637100;2.复旦大学附属闵行医院 药剂科,上海 201199
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是肥胖和代谢综合征的肝脏表现,已成为严重影响人类健康的疾病之一,全球发病率高达20%~30%[1]。肥胖、糖尿病和胰岛素抵抗均与NAFLD相关,另外,NAFLD患者通常都伴随糖代谢紊乱。目前NAFLD的治疗还没有特效药。奥贝胆酸(obeticholic acid,OCA)是天然胆汁酸鹅去氧胆酸的一种新型衍生物,是法尼醇X核受体(famesoid X receptor,FXR)的有效激活剂,比天然胆汁酸激动FXR活性更强[2-3]。FXR是核受体超家族之一,主要分布在肝脏、肾上腺和小肠组织中,在脂肪组织、心脏和脾脏中也有表达[4]。OCA激动肝细胞上的FXR受体后,调节胆固醇合成胆汁酸的过程,抑制肝脏内脂肪生成,抑制糖异生及发挥抗炎作用[5]。OCA被批准用于治疗原发性胆道疾病患者以及对熊去氧胆酸难治或不耐受胆管炎患者。此外,OCA目前正处于治疗非酒精性脂肪肝炎(nonalcoholic steatohepatitis,NASH)的Ⅲ期临床试验中,并已显示出其治疗肝脂肪变性、炎性反应和纤维化的作用[6-7]。尽管对OCA开展过很多研究,但OCA对高脂饮食喂养(high-fat diet,HFD)小鼠糖脂代谢的研究还鲜有报道。因此,本研究拟探讨OCA对HFD小鼠的糖脂代谢的影响,为其进一步开发提供直接的实验依据。
1 材料与方法
1.1 材料
1.1.1 动物:雄性SPF级8 周龄体质量20 g~24 g C57BL/6J小鼠[北京华阜康生物科技股份有限公司,SCXK(京)2019-0008]30只,饲养于川北医学院SPF级动物房,温度:(23±2)℃,湿度:45%~65%,自由摄食和饮水。
1.1.2 主要试剂:奥贝胆酸(上海毕得医药科技有限公司,纯度>98%);高脂饲料(Research diets公司);谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、游离脂肪酸(free fatty acid,FFA)、高密度脂蛋白总胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白总胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒(中生北控生物科技股份有限公司);Trizol和引物序列(Invitrogen公司);第一链cDNA合成试剂盒和qPCR试剂盒(北京全式金生物技术有限公司)。
1.2 方法
1.2.1 小鼠的分组及给药:根据体质量、血糖、TG和TC含量将HFD小鼠随机分为模型组(model)和奥贝胆酸干预组(OCA,10 mg/kg,连续给药6周),每组10只,喂正常饲料的10只小鼠作为对照组(control)。对照组和模型组灌胃给予0.5%羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)。
1.2.2 血清中生化指标的测定:末次给药后,眼内眦静脉丛取血0.8 mL,室温静置2 h后,4 ℃ 6 000 r/min离心10 min,留取血清,按说明书测定血清中脂质相关指标。
1.2.3 肝脏指数和肝脏脂质含量的测定:末次给药禁食6 h后,称重,处死小鼠,留取肝脏并称重,根据公式计算肝脏指数,肝脏指数=(肝脏质量/体质量)×100。称取一定质量的肝脏,加入预冷0.9%氯化钠溶液,手术剪尽可能剪碎,机械匀浆器匀浆,冰上静置40 min后,4 ℃ 12 000 r/min离心10 min,取上清液,按说明书测定肝脏内TG、TC和FFA含量,用BCA法测定上清液中蛋白质含量,最终结果用蛋白质浓度进行校正。
1.2.4 肝脏苏木精-伊红(hematoxylin-eosin,HE)染色检测肝组织形态:处死小鼠时留取部分肝脏固定于4%中性多聚甲醛中,石蜡包埋后用切片机切割为5 μm厚切片,之后用HE染色,染色之后用显微镜观察肝脏的形态。
1.2.5 RT-qPCR检测肝脏脂质代谢相关mRNA的表达水平:测定的mRNA包括FXR、小异二聚体伴侣(small heterodimer chaperone,SHP)、固醇调节元件结合蛋白(sterol regulatory element-binding protein,SREBP)、脂肪酸合酶(fatty acid synthase,FASN)、乙酰辅酶A羧化酶-1(acetyl-coenzyme A carboxylase 1,ACC1)、硬脂酰辅酶A去饱和酶-1(stearoyl-coenzyme A desaturase 1,SCD1)、肉碱棕榈酰转移酶-1α(carnitine palmitoyl transferase-1α,CPT1α)和细胞色素P450ω-羟化酶-4A14(cytochrome P450 omega-hydroxylase 4A14,CYP4A14)。实验方法为:称量一定质量的肝脏,加入Trizol,用剪刀将肝脏剪碎,机械匀浆,提取肝脏中的RNA,再用试剂盒将其反转录为cDNA,逆转条件为:25 ℃条件下10 min;之后42 ℃条件下15 min,最后85 ℃灭活5 min。随后进行扩增反应,其扩增条件为:95 ℃ 预变性30 s,之后95 ℃ 5 s,60 ℃ 10 s,进行40个循环,最后60 ℃条件下30 s。最终结果用相对定量法(2-ΔΔCt)进行分析。各目的基因的上下游引物(表1)。

表1 RT-qPCR引物序列Table 1 Primer sequence for RT-qPCR
1.3 统计学分析
2 结果
2.1 OCA改善HFD小鼠糖耐量异常并提高其胰岛素敏感性
在葡萄糖耐量实验(oral glucose toterance test,OGTT)实验中, 糖负荷后, 模型组HFD小鼠每个时间点的血糖和曲线下面积(area under the curve,AUC)明显高于对照组(P<0.01);OCA干预组显著降低模型组30 min、120 min(P<0.01)血糖及AUC(P<0.05)。在胰岛素数糖耐量实验(insulin tolerance test,ITT)中,小鼠注射胰岛素后,模型组各个时间点血糖和AUC明显高于对照组(P<0.01),OCA干预组明显降低模型组40 min血糖(P<0.01)和AUC(P<0.05)(图1)。
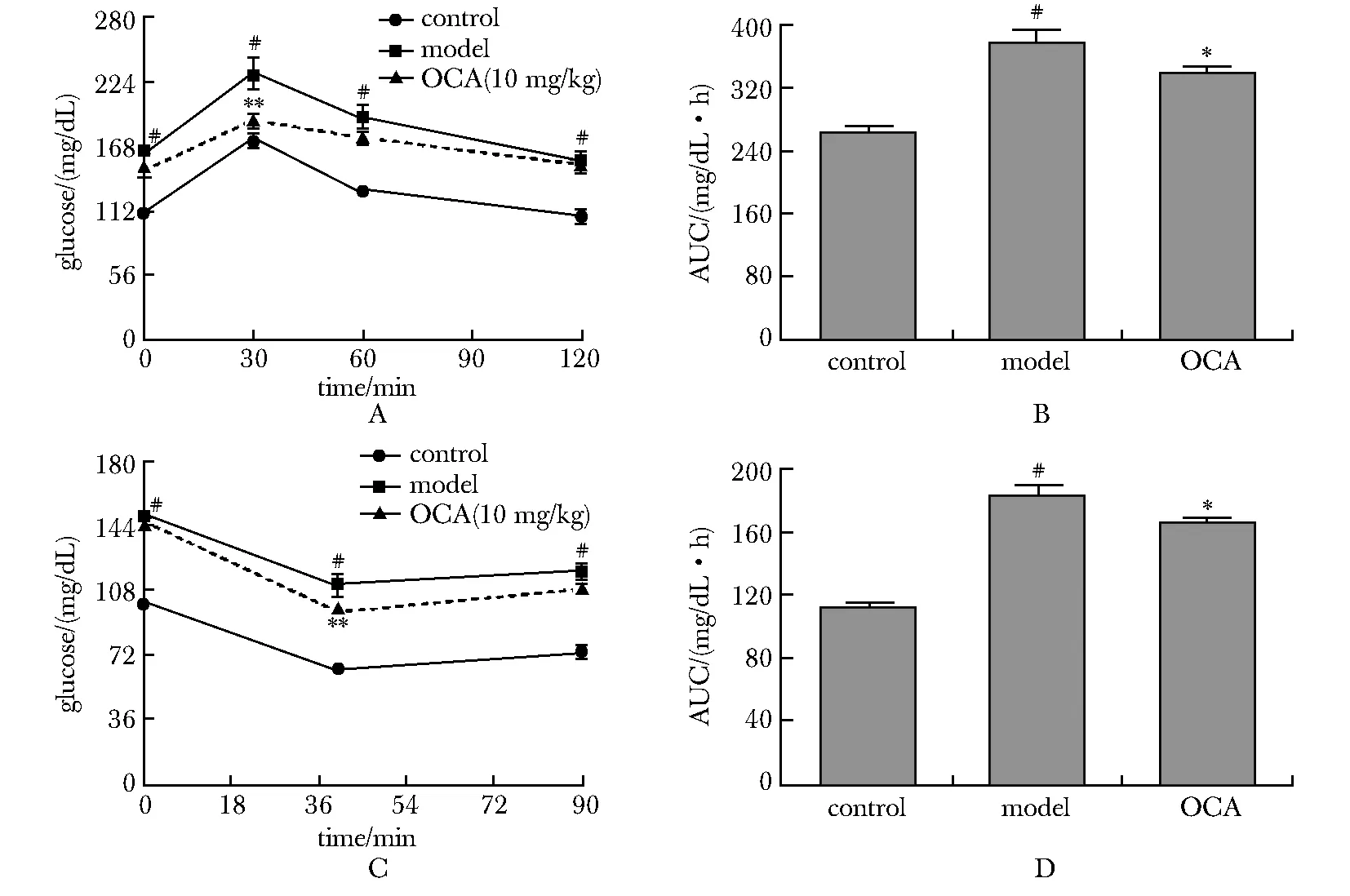
OGTT.oral glucose tolerance test; AUC.area under the curve; ITT.insulin tolerance test; OCA.obeticholic acid; HFD.high-fat diet; A.OGTT in mice; B.AUC in OGTT; C.ITT in mice; D.AUC in ITT; #P<0.05, ##P<0.01 compared with control group; *P<0.05, **P<0.01 compared with model group
2.2 OCA改善HFD小鼠血脂代谢紊乱
模型组小鼠血清中TG(P<0.05)、TC、LDL-C和FFA含量明显高于对照组(P<0.01),HDL-C含量明显低于对照组(P<0.01);OCA干预组显著降低模型组小鼠血清中TG(P<0.05)、TC、LDL-C和FFA含量(P<0.01),升高HDL-C水平(P<0.01)(表2)。
表2 OCA减轻HFD小鼠血脂代谢紊乱Table 2 OCA reduced the disorder of blood lipid metabolism in HFD mice n=10)
2.3 OCA降低HFD小鼠血清中ALT和AST活性
模型组小鼠清中ALT(P<0.05)和AST(P<0.01)活性明显强于对照组,表明高脂饲料喂养对肝脏功能有一定的损害;OCA干预组明显降低模型组小鼠血清中ALT(P<0.05)和AST(P<0.01)活性(图2)。
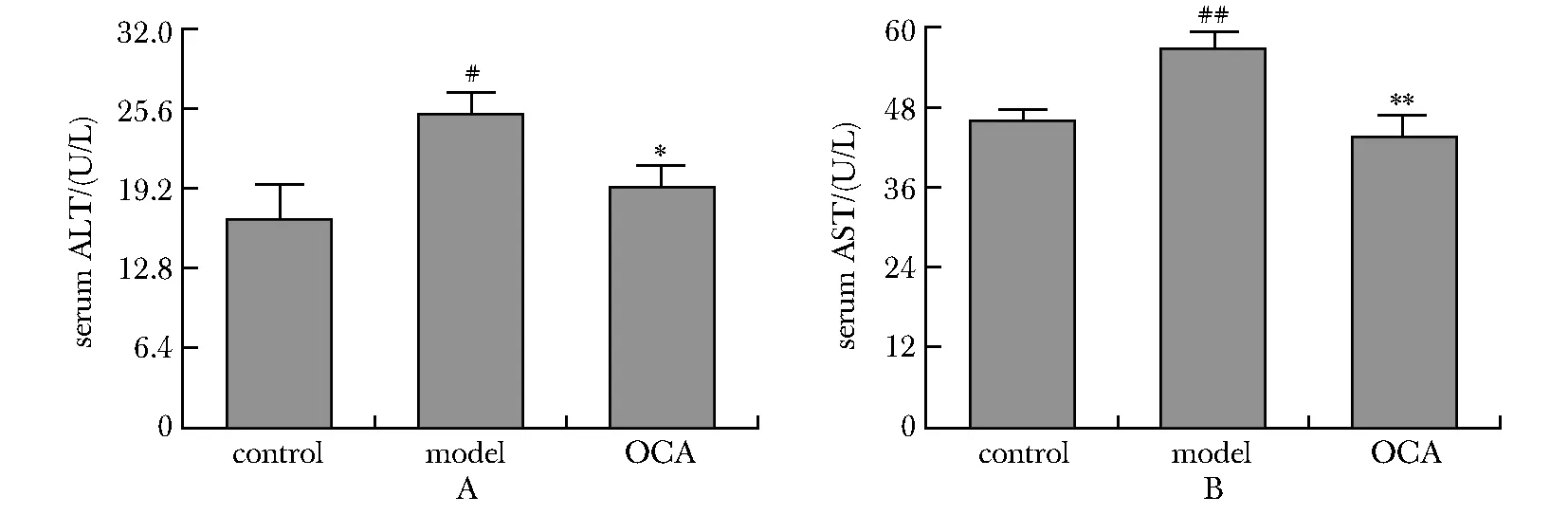
ALT.alanine aminotransferase; AST.aspartate aminotransferase; OCA.obeticholic acid; HFD.high-fat diet; A.ALT activities in serum; B.AST activities in serum; #P<0.05, ##P<0.01 compared with control group; *P<0.05, **P<0.01 compared with model group
2.4 OCA改善HFD小鼠肝脏脂肪变性
HE染色结果表明,对照组小鼠肝小叶结构正常, 肝细胞排列规则,肝索结构清晰可辨,未见肝细胞脂肪变性、坏死等;模型组小鼠肝脏中可见许多大小不一的空泡状的脂滴,肝细胞排列杂乱并伴有坏死,肝索结构受损;OCA干预组对这些异常变化都有一定的改善(图3)。脂质代谢相关指标测定结果表明,模型组小鼠肝脏内TG、TC和FFA含量明显高于对照组(P<0.01);OCA干预组明显降低模型组小鼠肝脏内TG(P<0.01)、TC(P<0.05)和FFA(P<0.01)含量;此外,OCA明显降低模型组小鼠的肝脏指数(P<0.05)(表3)。
表3 OCA降低HFD小鼠肝脏脂质含量并降低肝脏指数Table 3 OCA reduced the liver lipid content and liver index in HFD mice n=10)
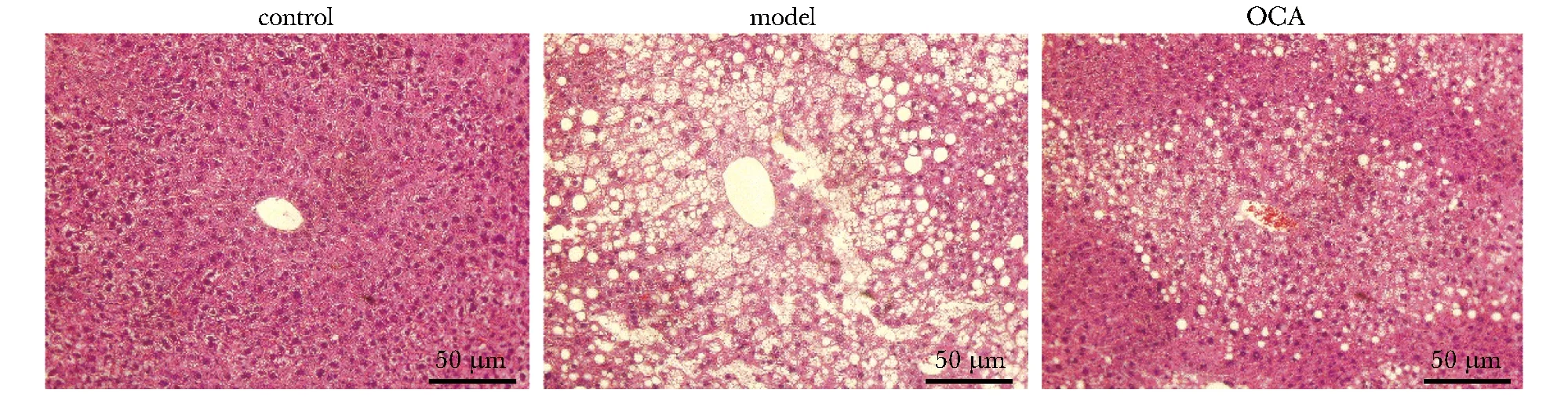
图3 OCA对HFD小鼠肝组织形态的影响Fig 3 Effect of OCA on the morphology of liver in HFD mice
2.5 OCA调节HFD小鼠肝脏中脂质代谢相关基因表达
模型组小鼠肝脏中基因Fxr(P<0.01)、Shp(P<0.05)、Cpt1α(P<0.01)和Cyp4a14(P<0.01)的表达低于对照组,基因Srebp(P<0.01)、Fasn(P<0.01)、Acc1(P<0.05)、Scd1(P<0.01)的表达高于对照组;OCA干预组明显增加模型组小鼠肝脏中基因Fxr、Shp、Cpt1α和Cyp4a14的表达(P<0.01),降低模型组小鼠肝脏基因Srebp、Fasn、Acc1的表达(P<0.05),具有降低模型组小鼠肝脏基因Scd1表达的趋势(表4)。
表4 OCA调节HFD小鼠肝脏中脂质代谢相关基因表达
3 讨论
OCA是激活FXR受体最具代表性且具有良好活性的一种化合物。研究报道OAC能明显改善NAFLD、NASH以及调节2型糖尿病KKAy小鼠的糖脂代谢[6-8]。本研究证实OCA对HFD小鼠的糖耐量异常、胰岛素抵抗和肝脏脂肪变性有改善作用。
本研究发现OCA对HFD小鼠的糖代谢有一定的作用,能明显改善小鼠的糖耐量受损,提高其对胰岛素的敏感性,与报道一致[9-10]。长期高脂饮食导致脂质代谢紊乱,脂质代谢紊乱又会促使糖代谢异常,结果发现OCA明显改善HFD小鼠血清中脂质代谢相关指标,提示OCA改善糖代谢可能与其调节脂质代谢有关。肝脏是机体调节糖代谢最重要的器官,HFD容易引起肝脏脂质蓄积,导致肝脏重量增加和功能受损[11]。血清ALT和AST是HFD、高胆固醇饮食和酒精引起肝组织损伤的标志酶(酶学指标)。本研究显示,OCA明显降低HFD小鼠血清中这两个酶的活性;HE染色和肝脏内脂质测定结果表明,OCA明显降低肝脏内脂质堆积,改善肝脏病理结构异常,进一步明确,OCA对肝脏有保护作用。同时推测,OCA可能通过延缓肝脏脂肪变性而改善肝脏功能,进而对HFD小鼠的糖代谢有一定的影响。后续研究OCA如何改善HFD小鼠肝脏脂肪变性。FXR是一种配体激活的转录因子和核受体超家族的成员之一,配体与FXR结合后会诱导其结构发生变化,同时使DNA结合结构域与靶基因启动子中的FXR应答元件结合,进而启动FXR转录而调节靶基因,从而参与多种代谢途径的调节[12]。SREBP也是一种核转录因子,通过调控脂质相关基因(FASN、ACC1和SCD1)的表达,促进肝脏FFA及TG的合成[13]。据报道,FXR通过增强SHP的表达来抑制SREBP的表达,进而调节脂质代谢[14]。小鼠肝脏中这些基因表达的测定结果,确实发现OCA增加基因Fxr、Shp表达,抑制SREBP表达。不仅如此,OCA对SREBP下游与脂质合成及氧化相关基因的表达也有一定的调节作用。这些结果说明,OCA可能通过调节FXR/SHP/SREBP信号途径来改善HFD小鼠肝脏脂肪变性。
综上,本研究发现,OCA能改善HFD小鼠的糖耐量异常和血脂代谢紊乱,提高其对胰岛素的敏感性,减轻HFD小鼠肝脏脂肪变性,其机制可能与调节FXR/SREBP信号途径有关。
