青蒿和槟榔制剂浸泡对锦鲤非特异性免疫因子活性、鳃及鳃丝组织病变的影响
2023-05-01马娇娇许斌韦永春曹鑫盛张震张其杰陈成勋
马娇娇,许斌,韦永春,曹鑫盛,张震,张其杰,陈成勋
(1.天津农学院天津水产生态及养殖重点实验室,天津 300380;2.天津隆锦水产养殖有限公司,天津 300382;3.天津赞兰科技有限公司,天津 300380)
锦鲤(Cyprinus carpio)体格健美、色彩艳丽,具极高的观赏和饲养价值,有“水中活宝石”、“会游泳的艺术品”的美称[1]。但养殖过程中,经常受到体表寄生虫及细菌性疾病的困扰,且病症出现晚,难以治疗,因此,疾病的防治极为重要。锦鲤疾病通常有真菌性疾病、细菌性疾病、寄生虫性疾病等[2]。如水霉病、细菌性疾病等。细菌性疾病的产生主要是水环境极容易产生细菌,如白皮病、烂鳃病等,都属于细菌性疾病。水产养殖中,不可避免会产生寄生虫的疾病,如小瓜虫、苯尼登虫等。这四种水产养殖病害,药物控制方法相对较为有效,而药物控制方法分别为治疗性药物以及预防性药物两种类型[3,4]。现阶段,我国针对水产病害研发的水产疫苗仅有几种确定可行,因此寻找可利用的水产疾病预防方法十分重要[4]。
中草药是我国纯天然的医药瑰宝,具有安全性高、毒副作用小、抗药性弱、价格低等优点。此外,中草药还具有驱虫,防病治病,抗菌及增强免疫力等作用[5]。既往研究表明,青蒿(Areca catechu)和槟榔(Artemisia carvifolia)对灭杀大菱鲆(Scophthalmus maximus)体外纤毛虫有良好效果;对锦鲤鳃部指环虫有一定灭杀效果。在防治锦鲤疾中,中草药的应用方式主要有饲料添加以及药物浸泡等。本试验使用药物浸泡方法研究青蒿和槟榔制剂对锦鲤血清免疫指标及鳃部组织的影响,可为水产养殖疾病的中药防治提供参考。
1 材料与方法
1.1 材料
锦鲤购自天津隆锦水产养殖有限公司,消毒处理后放入养殖箱中暂养3 d,以适应环境。
本试验所用中药为天津隆锦水产养殖有限公司提供,青蒿与槟榔1∶1 混合,粉碎后过40 目筛,后分别称重装入无纺布袋,形成缓解溶液的形式,放干燥阴凉处备用。
1.2 方法
选取健康、标准和规格基本一致的平均体质量(45.00±3.00)g,平均体长(17.00±2.00)cm 的锦鲤375 尾,分为5 组,每组3 个平行。挂袋药浴浓度分别为0 mg·L-1(对照组)、6.25 mg·L-1(A 组)、12.5 mg·L-1(B 组)、125 mg·L-1(C 组)和250 mg·L-1(D组)。试验用养殖箱规格为780 mm×575 mm×467 mm(实际加水110 L)。
每天早9 时和晚16 时投喂基础饲料,饲料购自天津隆锦水产养殖有限公司,粗蛋白含量为30%,粗脂肪含量为6%,投饲率为1%~2%,水温控制在(28.5±1.0)℃,pH7.0~7.5,溶解氧5~6 mg·L-1,清理袋子保证药物释放。试验开始的第0 d、3 d、6 d、9 d、12 d 以及15 d 从每个养殖箱中随机取3 尾鱼进行腹部抽血,采用加入edta 的抗凝试管保存。通过离心机将血液总量的三分之一取上清液,4℃、2 500 r/min 离心20 min 后置于-20℃中保存,用于溶菌酶(LZM)活性的测定。剩余血液置于室温中凝集20 min 后,以2 500 r·min-1速度离心20 min,仔细收集上清液保存于-20 ℃以备测定C3a、C5aR、IL-6、LZM、PGE2 及PGF-2a。试验开始第0 d,随机取3 尾抽血后的鱼,置于冰上取鳃部组织,用生理盐水清洗后,放入福尔马林固定液中,用于制作组织切片。试验开始第9 d,将所有抽血后的鱼置于冰上取鳃部组织,用生理盐水清洗后,放入福尔马林固定液中,用于制作组织切片。
鱼鳃切片制作参照周凯(2019)切片制作方法,用HE 染色[6];C3a、C5aR、PGE2、PGF-2a、LZM 和IL-6 采用南京建成生物工程研究所试剂盒进行测定。
1.3 数据统计
所有数据以平均值±标准误表示,用SPSS 22.0进行单因素方差分析(one-way ANOVA)和LSD 法多重进行比较分析,P<0.05 为差异显著性标准。标准曲线采用WPS 2019 绘制。
2 结果与分析
2.1 青蒿和槟榔制剂浸泡对锦鲤血清中C3a 含量的影响
同一天内,实验组与对照组锦鲤血清中C3a 含量在第3 d、6 d、9 d、12 d、15 d 与第0 d 相比变化显著,且与浸泡浓度成正比(P<0.05);同一组中,C3a含量随着浸泡天数增加先升高后降低,在第9 d 达最高值,除对照组外,其他组第3 d、6 d、9 d、12 d、15 d 与第0 d 相比变化显著(P<0.05)。D 组C3a 含量第9 d 达最高值(表1)。

表1 药物浸泡对锦鲤血清C3a 含量的影响Tab.1 Effect of drug soaking on serum C3a content of koi carp(Cyprinus carpio)
2.2 青蒿和槟榔制剂浸泡对锦鲤血清中C5aR 含量的影响
同一天内,各实验组与对照组锦鲤血清中C5aR 含量无显著变化(P>0.05);同一组中,C5aR 含量随着天数增加先增高后降低,D 组第3 d、6 d、9 d、12 d 与第0 d C5aR 含量变化显著(P<0.05);其余各组C5aR 含量无显著变化(P>0.05)。B 组C5aR 含量第12 d 达最高值(表2)。
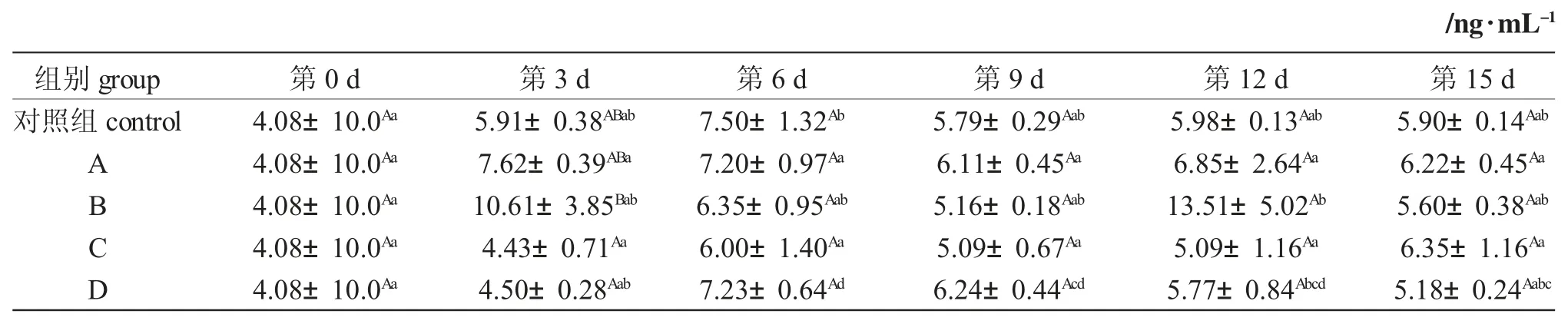
表2 不同浸泡浓度对锦鲤血清中C5aR 含量的影响Tab.2 Effect of different soaking concentration on C5aR content in serum of koi carp Cyprinus carpio
2.3 青蒿和槟榔制剂浸泡对锦鲤血清中PGE2 含量的影响
同一天内,实验组与对照组锦鲤血清中PGE2含量在第3 d、6 d、9 d、12 d、15 d 与第0 d 相比变化显著,与浸泡浓度成正比(P<0.05);同一组中,PGE2含量随着天数增加先升高后降低,在第9 d 达最高值,且第3 d、6 d、9 d、12 d、15 d 与第0 d 相比变化显著(P<0.05)。PGE2 含量在浸泡浓度D 组第9 d 达最高值(表3)。

表3 药物浸泡对锦鲤血清PGE2 含量的影响Tab.3 Effect of drug soaking on serum PGE2 content of koi carp Cyprinus carpio
2.4 青蒿和槟榔制剂浸泡对锦鲤血清中PGF-2a含量的影响
同一天内,各实验组与对照组锦鲤血清中PGF-2α 含量无显著变化(P>0.05);同一组中,PGF-2α 含量与0 d 相比显著升高(P<0.05),B、C、D 组第3 d、6 d、9 d、12 d、15 d 与第0 d C5aR 含量变化显著(P<0.05);其余组PGF-2α 含量无显著变化(P>0.05)。PGF-2a 含量在B 组第12 d 达到最高值(表4)。

表4 不同浸泡浓度对锦鲤PGF-2α 含量的影响Tab.4 Effects of different soaking concentrations on PGF-2 α content of koi carp Cyprinus carpio
2.5 青蒿和槟榔制剂浸泡对锦鲤血清中LZM 含量的影响
同一天内,实验组与对照组锦鲤血清中LZM含量变化显著,且与浸泡浓度成正比(P<0.05);同一组中,LZM含量随着天数增加先升高后降低,在第9 d 达最高值,且第3 d、6 d、9 d、12 d、15 d 与第0 d 相比变化显著(P<0.05)。LZM含量在D 组第9 d 达最高值(表5)。

表5 药物浸泡对锦鲤血清LZM 含量的影响Tab.5 Effect of drug soaking on LZM activity in serum of koi carp Cyprinus carpio
2.6 青蒿和槟榔制剂浸泡对锦鲤血清中IL-6 含量的影响
同一天内,D 组锦鲤血清中IL-6 含量在第12 d、15 d 与其他组相比显著增高(P<0.05),其余各组均无显著变化(P>0.05);同一组中,对照组及A、B、C 组IL-6 含量先增加后降低,C 组在第3 d 达到最高,其他组第6 d 达最高值,变化不显著(P>0.05);而D 组呈现先降低后升高的趋势,且第12 d、15 d变化显著(P<0.05)。IL-6 含量在浸泡浓度D 组第9 d 达到最高值(表6)。

表6 不同浸泡浓度对锦鲤血清中IL-6 含量的影响Tab.6 Effects of different soaking concentrations on the content of IL-6 in serum of koi carp Cyprinus carpio
2.7 青蒿和槟榔制剂浸泡对锦鲤鳃部表观变化的影响
对照组第9 d 鳃丝出现病变,各实验组锦鲤鳃部未出现明显形态学异常变化,鳃丝末端并没有因药物浓度变大而充血、红肿,炎症细胞也没有增多(图1)。

图1 不同浸泡浓度对锦鲤鳃部表观变化的影响Fig.1 The effect of different immersion concentration on the apparent changes of the gill of koi carp Cyprinus carpio
3 讨论
3.1 青蒿和槟榔制剂浸泡对锦鲤血清中C3a 和C5aR 含量的影响
补体系统是一个具有精密调控机制的复杂生物反应系统[7]。补体C3a、C5a 主要是通过特异性激活其相应的补体片段3a 受体(C3aR receptor,C3aR)、补体片段5a 受体(C5aR receptor,C5aR)来发挥生物学效应。吕丽刚[8]证实了草鱼(Ctenopharyngodon idella)C5、C5a 和C5aR 在抗草鱼呼肠孤病毒(GCRV)感染过程中具有免疫效应。其中补体活化的产物C3a 可与其受体结合引发下游信号通路发挥出诱导炎症等生物学效应[9]。补体C3 功能轴的下游通路与C3 激活后的产物包含核转录因子(NF-κB)、磷脂酰肌醇-3-羟激酶(PI3K/Akt)等炎症通路及IL-6、肿瘤坏死因子(TNF-α)等炎症因子[10]。C3a 在机体防御过程中可通过调理吞噬细胞、免疫作用等机制清除病原体[11]。而孟兆娜[12]等发现,复方中草药能显著提升镜鲤(Cyprinus carpio var.specularis)幼鱼的补体C3a。
C5aR 广泛分布于免疫细胞和机体组织中[13],与机体局部的C5a 结合后活性表达。C5aR 是补体裂解片段中表达过敏毒素作用最强的介质[14]。高浓度的C5aR 可以增强机体的免疫力[15],高浓度的C5aR可导致炎症反应使机体严重受损[16,17]。研究发现,虹鳟(Oncorhynchus mykiss)C5aR 存在于B 淋巴细胞和粒细胞表面[18],C5aR 只与虹鳟外周血细胞中的粒细胞结合[18],C5aR 抗体能抑制补体活化后虹鳟外周血细胞向过敏毒素片段蛋白的趋化现象[19]。
本实验中,数据分析得知青蒿与槟榔浸泡锦鲤初期C3a 和C5aR 含量升高,表明补体系统激活后,C3a、C5aR 含量降低,炎性减弱,可能与药物沉积及鱼体适应有关,且含量与药物浓度成正比。表明该复方药物能调节锦鲤血清C3a、C5aR 含量起到了消炎作用,与张雪飞等[20]的研究结果一致。
3.2 青蒿和槟榔制剂浸泡对锦鲤血清中PGE2 和PGF-2a 含量的影响
前列腺素E2(prostaglandin E2,PGE2)是在致炎因子作用下,局部组织产生和释放的、具有致炎致痛作用的炎症介质(Inflammatory mediator),主要有松弛子宫平滑肌,抑制子宫平滑肌自发性收缩等生理功能[21]。赵卫红[22]研究表明,大弹涂鱼(Boleophthalmus pectinirostris)产卵过程通过17α-羟基孕酮和前列腺素F2a(prostaglandin F2a,PGF-2a)调控,可以强烈地收缩子宫平滑肌,降低子宫内流血量[23]。正常情况下,两者动态平衡,共同调节着子宫平滑肌的收缩和松弛。病理情况下,一旦产生过多PGF-2a,使得PGF-2a/PGE2 比值增大,就会导致子宫平滑肌收缩,引起痉挛和疼痛。张爽[24]等在研究中药散剂益母散对孕鼠子宫平滑肌张力影响的试验中检测发现,孕鼠血清中PGE2 含量显著提高,且能提升孕鼠子宫平滑肌的张力来促进孕鼠分娩。而柳建昌等[25]研究发现,PGE2 对家鱼具有催产作用;对大鼠的8-细胞胚胎产生抑制囊胚作用[26];邓洁等[27]用一定浓度的槟榔碱对小鼠进行灌胃后发现,胎鼠外周血DNA 有一定程度的损伤,畸形率增高,且对胎鼠各项生长发育指标有较大影响,说明槟榔碱除了抑制胚胎生长发育,还对胚胎发育产生毒性作用。作为冷血动物的锦鲤,性腺发育由温度、营养、水流等环境因素和自身激素影响,性腺发育良好的锦鲤才能够进行产卵[28]。PGF-2a 对水产动物性腺的影响未见报道。
本试验测得除对照组外,锦鲤血清PGE2 和PGF-2a 含量相比第0 d 升高,但PGF-2a/PGE2 比值降低。各个实验组PGE2 都显著升高,B、C、D 组PGF-2a 显著升高,对照组和A 组升高不显著,表明高浓度该复方药物可能会抑制锦鲤胚胎发育。第0 d 时初始各组数据差异均不明显(P>0.05),说明各组鱼初始健康状况与体质均相同。
3.3 青蒿和槟榔制剂浸泡对锦鲤血清中LZM 含量的影响
溶菌酶(LZM)广泛存在于人与多种动物体内,是一种能水解致病菌中黏多糖的碱性酶和机体非特异性免疫的第一道屏障,主要是对革兰氏阳性菌发挥溶菌作用[29]。中草药对鱼类LZM含量调节的报道很多。谭娟等[30]研究发现,在草鱼幼鱼的饲料中添加一定量的鱼腥草复方制剂,能显著提升幼鱼体内LZM的含量。蔡中华等[31]用复方中草药投喂鲤使鱼免疫器官质量增加,溶菌酶活性及吞噬能力增强,特异性免疫能力显著提高。
李华等[32]在投喂了复方中草药后大菱鲆体内LZM的含量先升高后降低,与本试验结果相似,均呈现出先显著增长再显著降低的趋势,表明浸泡初期,炎性增加,LZM含量上升消除致病菌,后炎性减弱,LZM含量下降。表明试验所用药物可通过提高锦鲤体内LZM的含量,达到提高鱼体的抗菌能力的效果。
3.4 青蒿和槟榔制剂浸泡对锦鲤血清中IL-6 含量的影响
IL-6 作为具有生物学效应的细胞因子,具有促炎[32,33]、优先驱动巨噬细胞分化的作用,鱼类IL-6的功能已引起重视。机体受到病原刺激、发生炎症反应时,能诱导IL-6 表达,因而常作为系统促炎症因子激活的标志物。在用嗜水气单胞杆菌(Aeromonas hydrophila)感染武昌鱼(Megalobrama amblycephala)实验中发现,IL-6 体内的含量有明显提升,说明了IL-6 在机体免疫过程有重要作用。其他的实验还表明,在病原体入侵时,IL-6 促使机体产生抗菌肽抵抗病原体[34]。杨雨生[35]在饲料中添加姜黄素投喂黄颡鱼(Pelteobagrus fulvidraco)8 周后,其体内IL-6 含量明显增加,免疫力提高。
本试验中,IL-6 含量初期升高,鱼体浸泡初期机体发生炎症反应,表明该复方药物对锦鲤产生一定毒性;当药物浓度低于250 mg·L-1时,随着时间增加,鱼体本身适应性,IL-6 含量调控到正常,炎症缓解;当药物浓度达到250 mg·L-1时,毒性增强,随时间增加,重炎症反应加重,表明毒性与剂量成正比,与邹霞辉等[35,36]研究结果一致。
3.5 青蒿和槟榔制剂浸泡对锦鲤鳃部表观的影响
过量使用化学药物时,经常引起鱼类鳃丝红肿,如较高铜离子浓度下,鲤的部分鳃小片末端受刺激充满红细胞,导致毛细血管明显扩张,膨大肿胀[37]。本实验结果表明,对照组鳃丝第9 d 出现病变,而各浸泡组锦鲤鳃部鳃丝末端未见膨大,炎症细胞未见增多,表明此中药配方对锦鲤鳃组织无负面影响。
3.6 结论
青蒿槟榔1∶1 制剂在适量范围内可以调节锦鲤体内的炎性因子,增强非特异性免疫;能调节锦鲤血清C3a、C5aR 含量,起到消炎作用。该制剂可能会对锦鲤胚胎发育产生抑制作用,但综合来看,对锦鲤鳃组织无负面影响。浸泡浓度250 mg·L-1的组对以上锦鲤病理及生理过程的调控效果较好。
