中国药典和欧洲药典盐酸万古霉素有关物质检测方法的比较研究
2023-04-29赵燕金杨巧李泽南徐慧娟易芬芬
赵燕 金杨巧 李泽南徐慧娟 易芬芬

摘要:目的 比较并讨论《中国药典》和《欧洲药典》中盐酸万古霉素有关物质的检测方法,为完善盐酸万古霉素及注射用盐酸万古霉素有关物质的检测方法提供科学依据。方法 采用《中国药典》2020年版(ChP2020)和《欧洲药典》10.0版(EP10.0)有关物质方法,分别对系统适用性试验、空白辅料干扰试验、强制降解试验和样品进行有关物质检测,对色谱行为、已知杂质、有关物质测定结果和杂质控制策略等进行比较。结果 两种药典方法中色谱条件、系统适应用性要求和杂质控制策略存在较大差异。EP方法对特定杂质的分离效能优于ChP,且样品中检测出的杂质数量大于或等于ChP,但两种药典方法检测得到的总杂质含量结果无明显差异。结论 建议测定盐酸万古霉素及注射用盐酸万古霉素有关物质时推广使用EP10.0中的有关物质检测方法。
关键词:中国药典;欧洲药典;盐酸万古霉素;注射用盐酸万古霉素;有关物质
中图分类号:R978.1 文献标志码:A 文章编号:1001-8751(2023)04-0281-09
Comparative Study on Determination Methods of Vancomycin Hydrochloride Chinese Pharmacopoeia and European Pharmacopeia
Zhao Yan1, Jin Yang-qiao1, Li Ze-nan1, Xu Hui-juan2, Yi Fen-fen2
(1 Hai Zheng Pharmaceutical Co., LTD, Hangzhou 311400; 2 Hanhui Pharmaceuticals Co.,Ltd., Hangzhou 310016)
Abstract:Objective To compare and discuss the determination methods of vancomycin hydrochloride related substances in Chinese Pharmacopoeia (ChP) and European Pharmacopeial (EP), so as to provide the scientific basis for the determination of related substances in vancomycin hydrochloride and vancomycin hydrochloride for injection. Methods The vancomycin hydrochloride related substances were determined by adopting the methods of related substances quality standard contained in ChP2020 and EP10.0. The system suitability, blank excipient interference test, forced degradation and samples were tested. Comparisons were made between the chromatographic behavior, known impurities, associated compounds determination results, and impurity control technique. Results The chromatographic conditions, system applicability requirements and impurity control strategy of two methods have a large difference. The EP approach was more effective than ChP at separating particular impurities, and the levels of impurities found in the samples were greater than or on par with those found in ChP. However, there was no significant difference in the total contents of impurity between the two pharmacopoeia methods. Conclusion It is suggested that EP10.0 should be widely used in the determination of vancomycin hydrochloride and vancomycin hydrochloride for injection.
Key words:ChP; EP; vancomycin hydrochloride; vancomycin hydrochloride for injection; related substances
万古霉素(VaIlcomycin)是东方链霉菌(Streptomyces orientalis)产生的一种三环糖肽类抗生素,主要用来预防和治疗革兰阳性菌所造成的感染,被视为“最后一线药物”治疗所有抗生素均无效的严重感染[1]。其作用机制为结合敏感细菌细胞壁前体肽聚末端的丙氨酰丙氨酸,阻断肽聚糖合成,导致细胞壁缺损而杀灭细菌,并且还可通过改变细菌细胞膜渗透性来选择性地抑制RNA的合成。目前,临床上多使用其盐酸盐进行治疗。
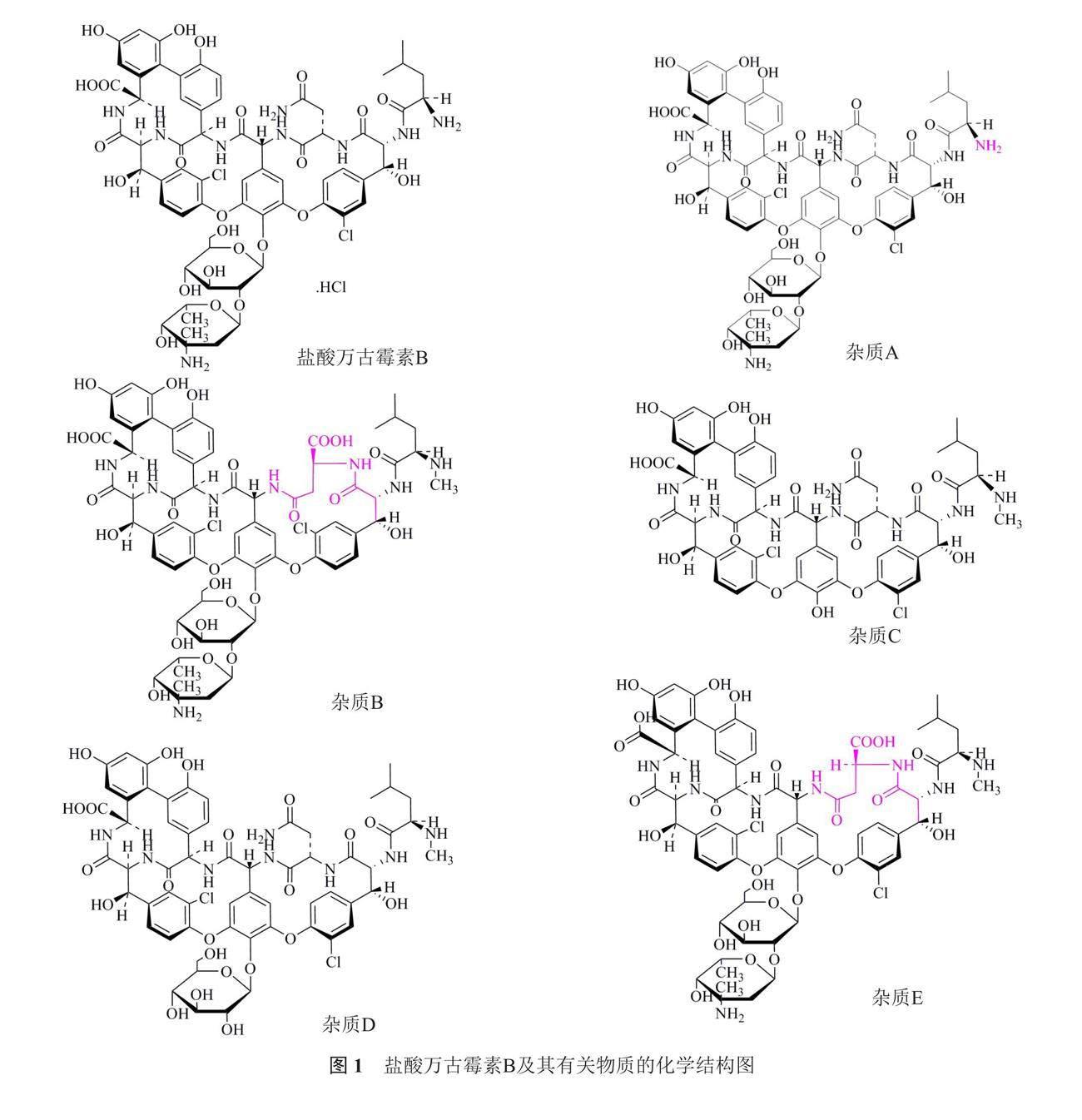
1958年,注射用盐酸万古霉素作为第一个(糖)肽类抗生素品种获得美国食品药品监督管理局(FDA)许可上市使用。原研制剂注射用盐酸万古霉素(稳可信)由礼来(Eli Lily)公司生产。盐酸万古霉素及其已知杂质(A~L)结构见图1,其中已知杂质M结构未确定。本品种收载于中国药典2020年版(ChP2020)二部[2]、《日本药典》17版[3]、《美国药典》43版[4]、欧洲药典10.0(EP10.0)版[5]等国际药典中。对比各国药典中盐酸万古霉素有关物质检测方法,日本药典、美国药典以及进口注册标准JX20130179与中国药典的分析方法相同,均采用普通HPLC和常规粒径(5μm)的C18色谱柱。流动相配制,稀释剂,检测波长,进样体积,系统适应性溶液,色谱柱和计算方法(自身对照法)均一致,仅在样品浓度,体积流量以及梯度洗脱程序上存在细微差异。欧洲药典的分析方法则与其余四个检测方法有较大差异,采用了超高效液相色谱仪(UPLC)以及分离效果更好的小粒径(1.7 μm)色谱柱。故本研究采用盐酸万古霉素有关物质检测方法差异较大的ChP2020和EP10.0两种方法对其有关物质进行检查,并对结果加以比较和分析,拟制定更严格的有关物质分析方法。
1 仪器与材料
安捷伦高效液相色谱仪1260,安捷伦超高效液相1290,色谱柱:Thermo ODS HYPERSIL柱(4.6 mm×250 mm, 5 μm);Acquity C18 CSH柱(2.1 mm×150 mm, 1.7 μm)。甲醇(色谱级,Thermo Fisher Scientific),乙腈(色谱纯,新蓝景化学工业有限公司), 四氢呋喃(色谱纯,国药集团化学试剂有限公司),磷酸(分析纯,国药集团化学试剂有限公司),三乙胺(分析纯,国药集团化学试剂有限公司),盐酸(分析纯,杭州化学试剂有限公司),氢氧化钠(分析纯,杭州萧山化学试剂有限公司),30%过氧化氢(分析纯,国药集团化学试剂有限公司),三羟甲基氨基甲烷(分析纯,Sigma),纯化水。
万古霉素系统适应性标准品(European Pharmacopeia(Ph.Eur.) ,批号:1.0),杂质A(Molcan Corporation,批号:171218),杂质B(Molcan Corporation,批号:141027),杂质C(Molcan Corporation,批号:170906),杂质D(Molcan Corporation,批号:170910),万古霉素标准品(中国食品药品检定研究院,批号:130360-201302),稳可信[Vianexs.A.(Pliant C)希腊,批号:C940434、C822077],自制注射用盐酸万古霉素三批(海正药业杭州有限公司,批号:A、B、C),盐酸万古霉素原料药二批(海正药业杭州有限公司,批号:1.0、2.0)。
2 方法与结果
2.1 色谱条件及溶液配制
ChP2020和EP10.0有关物质测定方法的色谱条件及溶液制备见表1。
2.2 系统适用性试验比较
ChP2020有关物质检查方法采用Thermo ODS HYPERSIL色谱柱(4.6 mm×250 mm, 5 μm),具体方法见表1,梯度洗脱,体积流量1.0 mL/min, 进样量20 μL,供试品溶液质量浓度2 mg/mL;EP10.0有关物质检查方法采用Acquity C18 CSH柱(2.1 mm×150 mm, 1.7 μm),具体方法见表1,梯度洗脱,体积流量0.3 mL/min,进样量2 μL,供试品溶液质量浓度 4 mg/mL,杂质A对照品溶液质量浓度0.12 mg/mL,杂质B对照品溶液质量浓度0.08 mg/mL,杂质C对照品溶液质量浓度0.04 mg/mL,杂质D对照品溶液质量浓度0.06 mg/mL,具体方法见表1,分别记录不同色谱条件下供试品溶液和杂质对照品溶液的色谱图,比较其专属性,结果见表3。
由于仅采购到欧洲药典标准的四个已知杂质(杂质A~D),故本实验采用已购的四个杂质进行专属性试验,同时采购到欧洲药典标准的系统适用性标准品可用于EP10.0方法下特定杂质(杂质A~M)的定位,见图2。结果显示ChP2020和EP10.0两种方法检出的注射用盐酸万古霉素样品中有关物质均符合各自规定。但EP10.0方法杂质分离度更好,检出的已知杂质更多,见图3。
2.3 空白辅料的干扰试验
按照供试品浓度分别配制1倍处方量和3倍处方量的空白辅料样品溶液。按照ChP2020及EP10.0液相条件,记录色谱图,见图4,结果显示两种检测方法均未检测到辅料色谱峰。
2.4 强制降解试验比较
盐酸万古霉素受热后易产生化学结构分解,因此通过热降解得到更多的杂质,同时再进行酸降解、碱降解和氧化降解,以考察ChP2020和EP10.0方法对其杂质的分离效能。热降解样品配制:按照表1中供试品溶液浓度配制,取供试品适量,分别在105 ℃的高温条件下暴露8 h后用稀释剂溶解完全转移至容量瓶中并稀释至刻度,摇匀作为热降解样品溶液;酸降解样品配制:按照表1中供试品溶液浓度配制,取供试品适量,分别置容量瓶中,加入0.5 mol/L盐酸溶液5.0 mL,在室温下放置15 h后加0.5 mol/L氢氧化钠溶液中和,加稀释剂溶解并稀释至刻度,摇匀作为酸降解样品溶液;碱降解样品配制:按照表1中供试品溶液浓度配制,取供试品适量,分别置容量瓶中,加入1 mol/L氢氧化钠溶液5.0 mL,在室温下放置15 h后加1 mol/L盐酸溶液中和,加稀释剂溶解并稀释摇匀作为碱降解样品溶液;氧化降解样品配制:按照表1中供试品溶液浓度配制,取供试品适量,分别置容量瓶中,加入5%双氧水溶液5.0 mL,在室温下放置24 h后,加稀释剂溶解并稀释摇匀作为氧化降解样品溶液。分别按表1中ChP2020和EP10.0色谱条件进行测试,记录色谱图。
结果显示,经热降解、酸降解、碱降解的注射用盐酸万古霉素样品,杂质数量及杂质含量均明显增加,同时氧化降解的注射用盐酸万古霉素样品与未降解样品相比,杂质数量和总杂质含量均未有明显增加,说明注射用盐酸万古霉素在氧化条件下较稳定。ChP2020和EP10.0方法测得的主峰峰纯度均符合要求,主峰与相邻峰之间均达到分离要求,总杂质含量无明显差异。经热降解、酸降解、碱降解的注射用盐酸万古霉素样品采用ChP2020系统分析,可检测到12~14个杂质,在6~10 min处的杂质色谱峰相连,分离较差,杂质C和杂质D可被有效分离,色谱图详见图5。采用EP10.0液相系统分析,可检测到13~19个杂质,各杂质分离度较好(图6)。两种测定方法在酸降解条件下,杂质D均为最大杂质。2.5 杂质控制限度比较
ChP2020采用自身对照法计算杂质含量,EP10.0采用面积归一化法计算杂质含量,并且杂质控制策略明显不同,见表4。
2.6 杂质检测结果比较
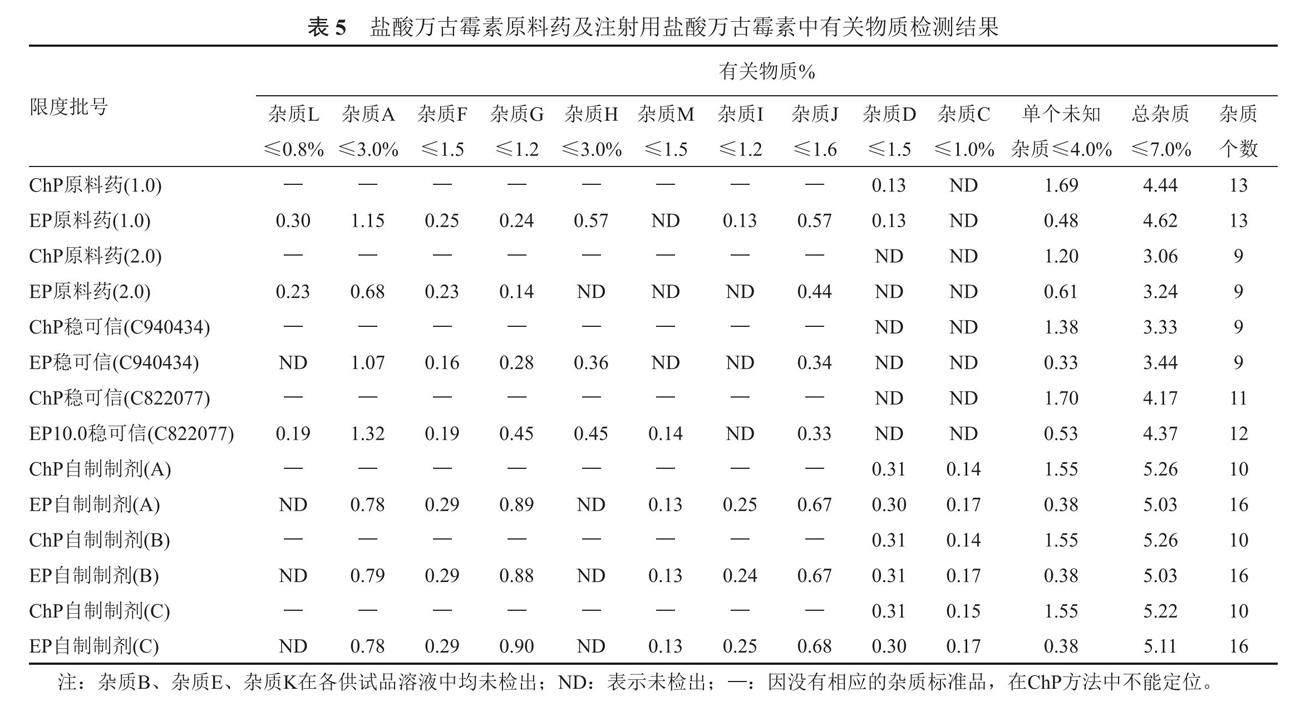
采用ChP2020及EP10.0有关物质检查方法对盐酸万古霉素原料药、自制制剂及部分上市制剂进行检测,结果见表4,为全方位比较原料药及其制剂中的有关物质情况,本研究采用有效期内上市制剂稳可信(批号:C940434)、近效期上市制剂稳可信(批号:C822077)、冷藏储存原料药(批号:1.0、2.0),以及在40 ℃±2 ℃/75%RH±5%RH条件下放置6个月的自制制剂(A、B、C)。
对样品有关物质测定结果进行比较,EP10.0方法测得的杂质个数大于或等于ChP2020,两种方法测定的七批样品杂质总量平均值见表5,可见两种方法测得的结果相当。
3 讨论
3.1 系统适用性不同
ChP2020系统适用性要求两个主峰间分离度大于5.0,并不能对已知杂质进行定位,也未对分离度作更具体的要求。而EP10.0系统适用性规定杂质G与杂质H的分离度在1.5~4.0之间,杂质B与杂质L之间分离度在1.5~5.0之间。
3.2 分离效能不同
系统适用性实验中,EP10.0方法可以有效分离各特定已知杂质,根据破坏试验杂质来源推测杂质A(稳可信中最大单个杂质)及杂质F为工艺来源,杂质G(自制产品中最大单个杂质)、杂质J及杂质D为降解产物。ChP2020有关物质测定方法可以有效分离降解杂质杂质C和杂质D,但不能很好的分离6~10 min处的杂质,色谱峰相连或合并,对其余降解杂质、工艺杂质亦不能有效分离,由此说明EP10.0方法的分离效能优于ChP2020。
3.3 杂质控制策略不同
ChP2020标准仅对单个杂质和总杂质进行控制,而EP10.0标准对特定杂质,主峰前后未知杂质和总杂质均进行了严格控制,更有利于盐酸万古霉素的质量控制。
3.4 样品有关物质测定结果不同
2批原料药,5批制剂检测结果均显示EP10.0方法检测得到的杂质个数大于或等于ChP2020,ChP2020方法检测到最大单杂为1.20%~1.70%,均大于相应批次的EP10.0方法,提示ChP方法最大单杂为多个未知杂质共洗脱,但两种方法测定的总杂质含量相当,差值均小于0.20%,说明两种方法在总杂测定方面等效。同时两种方法检测两批原料药以及稳可信(批号:C940434)杂质个数相同,但EP方法检测的近效期稳可信以及加速放置六个月的自研三批制剂杂质个数均多于ChP2020方法,提示成品放置时间越长,放置条件越剧烈(温度越高,湿度越大),EP检测方法可检测到的杂质个数越多。
4 结语
目前,对盐酸万古霉素有关物质研究报道的文献并不是很多[6-8],更缺少对各国药典方法对比的相关文献。本文采用ChP2020和EP10.0收载的注射用盐酸万古霉素和盐酸万古霉素有关物质分析方法,分别对系统适用性、专属性、强制降解试验和样品进行有关物质检测,对色谱行为、已知杂质、有关物质测定结果和杂质控制策略等进行比较。ChP2020和EP10.0色谱条件中仪器、色谱柱、流动相组成、梯度洗脱程序、流速、柱温和进样量均不相同,且系统适用性要求存在较大差异。ChP2020系统中6~10min杂质出现共洗脱,而EP10.0系统中各特定杂质均能达到有效分离,分离效能优于ChP2020。强制降解试验表明ChP2020和EP10.0方法对降解杂质C和杂质D分离效能无明显差异。两种药典方法杂质控制策略不同,EP10.0在控制单杂和总杂的基础上,增加了对特定杂质的控制,EP10.0系统测得样品中的杂质数量大于或等于ChP2020,测得的总杂含量无明显差异。但EP10.0方法使用的超高效液相和色谱柱在成本上高于ChP2020方法。
综上研究结果,为更好的控制注射用盐酸万古霉素有关物质,建议采用EP10.0进行有关物质检测。
参 考 文 献
Kauf T L, Mckinnon P, Corey G R, et al. An open-label, pragmatic, randomized controlled clinical trial to evaluate the comparative effectiveness of daptomycin versus vancomycin for the treatment of complicated skin and skin structure infection[J]. BMC Infectious Diseases, 2015, 15(1): 503-512.
国家药典委员会. 中华人民共和国药典(二部)[S]. 北京: 中国医药科技出版社, 2020: 1048-1050.
JP Vancomycin Hydrochloride [S]. 17th, 2017: 1758-1759.
USP Vancomycin Hydrochloride [S]. 43th. 2021: 4586-4589.
EP Vancomycin Hydrochloride [S]. 10.0th. 2019: 4168-4171.
王晨, 王立新, 张斗胜, 等. 国产注射用盐酸万古霉素的质量评价[J]. 中国抗生素杂志, 2018, 43(3): 262-268.
王丽荣, 王俊秋, 周立春. 注射用盐酸万古霉素有关物质检查方法的改进[J]. 中国药品标准, 2011, 12(6): 445-447.
于童, 赵荣生, 周勇, 等. 注射用盐酸万古霉素制剂的质量评价研究[J]. 中国药学杂志, 2009, 44(21): 1662-1665.
