拟南芥CARK5激酶响应脱落酸信号的研究
2023-04-29李柯萱李小意王若琳杨毅
李柯萱 李小意 王若琳 杨毅

为了研究拟南芥脱落酸(Abscisic acid,ABA)受体的翻译后修饰,本研究以能够磷酸化ABA受体的激酶CARK5作为研究对象,通过构建了转基因株系来检测CARK5在ABA信号途径中的功能.结果显示: CARK5能够促进ABA介导的抑制种子萌发、幼苗的形态建成以及主根的生长,但是过表达激酶失活型CARK5m(CARK5N250A)则跟突变体cark5表型类似.拟南芥中过表达CARK5增强植株抗旱性;ABA处理后,ABA响应标记基因RAB18表达量增加.这些结果说明,CARK5通过可以磷酸化ABA受体,正调控ABA信号通路.
CARK5; 磷酸化; 脱落酸; 干旱胁迫
Q495A2023.036001
收稿日期: 2022-05-26
基金项目: 四川省国家自然科学基金(2022NSFSC0162)
作者简介: 李柯萱(1997-), 女, 四川自贡人, 硕士研究生, 研究方向为植物遗传学. E-mail: likexuan1312@163.com
通讯作者: 杨毅. E-mail: yangyi528@scu.edu.cn
Response of CARK5 kinase to ABA signaling in Arabidopsis
LI Ke-Xuan, LI Xiao-Yi, WANG Ruo-Lin, YANG Yi
(Key Laboratory of Bio-Resources and Eco-Environment of Ministry of Education, College of Life Sciences, Sichuan University, Chengdu 610065, China)
In order to explore the post-translational modification of Arabidopsis abscisic acid (ABA) receptor, this study constructed overexpressing CARK5 and kinase-dead CARK5m (CARK5N250A) in the wild type and T-DNA mutant cark5 plants by genetic and physiological assays, to analyze the functions of CARK5 in ABA signaling. The results showed that CARK5 can promote ABA-mediated inhibition of seed germination, seedling cotyledon and primary root elongation, but the overexpression kinase-inactive CARK5m (CARK5N250A) has a similar phenotype to the mutant cark5. In addition, overexpressing CARK5 enhanced plant drought resistance and ABA-marked gene RAB18 expression. Taken together, these data suggest that CARK5 positively regulates the ABA signaling pathway by phosphorylation of ABA receptors.
CARK5; Phosphorylation; Abscisic acid; Drought stress
1 引 言
植物能够通过捕捉环境信号,然后激活植物激素介导的多种内源途径,进而影响植物从种子成熟、种子萌发到开花结果以及响应生物或者非生物胁迫等各种生命活动[1,2].其中脱落酸(Abscisicacid,ABA)是一种由类胡萝卜素裂解而成的重要植物激素[3],在植物中具有多种生理功能.ABA通过调控种子的休眠和萌发以及气孔的开度等生理活动,来应对干旱、高温、高盐等环境胁迫[4].拟南芥响应ABA信号通路的过程是:首先ABA受体PYR1/PYLs/RCARs(Regulatory Components of ABA Receptors/Pyrabactin Resistance/PYR like)感知ABA后,能够抑制磷酸酶PP2C活性,激活激酶SnRK2s,使其磷酸化ABA信号通路的下游信号分子,最终响应ABA信号.ABA受体作为ABA信号通路中的核心成员[5-7],在拟南芥中总共有14个成员[8].在14个成员中除了PYL13以外,其余13个都被证实能够结合ABA.
自从ABA受体被发现以来,研究者也一直在研究其翻译后修饰,其中ABA受体的磷酸化修饰在ABA信号转导中具有重要作用[9].本实验室前期研究筛选出能够结合并使部分RCARs磷酸化的ABA受体激酶(Cytosolic ABA Receptor Kinase,CARK),该家族一共有11个成员,它们的激活环中都具有保守的天冬氨酰(N).其中CARK1属于拟南芥丝氨酸/苏氨酸蛋白激酶RLCKⅧ亚家族,研究发现CARK1能够通过结合并磷酸化RCAR3和RCAR11-14从而抑制PP2C活性,促进ABA信号通路[10,11].除此之外,CARK3以ABA依赖的方式转录干扰果胶甲酯酶抑制物(PMEL)的转录,进而调节拟南芥的花粉育性[12].最近的研究也表明,CARK2、CARK4、CARK5、CARK7和CARK11磷酸化二聚化受体后,从而解聚,增强ABA结合能力[13].由于CARKs在植物的生长发育以及抗逆性中的作用既存在冗余又可能有差异,所以有必要对每个成员在ABA信号途径中的功能进行分析.因此,本研究选取能够与RCARs相互作用的CARK5进行分析,探究其响应ABA信号的表型和ABA下游基因的转录水平.
2 材料与方法
2.1 材 料
T-DNA插入突变的拟南芥种子cark5(SALK_136404)购买自网站拟南芥生物资源中心ABRC(http://www.arabidopsis.org/).野生型拟南芥(Arabidopsis thalian)为哥伦比亚野生型(Col-0).拟南芥先播种在MS固体培养基(MS粉末加上2%蔗糖和0.8%的琼脂粉)上培养5~7 d,等到开始长出真叶时再移栽到配置的营养土(蛭石∶营养土=1∶3混匀,并进行121 ℃高压灭菌20 min后冷却至室温).
2.2 实验方法
2.2.1 拟南芥过表达和回补株系构建 将目的基因构建到pBI121载体中,回补株系用pZH01载体.构建成功的载体转化至大肠杆菌DH5α,进行菌落PCR和测序检测,确定构建成功后将DH5α进行扩大培养并提取质粒转入农杆菌GV3101中.采用花絮侵染法[14]得到带有卡那抗性(回补株系为利福平抗性)的T0代种子,再利用含抗性的MS平板进行筛选出能够长出真叶的阳性株系,然后在土壤中培养传代,利用孟德尔遗传定律检验得到T2代株系.T2代种子再播种于相应抗性的MS平板上,验证纯合株系.T3代种子用于表现分析.
2.2.2 实时荧光定量PCR(qRT-PCR) 将待测组织用液氮速冻后研磨,每50~100 mg组织用1 mL Trizol试剂对组织进行裂解,加入氯仿后在冰上沉淀10 min,使核蛋白复合物解离,再用异丙醇沉淀回收总 RNA.得到的总RNA后根据Takara反转录试剂盒说明书将RNA反转成cDNA,最后根据Takara荧光定量PCR酶使用说明书配制qRT-PCR反应体系,体系及程序如表1所示,同时保证每个样本技术重复三次,生物学重复三次.
2.2.3 ABA处理下种子萌发率统计 将每个株系约100颗种子春化3 d后消毒播种于含终浓度分别为0、0.3、1.0、3.0和10.0 μmol/L ABA的MS培养基中,置于温室中培养,持续1 w,每天数萌发率.萌发率=萌发的种子数/种子的总数.
2.2.4 ABA处理下幼苗形态建成实验分析 每个株系播种约50颗种子于终浓度为0和0.3 μmol/L ABA的MS平板上,7 d后观察它们子叶变绿情况,计算子叶变绿的比率.
2.2.5 ABA处理下根长实验分析 每个株系拟南芥种子播种于MS平板,竖置生长2~3 d后选择长度长势相似的植株移植到1/2MS平板中,且加入30 μmol/L ABA.观察它们主根伸长情况,7~8 d后拍照用imageJ软件测量主根长度.
2.2.6 幼苗干旱及复水处理 将拟南芥种子春化后直接播种到土里,每个株系至少3盆,每两天浇一次水,保证植物正常生长,生长两周后,停止浇水,干旱13 d后拍照记录,再进行复水处理,连续浇水直到土壤吸水饱和,两天后观察植株存活率.
3 结 果
3.1 qRT-PCR鉴定CARK5转基因株系
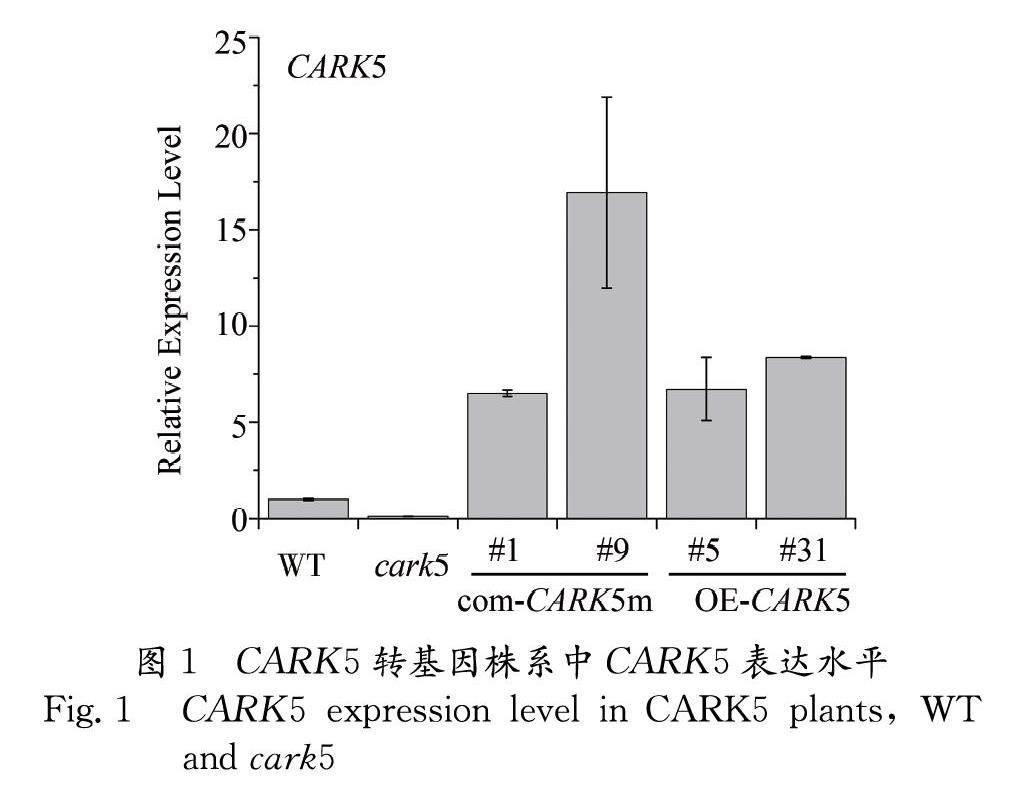
前期已经从购买的种子中鉴定出cark5突变株系,然后构建并筛选出了CARK5过表达株系OE-CARK5 #5和OE-CARK5 #31,并进行了qRT-PCR实验进行验证.qRT-PCR结果显示cark5突变株系的CARK5基因表达水平几乎未检测到,说明该突变体为敲除突变体,用于后续分析;两种过表达株系的CARK5表达量相比野生型都增加5倍以上(图 1).另外为了更好地验证CARK5基因的功能,本实验还构建了cark5突变株的背景下回补CARK5激酶位点突变的株系com-CARK5m #1和com-CARK5m #9,如qRT-PCR结果所示,CARK5 mRNA转录水平相对于野生型也有显著提高(图 1).
3.2 ABA对CARK5转基因株系种子萌发和幼苗形态建成的影响
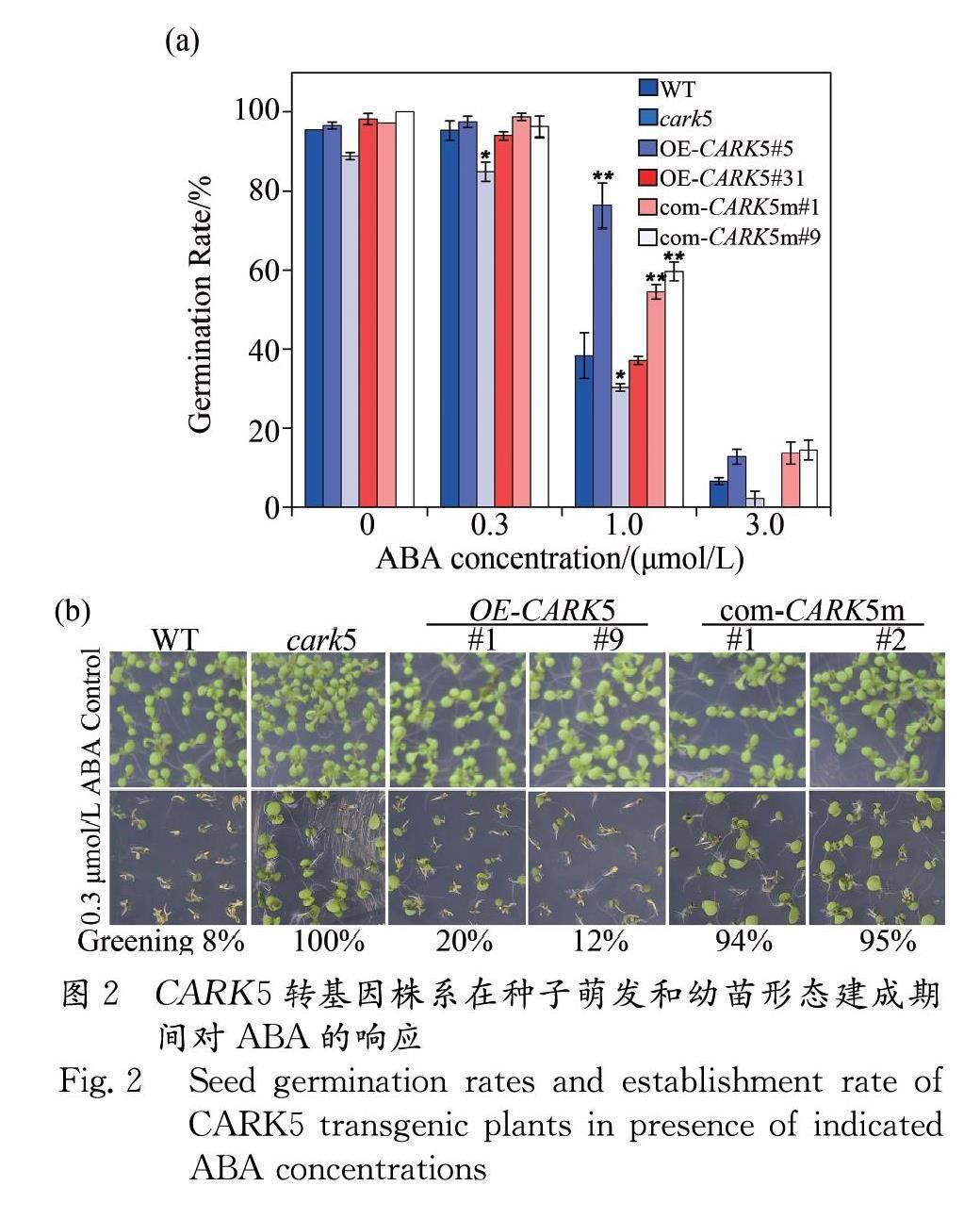
因为已有的研究表明CARK5能够与ABA受体相互作用,所以本研究想探讨它在拟南芥中是否调控ABA介导的种子萌发和幼苗形态建成等生物学功能.首先进行了种子萌发实验,结果显示:不添加外源ABA的情况下,以及0.3 μmol/L低浓度ABA处理时,CARK5转基因株系种子的萌发率都没有明显区别; 1.0 μmol/L ABA时,WT、cark5、OE-CARK5 #5、OE-CARK5 #31、com-CARK5m #1和com-CARK5m #9的萌发率分别为:40%、75%、35%、40%、54%和60%;当ABA浓度升高到3 μmol/L时,OE-CARK5 #5和OE-CARK5 #31种子几乎不萌发,而cark5、com-CARK5m #1和com-CARK5m #9没有显著差异.因此,拟南芥中CARK5缺失之后,与野生型相比,对ABA的敏感程度降低,而过表达CARK5会增加植株对ABA的敏感程度.并且回补CARK5激酶活性位点突变的CARK5m到cark5株系后,com-CARK5m #1和com-CARK5m #9株系萌发率显著高于野生型,而与cark5没有显著差异,都表现出对ABA不敏感(图2a).
虽然在0.3 μmol/L ABA处理下,CARK5转基因植株的种子萌发率没有明显区别(图2a),但是继续培养10天后, WT、cark5、OE-CARK5 #5、OE-CARK5 #31、com-CARK5m #1和com-CARK5m #9的子叶绿化率比率分别为:8%、100%、20%、12%、94%和95%.com-CARK5m与cark5相似且都表现为ABA的不敏感,幼苗子叶变绿程度极高.而过表达株系与野生型都表现出了ABA抑制子叶变绿(图2b).综上结果表明CARK5在ABA介导的抑制种子萌发和子叶变绿中起正调控作用.
3.3 CARK5在ABA处理下对根长伸长的影响
对CARK5转基因株系在ABA介导下根伸长情况进行实验分析.将MS培养基培养3 d的幼苗转移到不含ABA和含30 μmol/L ABA的1/2MS培养基中,继续培养7 d后,结果如图 3所示,在正常情况下,各株系的根长几乎一致;而ABA处理之后,WT、cark5、OE-CARK5 #5、OE-CARK5 #31、com-CARK5m #1和com-CARK5m #9跟对照组的比较,根长分别抑制了45.8%、55.1%、31.7%、29.1%、67.4%和47.1%.过表达株系较于野生型株系对ABA敏感,突变体的主根伸长对ABA处理较不敏感,而回补激酶失活型CARK5,不能回补到野生型的表型.这些结果说明CARK5同样依赖其激酶活性来影响ABA对根长的抑制作用.
3.4 CARK5转基因株系对干旱胁迫的响应
对2周大小的WT、cark5、OE- CARK5 #5、OE-CARK5 #31、com-CARK5m#1和com-CARK5m #9幼苗进行13 d的干旱处理,结果发现:干旱13 d的时候,WT、cark5和com-CARK5m #1和com-CARK5m #9就已经萎蔫了;相对而言,OE-CARK5 #5和OE-CARK5 #31脱水程度更低.复水2 d后发现,WT大部分幼苗恢复;而cark5、com-CARK5m #1和com-CARK5m #9的所有植株都因为脱水致死;而OE-CARK5的两个株系都全部恢复.如图所示(图4),所有株系在干旱处理前的长势是一致的,因此可以得出OE-CARK5最耐旱,从而可以推断CARK5在植物应对干旱胁迫中起正调控作用.
3.5 ABA处理CARK5转基因株系后调控下游基因的转录水平
CARK5与ABA受体能够相互作用,因此本研究检测了ABA信号通路中的标记基因RAB18来判断它是否会响应ABA信号通路.用50 μmol/L ABA处理10 d大小的WT、cark5、com-CARK5m #1、com-CARK5m #9、OE-CARK 5 #31.3 h后收样,提取RNA,然后做qRT-PCR,检测ABA信号响应标记基因RAB18的相对表达量.如结果所示(图5),ABA处理后RAB18的表达量相对于处理前都有显著升高,其中在OE-CARK5#31中的表达量最高,在WT中次之,在cark5、com-CARK5m #1和com-CARK5m #9株系中最低,并且处理后它们都与野生型存在显著性差异.因此,CARK5能促进ABA下游响应基因的表达,相反,CARK5m不能激活ABA信号通路.
4 讨 论
ABA受体的磷酸化是一种由不同的激酶引起的翻译后修饰.例如,TOR磷酸化ABA受体PYL4(RCAR10),终止ABA信号来平衡植物的生长和抗逆性[15].AEL酪蛋白激酶通过磷酸化136和182的丝氨酸来破坏ABA受体PYL1(RCAR12)的稳定性,进而抑制植物对ABA的响应,导致拟南芥应对干旱胁迫的能力减弱[16].而本实验室前期研究已经发现,CARK1磷酸化RCAR3、RCAR11抑制了PP2C活性,正向调节ABA信号,所以过表达CARK1能够显著提高拟南芥的抗旱性[11]. 已有研究表明CARKs偏好于与ABA受体亚家族III的成员相互作用,在ABA信号转导中起冗余作用.有趣的是,CARK1、CARK4和CARK5与RCAR3相互作用,而CARK2、CARK7和CARK11不能[13].这种差异可能是因为CARK基因是从共同的祖先基因复制而来的,并且在植物多样化的过程中发生功能分化[17]. 例如,蛋白激酶AEL磷酸化ABA受体,从而降低其稳定性,抑制ABA信号通路.说明不同的激酶与ABA受体存在相互作用,并且能够磷酸化ABA受体家族不同的基因以及不同的位点,发生不同的ABA响应.CARK5与ABA受体RCAR3、RCAR11、RCAR12、RCAR13和RCAR14有相互作用,并且能磷酸化RCAR11、RCAR12、RCAR13和RCAR14[13].但是CARK5在植物生长发育中具体表型还不明确,所以本研究在CARK5已有的分子研究基础上,构建CARK5相关转基因株系,进一步探讨CARK5对幼苗响应ABA在种子萌发和形态建成上的影响、成苗响应干旱的影响以及对下游基因表达的影响.
对CARK5的转基因株系的功能进行分析表明:CARK5能抑制种子的萌发、幼苗的形态建成以及主根的生长.磷酸激酶活性位点突变的com-CARK5m株系虽然mRNA的表达量仍然较高,但是却影响了CARK5的功能,再次说明CARK5通过磷酸化ABA受体来发挥作用,进而影响拟南芥生长发育.那么CARK5是如何与特定的ABA受体作用的呢?前面提到CARK5和CARK1一样都能够与RCAR3相互作用,已有研究表明CARK1磷酸化ABA受体后,改变了它们的结构,可能使它们更容易与ABA结合,特别是单体的状态的RCARs,例如RCAR3;同时也可能导致本来是同源二聚体态的RCARs成为单体,从而暴露了结合PP2Cs的loop[18],所以CARK5很可能与CARK1有同样的作用机制,是否存在差异还需要进一步研究.
为了研究CARK5在非生物胁迫中的功能,对CARK5相关转基因株系进行干旱处理,结果表明它们在调节干旱胁迫中起正调控的作用.并且过表达CARK5能够使ABA诱导表达的下游标记基因RAB18显著升高,说明CARK5磷酸化ABA受体后,提高RAB18转录水平,从而促进ABA信号通路,进而提高植物耐旱性.但CARK5是如何受ABA调控来影响ABA受体RCARs的磷酸化还需要继续研究.因此需要进一步研究ABA是否诱导了CARKs的表达,使RCARs被磷酸化的比例增加或者结构改变,从而促进ABA信号通路,或者是RCARs被磷酸化后,进一步引起ABA信号通路中其它蛋白结构的改变进而影响ABA响应,所以还需要进行更多实验来进行验证.CARK5在ABA信号途径中功能的分析,有助于理解植物抗逆机理.
参考文献:
[1] Yang C, Lin L. Hormonal regulation in shade avoidance[J]. Front Plant Sci, 2017, 8: 1527.
[2] Shu K, Liu X D, Xie Q, et al. Two faces of one seed: hormonal regulation of dormancy and germination [J]. Mol Plant, 2016, 9: 34.
[3] Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism[J]. Annu Rev Plant Biol, 2005, 56: 165.
[4] Kanchan V, Neha U, Nitin K, et al. Abscisic acid signaling and abiotic stress tolerance in plants: A review on current knowledge and future prospects [J]. Front Plant Sci, 2017, 8: 161.
[5] Park S Y, Fung P, Nishimura N, et al. Abscisic acid inhibits PP2Cs via the PYR/PYL family of ABA-binding START proteins[J]. Science, 2009, 324: 1068.
[6] Ma Y, Szostkiewicz I, Korte A, et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors [J]. Science, 2009, 324: 1064.
[7] Kim S, Kang J Y, Cho D I, et al. ABF2, an ABRE-binding bZIP factor, is an essential component of glucose signaling and its overexpression affects multiple stress tolerance [J]. Plant J, 2004, 40: 75.
[8] Yuan X, Yin P, Hao Q, et al. Single amino acid alteration between valine and isoleucine determines the distinct pyrabactin selectivity by PYL1 and PYL2[J]. J Biol Chem, 2010, 285: 28953.
[9] Zhou X, Yuan F, Bai Y, et al. SOS2-LIKE PROTEIN KINASE5, an SNF1-RELATED PROTEIN KINASE3-Type protein kinase, is important for abscisic acid responses in Arabidopsis through phosphorylation of ABSCISIC ACID-INSENSITIVE5[J]. Plant Physiol, 2015, 168: 659.
[10] Li X, Kong X, Huang Q, et al. CARK1 phosphorylates subfamily Ⅲ members of ABA receptors [J]. J Experim Botany, 2019, 70: 519.
[11] Zhang L, Li X, Li D, et al. CARK1 mediates ABA signaling by phosphorylation of ABA receptors[J]. Cell Disc, 2018, 4: 30.
[12] Wang H H, Qiu Y, Yu Q, et al. Close arrangement of CARK3 and PMEIL affects ABA-mediated pollen sterility in Arabidopsis thaliana[J]. Plant Cell Environ, 2020, 43: 2699.
[13] Li X, Xie Y, Zhang Q, et al. Monomerization of abscisic acid receptors through CARKs-mediated phosphorylation [J]. New Phytol, 2022.
[14] 董万春, 樊婷婷, 阳立波, 等. 拟南芥CDR6基因过表达载体构建及过量表达植株筛选鉴定[J]. 安徽农业科学, 2015, 43: 63.
[15] Wang P, Yang Z, Li Z, et al. Reciprocal regulation of the TOR kinase and ABA receptor balances plant growth and stress response[J]. Mol Cell, 2018, 69: 100.
[16] Chen H H, Qu L, Xu Z H, et al. EL1-like casein kinases suppress ABA signaling and responses by phosphorylating and destabilizing the ABA receptors PYR/PYLs in Arabidopsis [J]. Mol Plant, 2018, 11: 14.
[17] Nan Q, Qian D, Niu Y, et al. Plant Actin-Depolymerizing factors possess opposing biochemical properties arising from key amino acid changes throughout evolution [J]. Plant Cell, 2017, 29: 395.
[18] Zhang X, Zhang Q, Xin Q,et al. Complex structures of the abscisic acid receptor PYL3/RCAR13 reveal a unique regulatory mechanism [J]. Structure, 2012, 20: 780.
引用本文格式:
中 文: 李柯萱, 李小意, 王若琳, 等. 拟南芥CARK5激酶响应脱落酸信号的研究[J]. 四川大学学报: 自然科学版, 2023, 60: 036001.
英 文: Li K X, Li X Y, Wang R L, et al. Response of CARK5 kinase to ABA signaling in Arabidopsis [J]. J Sichuan Univ: Nat Sci Ed, 2023, 60: 036001.
