活性天然产物莪术烯的全合成
2023-04-29郭晶晶袁长春傅凯荀苗苗马文兵王志强李志春
郭晶晶 袁长春 傅凯 荀苗苗 马文兵 王志强 李志春
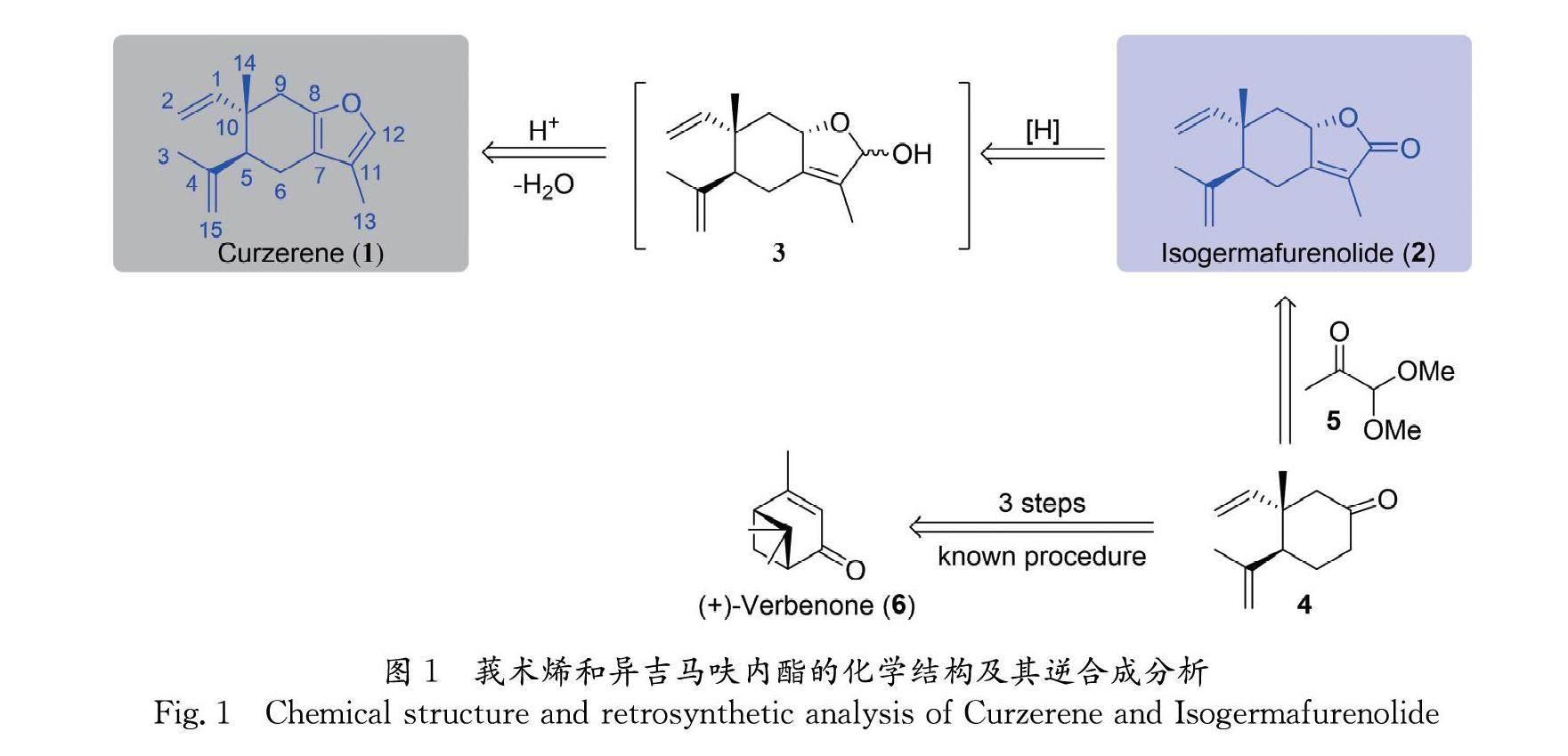

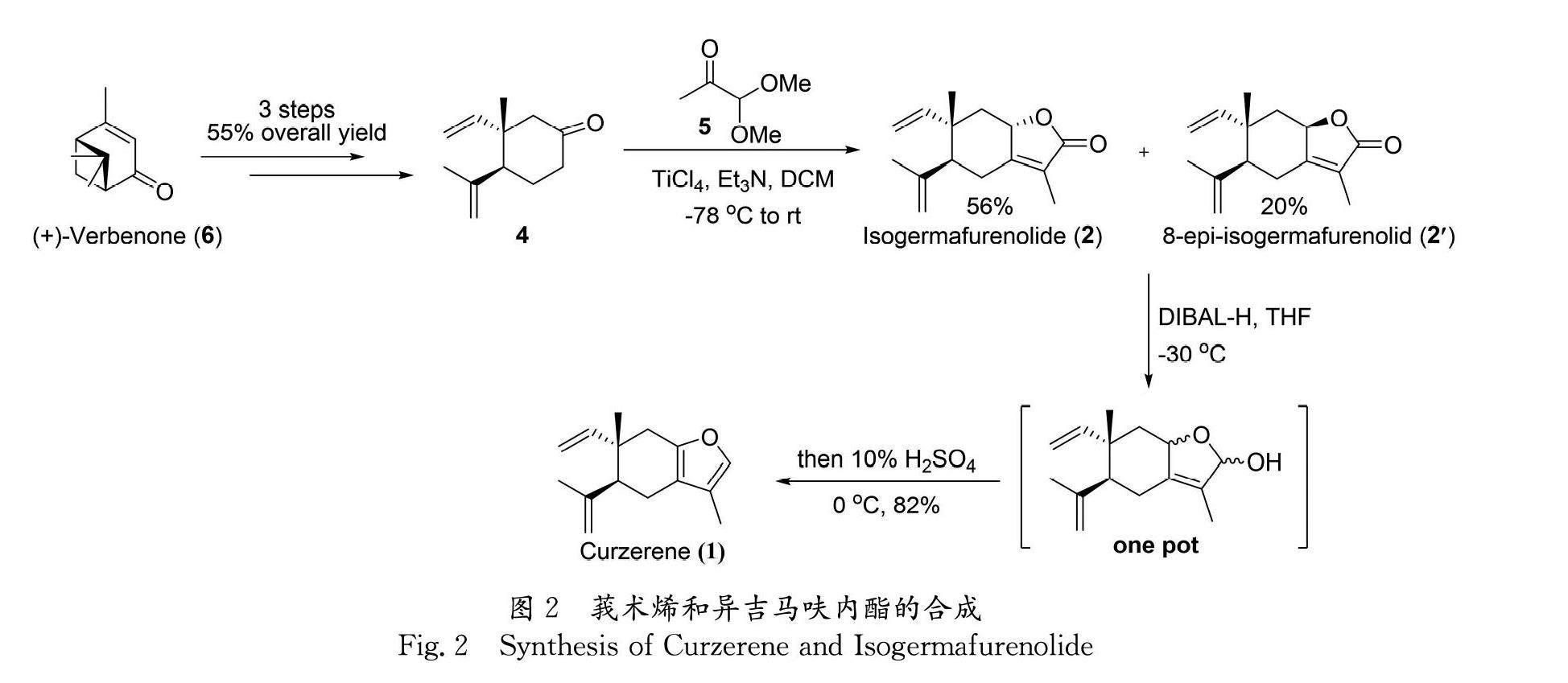
莪术烯(Curzerene)是从姜黄属植物的根茎中分离提取的萜烯呋喃类天然产物,具有抗炎、抗癌、抗利什曼病等多种生物活性. 本文以商业化试剂(+)-马鞭草烯酮(6)为手性原料,首先通过已知的3步反应得到关键酮化合物(4);4再与1,1-二甲氧基丙酮发生由TiCl4-Et3N介导的用于构建丁烯酸内酯的串联环化反应,分别以56%和20%的收率得到天然产物isogermafurenolid(2)及其异构体8-epi-isogermafurenolid(2′);最后,2与2′经DIBAL-H还原、酸促进脱水呋喃化一锅反应,以82%的收率合成了目标天然产物莪术烯. 该合成路线共5步, 总收率34%.
温莪术; 榄香烯型倍半萜; 莪术烯; 全合成
O629.9A2023.035001
收稿日期: 2022-11-11
基金项目: 山西省基础研究计划(20210302123016)
作者简介: 郭晶晶(1996-), 女, 山西太原人, 硕士研究生. E-mail:1158936974@qq.com
通讯作者: 袁长春. E-mail: ycc543700483@nuc.edu.cn
Total synthesis of bioactive natural product Curzerene
GUO Jing-Jing1,2, YUAN Chang-Chun1,2, FU Kai1,2,
XUN Miao-Miao1,2, MA Wen-Bing1, WANG Zhi-Qiang1, LI Zhi-Chun1
(1.School of Chemistry and Chemical Engineering, North University of China, Taiyuan 030051, China;
2. Dezhou Industrial Technology Research Institute, North University of China, Dezhou 253034, China)
Curzerene is a natural product of terpene furans isolated from the curcuma rhizomes, which has various biological activities such as anti-inflammation, anti-cancer and anti-leishmaniasis. In this paper, commercially available (+)-verbenone (6) was utilized as chiral starting material to synthesize Curzerene in 5 steps with 34% total yield. A key ketone compound 4 was first obtained through a known three-step reaction. Then ketone 4 and 1,1-dimethoxyacetone underwent TiCl4-Et3N-mediated cyclization reaction to afford natural products isogermafurenolid (2) and its isomer 8-epi-isogermafurenolid (2′) in 56% and 20% yield, respectively. Finally, the target Curzerene was synthesized from 2 and 2′ with 82% yield by a one-pot reaction of DIBAL-H reduction and subsequent acid promoted dehydration.
Curcuma wenyuji; γ-Elemene-type sesquiterpenes; Curzerene; Total synthesis
1 引 言
姜科姜黄属植物温莪术是我国的传统中药,中医以其根茎入药具有行气破瘀,通经止痛的效果[1-3]. 温莪术根茎中含有的大量挥发油成分,通常被称之为“莪术油”[4,5],现代医学研究表明,莪术油具有抗炎、抗肿瘤、调节免疫、抗菌等多种药效作用[6],其有机化学成分主要含有倍半萜醇和倍半萜烯类化合物[7],如:莪术醇、莪术双酮、榄香烯以及莪术烯等. 鉴于莪术油巨大的医学应用价值[8],其含有的有效活性单体也颇受关注. 例如莪术醇在治疗肝癌方面具有显著的疗效[9]. 更值得一提的是,β-榄香烯作为非细胞毒性抗癌药物,现已被列为国家级二类抗肿瘤新药,用于治疗肺癌和乳腺癌[10].
莪术烯(Curzerene,图1)作为莪术油中另一含量较高的有效活性单体[8, 11],在医学研究方面也倍受关注. 其一,莪术烯在炎症治疗方面展现了巨大的医学应用前景:2006年,孙秀燕等[12]发现莪术烯对TNF-α炎症因子的分泌具有显著的抑制效果;2008年,王珊等[13]发现莪术烯在一定的浓度下对小鼠体内NO的释放展现出了很好的抑制效果,同时对正常的细胞增殖没有产生显著的干扰. 其二,莪术烯在抗肿瘤方面表现出了良好的生物活性:2017年,王友娣等[11]通过研究发现,莪术烯可以下调肺癌中谷胱甘肽s-转移酶(GST) A1的表达,并显示出抑制肿瘤的特性,同时显示出低毒、对裸鼠的器官没有损伤;2022年,Cheng等[14]发现莪术烯可抑制U251和U87胶质瘤细胞中谷胱甘肽s-转移酶(GST)A4和mRNA的表达,同时显示出抑制肿瘤的活性. 其三,2021年巴西学者[15]报道了莪术烯在抗利什曼病方面的体外研究,结果表明莪术烯可以有效的抑制利什曼病原虫的繁殖生长. 其四,也最为有趣的是,印度学者[16]为了在天然产物中寻求治疗新型冠状病毒肺炎(COVID-19)的药物,通过使用Auto Dock Vina软件对选取的天然产物分子与SARS-CoV-2刺突蛋白(PDB ID 7DDD)进行了分子对接分析,发现莪术烯展现了不错的对接分数. 这对后续治疗新型冠状病毒肺炎的药物发现具有一定的意义.
莪术烯(图1化合物1)属于榄香烯型倍半萜天然产物,分子结构中有两个手性中心,其中10号位为季碳手性中心. 对其展开全合成有一定的难度,截止目前有两个研究小组报道过它的合成. 1988年,Bohlmann小组[17]从哈格曼乙酯(Hagemanns ester)出发,经过长达十多步的转化首次报道了莪术烯消旋体的合成. 2019年,Barrero小组[18]从吉马酮(Germacrone)出发,利用钯配合物介导的Cope重排反应以及I2/DMSO介导的α-异丙烯基酮呋喃化反应,两步高效地实现了莪术烯的合成,但同样是完成了其消旋体的合成. 本研究小组对榄香烯型萜类天然产物的全合成具有浓厚的兴趣,目前已完成了多例该类型天然产物的合成工作[19]. 本研究论文在以往研究的基础上实现了莪术烯的手性合成.
异吉马呋内酯(Isogermafurenolide,图1化合物2)为γ-丁烯酸内酯类天然产物,同样也是从姜黄属植物温郁金的根茎中分离提取的天然产物[20,21]. 生物活性评价研究表明该化合物亦具有抗炎、抗肿瘤、神经防护等多种生物活性[22,23]. 从逆合成角度分析(图1),异吉马呋内酯经过还原能够得到半缩醛化合物3,然后3经过脱水芳香化过程,即可生成莪术烯. 而异吉马呋内酯则可通过化合物4与1,1-二甲氧基丙酮(化合物5)经TiCl4-Et3N介导的构建丁烯酸内酯化反应实现[24]. 酮化合物4为已知化合物,可由(+)-马鞭草烯酮经3步已知反应获得[19]. 莪术烯及异吉马呋内酯具体的合成路线见图2.
2 实验部分
2.1 仪器与试剂
瑞士Bruker公司Advance Ⅲ HD 600 MHz型核磁共振波谱仪(CDCl3或C6D6为溶剂,TMS为内标;溶剂各残余峰为CDCl3∶1H NMR = 7.26, 13C NMR = 77.16; C6D6∶1H NMR = 7.16);美国Thermo Fisher Exactive Plus型高分辨质谱仪.
(+)-马鞭草烯酮购自百灵威科技有限公司;四氯化钛、三乙胺、DIBAL-H、1,1-二甲氧基丙酮均购自萨恩化学技术(上海)有限公司;四氢呋喃、二氯甲烷均为分析纯, 使用前四氢呋喃加入金属钠重蒸处理,二氯甲烷加入氢化钙重蒸处理.
2.2 合 成
2.2.1 化合物4的合成 化合物4可通过已知的3步反应制备[19],总收率55%.
2.2.2 Isogermafurenolide (2)和8-epi-isogermafurenolid (2′)的合成与结构表征 将4(178.28 mg,1.0 mmol)溶于10 mL干燥的二氯甲烷中,-78 ℃下向该溶液中加入四氯化钛(284.5 mg, 0.16 mL,1.5 mmol),10 min 后加入干燥的三乙胺(202.4 mg, 0.28 mL,2.0 mmol ). -78 ℃下搅拌30 min,加入1,1-二甲氧基丙酮(5,236.3 mg, 0.24 mL,2.0 mmol)后将反应液自然升温至室温;反应24 h(TLC跟踪),加入50 mL蒸馏水淬灭反应,加入30 mL乙酸乙酯稀释,分相,水相用乙酸乙酯萃取3次(每次30 mL),有机相用无水Na2SO4干燥抽滤后,在旋转蒸发仪上减压浓缩后,经硅胶层析柱[ 洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=10∶1]纯化后,得白色固体Isogermafurenolide (2)共130.1 mg,收率56%;淡黄色油状液体8-epi-isogermafurenolid (2′)共46.5 mg,收率20%.
Isogermafurenolide (2): [α]D20 +19 (c 1.0, MeOH); 1H NMR (400 MHz, CDCl3) δ 5.73 (dd, J = 17.4, 10.8 Hz, 1H), 5.00 (brd, J = 10.4 Hz, 1H), 4.99 (brs, 1H), 4.97 (brd, J = 17.6 Hz, 1H), 4.83 (dd, J = 11.6, 6.0 Hz, 1H), 4.73 (s, 1H), 2.67 (dd, J = 14.4, 4.4 Hz, 1H), 2.55 (t, J = 13.6 Hz, 1H), 2.20 (dd, J = 12.4, 6.0 Hz, 1H), 2.04 (dd, J = 12.8, 4.0 Hz, 1H), 1.82 (t, J = 1.6 Hz, 3H), 1.76 (s, 3H), 1.17 (s, 3H); 1H NMR (400 MHz, C6D6) δ 5.38 (dd, J = 17.6, 10.8 Hz, 1H), 4.84 (t, J = 1.6 Hz, 1H), 4.78 (dd, J = 10.8, 0.8 Hz, 1H), 4.70 (dd, J = 17.6, 0.8 Hz, 1H), 4.48 (s, 1H), 4.19 (dd, J = 11.6, 6.0 Hz, 1H), 2.10 (dd, J = 14.4, 4.0 Hz, 1H), 1.82 – 1.72 (m, 2H), 1.62 (t, J = 1.6 Hz, 3H), 1.54 (dd, J = 13.6, 4.0 Hz, 1H), 1.50 (s, 3H), 0.66 (s, 3H); 13C NMR (100 MHz, CDCl3) δ 174.9, 162.1, 146.7, 145.0, 120.2, 114.0, 112.0, 78.0, 53.1, 45.9, 40.9, 28.5, 24.9, 17.1, 8.4; HRMS (ESI): m/z 计算值 C15H20O2 {[M+H]+}, 233.1536, 实测值233.1535.
8-epi-isogermafurenolid (2′): [α]D20 -25 (c 1.0, MeOH); 1H NMR (600 MHz, CDCl3) δ 5.89 (dd, J = 17.4, 11.8 Hz, 1H), 5.30 (s, 1H), 5.22 (d, J = 18.0 Hz, 1H), 5.18 (d, J=10.8 Hz, 1H), 4.86 (dd, J = 12.0, 6.6 Hz, 1H), 4.82 (s, 1H), 4.68 (s, 1H), 2.73~2.62 (m, 2H), 2.59 (d, J = 7.0 Hz, 1H), 2.31 (dd, J = 13.2, 6.6 Hz, 1H), 1.81 (s, 3H), 1.72 (s, 3H), 1.00 (s, 3H); 13C NMR (100 MHz, CDCl3) δ 174.9, 162.1, 147.3, 146.5, 120.9, 114.1, 113.3, 78.3, 49.6, 40.9, 39.4, 28.8, 28.1, 25.5, 8.4; HRMS (ESI): m/z 计算值 C15H20O2 {[M+H]+}, 233.1536, 实测值233.1536.
2.2.3 莪术烯(1)的合成与结构表征 将2与2′的混合物(比例为2.8∶1, 185.6 mg,0.8 mmol)溶于8.0 mL干燥的四氢呋喃中,-30 ℃下向反应液中缓慢加入1.36 mL二异丁基氢化铝(1.0 mmol/L in toluene).滴加结束后将反应液缓慢升至-10 ℃,再加入5.6 mL四氢呋喃与5.4 mL 10%硫酸的混合溶液,然后将反应液置于0 ℃下搅拌30 min,接着加入30 mL蒸馏水,最后加入30 mL乙酸乙酯分相. 水相用乙酸乙酯萃取3次(30 mL × 3),有机相用无水Na2SO4干燥抽滤后,在旋转蒸发仪上减压浓缩后经硅胶层析柱[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)= 20∶1]纯化后得无色油状1共141.6 mg,收率82%.
莪术烯 (1): [α]D20 -8.7 (c 0.5,CHCl3); 1H NMR (400 MHz, CDCl3) δ 7.06 (bs, 1H), 5.88 (dd, J = 17.2, 10.8 Hz, 1H), 5.00 (dd, J = 12.4, 0.8 Hz, 1H), 4.97 (dd, J = 5.2, 0.8 Hz, 1H), 4.87 (t, J = 1.2 Hz, 1H), 4.76 (bs, 1H), 2.68 (bd, J = 16.4 Hz, 1H), 2.42 (m, 2H), 2.36 (d, J = 16.0 Hz, 1H), 2.30 (t, J = 7.2 Hz, 1H), 1.92 (d, J = 1.2 Hz, 3H), 1.75 (s, 3H), 1.07 (s, 3H); 13C NMR (100 MHz,CDCl3): δ 149.7, 147.4, 147.3, 137.3, 119.5, 116.6, 112.9, 111.1, 50.1, 40.3, 36.3, 24.6, 24.3, 19.6, 8.3;HRMS (ESI): m/z 计算值 C15H20O {[M+H]+}, 217.1587, 实测值217.1590.
3 结果与讨论
莪术烯和异吉马呋内酯的全合成路线如图2所示. (+)-马鞭草烯酮作为廉价易得的手性化合物,在天然产物全合成中常作为理想的起始原料. (+)-马鞭草烯酮经过与乙烯基格氏试剂的Michael加成反应、酸性条件下四元环的定向开环反应和K2CO3/MeOH条件下的乙酰基脱保护反应这三步已知反应[19],能以55%的收率得到已知酮化合物4.
酮化合物4在TiCl4-Et3N体系的介导下(图3)[24],首先与1,1-二甲氧基丙酮经由中间态7发生交叉aldol反应得到中间体8,接着发生分子内的环化反应得到中间态9,然后脱除TiCl3OH可得到中间态10,最后经水解可得到目标化合物2(isogermafurenolide)及其差向异构体2′(8-epi-isogermafurenolid). 其中化合物2为热力学稳定主产物,收率为56%; 2′为副产物, 收率为20%. 化合物2经1H NMR、13C NMR、HRMS和旋光度的表征与提取分离报道一致[17, 20, 21],确认完成了异吉马呋内酯(2)的全合成工作.
2与2′的混合物(比例为2.8∶1)首先用DIBAL-H将其还原成半缩醛中间体,然后用酸后处理使其脱水芳香化,最后可一锅以82%的收率实现目标分子莪术烯(1)的全合成. 其结构通过1H NMR和13C NMR进行了表征(图4和图5),此外还通过HRMS表征了其结构,以上表征结果均与提取分离报道一致[17,18].
4 结 论
本文以商品化的天然手性源(+)-马鞭草烯酮为初始原料,经过与乙烯基格氏试剂Michael加成反应、酸性条件下四元环定向开环反应和K2CO3/MeOH脱乙酰基保护反应,首先得到已知化合物4;4接着与1,1-二甲氧基丙酮(5)发生由TiCl4-Et3N介导的γ-丁烯酸内酯化反应,分别得到化合物2及其差向异构体2′;最后2与2′经DIBAL-H还原反应、酸催化脱水芳香化反应生成目标产物莪术烯(1). 综上,本文以5步34%的总收率实现了莪术烯的手性全合成,其结构经1H NMR、13C NMR和HRMS表征与报道一致.
参考文献:
[1] 周改莲, 黄盼, 谢雪婷, 等. 广西莪术关键采收月份挥发性成分的差异及动态变化研究[J]. 广西植物, 2022, 42: 772.
[2] 陈琴, 刘庆亚, 陈次琼, 等. 郁金茎叶提取物抑杀植物病原真菌活性研究与GC/MS分析[J]. 四川大学学报: 自然科学版, 2017, 54: 209.
[3] 李慧芬, 尉研, 龙章富, 等. 郁金正己烷萃取物的抑杀真菌活性与成分分析[J]. 四川大学学报:自然科学版, 2011, 48: 191.
[4] 周欣, 梁光义, 沈万雁, 等. 不同产地莪术挥发油的研究[J]. 华西药学杂志, 2002, 17: 201.
[5] 李爱群, 胡学军, 邓远辉, 等. 温莪术挥发油的成分[J]. 中草药, 2001, 32: 782.
[6] 曾建红, 黄凤香, 廖迎. 莪术油的含量测定和抗肿瘤作用的新进展[J]. 肿瘤药学, 2012, 2: 19.
[7] Chen Y, Zhu Z P, Chen J, et al. Terpenoids from curcumae rhizoma: their anticancer effects and clinical uses on combination and versus drug therapies [J]. Biomed Pharmacother, 2021, 138, 113850.
[8] 周冲, 刘慧俊, 崔友, 等. 莪术油中莪术烯的分离及结构鉴定[J]. 烟台大学学报:自然科学与工程版, 2010, 23: 294.
[9] Mao Y, Zhang J, Hou L, et al. The effect of beta-elemene on alpha-tubulin polymerization in human hepatoma HepG2 cells [J]. Chin J Cancer Res, 2013, 25: 770.
[10] Zhang X, Zhang Y, Li Y. β-Elemene decreases cell invasion by upregulating E-cadherin expression in MCF-7 human breast cancer cells [J]. Oncol Rep, 2013, 30: 745.
[11] Wang Y D, Li J H, Guo J Q, et al. Cytotoxic and antitumor effects of curzerene from curcuma longa [J]. Planta Med, 2017, 83: 23.
[12] 孙秀燕, 郑艳萍, 刘志峰, 等. 温莪术环状含氧倍半萜类化学成分的研究[J]. 分析测试学报, 2006, 25: 27.
[13] 王珊, 郑艳萍, 孙秀燕, 等. 温莪术油对脂多糖活化巨噬细胞释放一氧化氮的抑制作用[J]. 烟台大学学报:自然科学与工程版, 2008, 21: 71.
[14] Cheng B, Hong X L, Wang L F, et al. Curzerene suppresses progression of human glioblastoma through inhibition of glutathione S-transferase A4 [J]. CNS Neurosci Ther, 2022, 28: 690.
[15] Nunes T, Santos M, Oliveira M,et al. Curzerene antileishmania activity: effects on Leishmania amazonensis and possible action mechanisms [J]. Int Immunopharmaco, 2021, 100, 108130.
[16] Shanmugavelan R, Musthafa M. Pharmacokinetics and molecular docking study of siddha polyherbal preparation shailam against COVID-19 mutated s gene [J]. Trop J Nat Prod Res, 2022, 6: 502.
[17] Friedrich D,Bohlmann F. Total synthesis of various elcmanolide [J]. Tetrahedron, 1988, 44: 1369.
[18] Salihila J, Silva L, Pulgar H, et al. One-step synthesis of furan rings from α isopropylidene ketones mediated by iodine/DMSO: an approach to potent bioactive terpenes [J]. J Org Chem, 2019, 84: 6886.
[19] Yuan C C, Zhong S Y, Li X Y, et al. Total synthesis, structural revision and biological evaluation of γ-elemene-type sesquiterpenes [J]. Org Biomol Chem, 2018, 160: 7843.
[20] Kuck K, Jürgenliemk G, Lipowicz B, et al. Sesquiterpenes from myrrh and their ICAM-1 inhibitory activity in vitro [J]. Molecules, 2021, 26: 42.
[21] Tesso H, Knig W A, Son P, et al. Composition of the essential oil of flowers of Chloranthus spicatus (Thunb.) makino [J]. Flavour Fragr J, 2006, 21: 592.
[22] Ren C, Lin Y L, Liu X Q, et al. Target separation and antitumor metastasis activity of sesquiterpene-based lysine-specific demethylase 1 inhibitors from zedoary turmeric oil [J]. Bioorg Chem, 2021, 108: 104666.
[23] Xu J, Zhu H L, Zhang J, et al. Sesquiterpenoids from Chloranthus anhuiensis with neuroprotective effects in PC12 cells [J]. J Nat Prod, 2018, 81: 1391.
[24] Tanabe Y, Mitarai K, Higashi T, et al. Efficient one-step synthesis of trialkylsubstituted 2(5H)-furanones utilizing direct Ti-crossed aldol condensation and its application to the straightforward synthesis of (R)-mintlactone and (R)-menthofuran [J]. Chem Commun, 2002, 0: 2542.
引用本文格式:
中 文: 郭晶晶, 袁长春, 傅凯, 等. 活性天然产物莪术烯的全合成[J]. 四川大学学报: 自然科学版, 2023, 60: 035001.
英 文: Guo J J, Yuan C C, Fu K, et al. Total synthesis of bioactive natural product Curzerene [J]. J Sichuan Univ: Nat Sci Ed, 2023, 60: 035001.
