赶黄草多酚改善胰岛素抵抗的机制研究
2023-04-29郑浩睿王韬宇薛海瑞唐琳
郑浩睿 王韬宇 薛海瑞 唐琳
摘要:为探究四川省道地药材赶黄草改善胰岛素抵抗的作用及其机制,以赶黄草茎乙酸乙酯相(PSE)作为研究材料,建立了3T3-L1脂肪细胞诱导分化模型.诱导脂肪细胞分化后,通过油红O、尼罗红染色和Western Blot等手段探究了脂肪细胞内脂滴积累以及脂肪酸合成关键酶和胰岛素抵抗相关蛋白的表达情况.结果表明诱导分化后的脂肪细胞内的脂滴含量比对照组前脂肪细胞有着显著地增加,赶黄草多酚治疗后可以明显抑制脂质积累.PSE可以激活PI3K-Akt/GSK-3β信号通路,上调p-ACC、CPT1a、PGC-1α和PPARα这些控制脂质分解和脂肪酸氧化的蛋白的表达,并下调CD36、FASn和SREBP1c调节脂质合成的蛋白.综上所述,PSE可以通过激活PI3K-Akt/GSK-3β信号通路改善胰岛素抵抗,同时,促进脂质分解,抑制脂肪合成.
关键词:赶黄草;糖尿病;胰岛素抵抗;3T3-L1
收稿日期: 2023-02-10
基金项目: 四川省科技计划(2020YFS0281)
作者简介: 郑浩睿(1997-),女,山东泰安,硕士研究生,主要研究领域为药用植物天然产物.E-mail: 1240901932@qq.com
通讯作者: 唐琳.E-mail:tanglin@scu.edu.cn
Mechanism study on the polyphenols of Penthorum chinense
Pursh. ameliorating insulin resistance
ZHENG Hao-Rui, WANG Tao-Yu, XUE Hai-Rui, TANG Lin
(Gollege of Life Sciences,Sichuan University, Chengdu 610065)
In order to explore the effect and mechanism of polyphenol of Penthorum chinense Pursh. on improving insulin resistance, the ethyl acetate phase of the stem of Penthorum chinense Pursh. (PSE)was used as the research material, and the 3T3-L1 adipocyte differentiation model was established. The accumulation of lipid droplets and the expression of key enzymes of fatty acid synthesis in adipocytes were observed by measuring the content of triglyceride and total cholesterol. Oil red O and Nile red staining results showed that the lipid droplets in the differentiated adipocytes were significantly increased compared with the control preadipocytes, and the treatment of PSE could significantly inhibit lipid accumulation. Western Blot results showed that PSE could improve insulin resistance by activating the PI3K-Akt/GSK-3β signaling pathway and up-regulating the expression of p-ACC, CPT1a, PGC-1α and PPARα, which control lipolysis and fatty acid oxidation. PSE also downregulated CD36, FASn, and SREBP1c proteins that regulate lipid synthesis. In summary, PSE can improve insulin resistance by activating the PI3K-Akt/GSK-3β signaling pathway, and at the same time, promote lipid decomposition, and inhibit fat synthesis.
Penthorum chinense Pursh.;Diabetes Mellitus;Insulin Resistance;3T3-L1
1 引 言
糖尿病是一种世界范围的流行性疾病,其中Ⅱ型糖尿病(T2DM)约占所有糖尿病病例的90%[1].T2DM是一种涉及遗传和环境等多因素性疾病,其病理生理学特征是β细胞功能障碍,胰岛素抵抗和慢性炎症引起的糖脂和蛋白质代谢紊乱,这些特征会缓慢且持续地阻碍血糖水平的控制,最终导致微血管和大血管并发症的发展[2].有研究证明肥胖会大大增加患T2DM的几率[3],然而全球有超过三分之一的人口超重或肥胖[4],这将极大地增加了T2DM的潜在患病概率.据报道,减少卡路里摄入量来减肥,不仅有助于控制血糖,还有助于改善血压、血脂水平以及糖尿病和肥胖相关疾病[5].肥胖主要表现为体内脂肪过多而且分布不均.脂肪组织是机体能量代谢的核心,当体内能量代谢紊乱时,将导致脂质代谢紊乱和脂肪组织过度积累,并引发胰岛素抵抗等症状[6].此外,国际医学权威杂志柳叶刀子刊《Lancet Digital Health》发表的一篇文章证明了肥胖可导致糖尿病的发生,并提出预防肥胖可有效干预糖尿病的策略[7].
赶黄草(Penthorum chinense Pursh.)是虎耳草科 (Saxifragaceae)扯根菜属植物[8],其性温、味甘、无毒,具有清热解毒、活血散瘀、利水消肿、退黄、保肝护肝的功效.
植物多酚是植物体内重要的次生代谢产物,许多可食类植物如蔬菜、水果、茶等植物的花、茎、叶以及果实中都富含多酚类化合物.多酚类合物具有抗氧化、抗肿瘤、保肝等功效[9-11].此外,研究表明,富含植物多酚的苹果、姜、绿茶等可用于预防胰岛素耐受以及代谢紊乱等症状[12-14].而核受体蛋白PPARα和PPARγ在多酚类化合物缓解和改善高脂引起的肥胖等病症中起到关键作用.因此发掘植物中的天然活性成分具有良好的前景,本研究便旨在开发利用赶黄草中的天然酚类成分,并研究其对预防与治疗胰岛素抵抗的功效.
据《全国中草药汇编》下册中记载,赶黄草具有利尿消肿的功效,这也使得赶黄草与糖尿病的治疗联系了起来.2015年《Journal of Ethnopharmacology》杂志发表了一篇关于赶黄草降血糖的文章,该文献用高糖高脂饲料和STZ联合喂养大鼠,使其出现胰岛素抵抗症状.研究表明赶黄草多酚可以降低血清中糖基化血红蛋白、甘油三酯和胆固醇等水平,同时,可以升高高密度脂蛋白和胰岛素水平,证明赶黄草在一定程度上具有降血糖的作用及潜力[15].该文章仅在糖尿病模型相关表型上做了初步研究,但对于具体的降血糖的机制及通路尚不明确.
本研究以赶黄草茎乙酸乙酯提取相为研究材料,建立了3T3-L1脂肪细胞诱导分化模型,结果表明PSE可以激活PI3K-Akt-GSK-3β信号通路来改善胰岛素抵抗,还可以上调p-ACC、CPT1a、PGC-1α和PPARα这些控制脂质分解和脂肪酸氧化的蛋白的表达,并下调CD36、FASn和SREBP1c调节脂质合成的蛋白.研究结果为进一步开发利用赶黄草多酚资源与其糖尿病预防作用提供了一定研究依据.
2 材料与方法
2.1 材 料
2.1.1 植物材料
赶黄草干燥材料购买于四川省古蔺县桂花乡臣相赶黄草种植专业合作社,经四川大学生命科学学院白洁副教授鉴定为赶黄草,材料经粉碎机粉碎后于-20 ℃密封保存.称取一定质量的赶黄草茎粉末,按料液比1∶25加入70%乙醇,超声提取两次,经旋转蒸发仪减压浓缩,然后加入超纯水重悬,加入相同体积的乙酸乙酯进行萃取,萃取10次;溶于磷酸盐缓冲液(PBS)用于体外细胞实验.
2.1.2 细胞培养材料
小鼠胚胎成纤维细胞3T3-L1均由中国科学院干细胞库提供.HyClone 新生小牛血清购自格来赛生命科技(上海)有限公司.
2.1.3 实验材料
地塞米松、IBMX购自阿拉丁生物;无水葡萄糖、油红O染色液(细胞专用)、牛胰岛素和罗格列酮(Rosiglitazone,Rosi)购自Solarbio;棕榈酸(Palmitic acid,PA)购自源叶生物;糖原试剂盒、甘油三酯试剂盒和胆固醇试剂盒购自南京建成;Cell Counting Kit-8(CCK-8)细胞增殖检测试剂盒购自上海陶术生物科技有限公司;尼罗红购自上海懋康生物科技有限公司;p-GSK3β(Ser9)、GSK3β、PGC1α、FAS、ACC、p-ACC(Ser80)、PI3K p85α、p-PI3K(Tyr607)、Akt1/2/3、p-Akt(Ser473)、CD36、SREBP1c、PPARα、CPT1α和β-Actin购自上海艾博威斯生物科技有限公司;Glut 4购自江苏亲科生物研究中心有限公司.
2.2 方 法
2.2.1 3T3-L1细胞实验
将3T3-L1前脂肪细胞培养至细胞融合2 d后换为MDI诱导培养基继续培养2 d,会发现细胞形态有明显的变化.再用Insulin培养基继续培养四天,每2 d换一次液.最后更换为DMEM高糖培养基培养2 d,可观察到明显变大的脂滴.至此,3T3-L1前脂肪细胞已经诱导分化为脂肪细胞.在诱导分化之后加入PSE培养24 h后测定相关表型与蛋白表达量.
2.2.2 3T3-L1细胞毒性实验
取处于生长对数期的细胞经消化后接种于96孔板中,每孔100 μL,过夜培养.待细胞汇合至80%时,将对照组用无血清培养基,加药组添加不同浓度的PSE用无血清培养基分别稀释至终浓度为10、20、30、40、50、60、70和80 μg/mL,培养24 h.最后使用CCK-8试剂测量450 nm的光吸收值.细胞存活率用(加药组吸收值-空白组吸收值)/(对照组吸收值-空白组吸收值)×100%表示.
2.2.3 脂肪细胞甘油三酯(TG)和总胆固醇(T-CHO)测定
将细胞接种于6孔板中诱导分化,待细胞分化为脂肪细胞时收集细胞到1.5 mL离心管中,800 r/min离心5 min,弃上清.加入PBS进行超声破碎细胞.直接采用甘油三酯(TG)和总胆固醇(T-CHO)试剂盒在510 nm波长下测量,根据说明书计算含量.
2.2.4 油红O脂质染色
将饱和油红O原液按3∶2体积比加入蒸馏水混匀,室温放置5~10 min,过滤后备用.对6孔板中诱导分化后的脂肪细胞进行脂质染色,吸走培养液,PBS轻轻晃动清洗3次,用4%多聚甲醛室温固定30 min,PBS清洗一次后加入油红O工作液,室温染色10 min左右.吸去染液,加入75%酒精或60%异丙醇,除去未结合的染料,蒸馏水冲洗3次.倒置显微镜观察并拍照.
2.2.5 尼罗红荧光染色
称取尼罗红粉末于丙酮中,配置1 mg/mL的母液,-20 ℃储存.PBS冲洗诱导分化后的脂肪细胞3次,4%多聚甲醛固定30 min,然后用60%异丙醇洗涤10 min,6孔板干燥后加入终浓度为5 μg/mL的尼罗红荧光染料,避光孵育15 min.PBS除去未与脂质结合的染料,在倒置荧光显微镜下观察并拍照.
2.2.6 Western Blot
待3T3-L1细胞生长至90%汇合度时将细胞消化离心,弃上清.向离心管中加入300 μL RIPA细胞裂解液和3 μL蛋白酶抑制剂混合物;超声破碎细胞后,于4 ℃下15 000 r/min离心30 min,取上清.测定蛋白浓度,调平后,加入四分之一的SDS-PAGE上样缓冲液(5×)于100 ℃下煮沸5 min,-80 ℃保存备用.点样后120 V跑胶.跑胶结束后转膜、封闭洗膜、孵育一抗二抗后显影.
2.2.7 数据处理及统计方法
Graphpad Prism 8.0 软件用来分析数据和作图.所有实验结果用平均数±标准差(Mean±SD)来表示,P<0.05时认为具有显著性差异.
3 结果与分析
3.1 3T3-L1细胞实验结果
3.1.1 3T3-L1细胞诱导分化模型评估
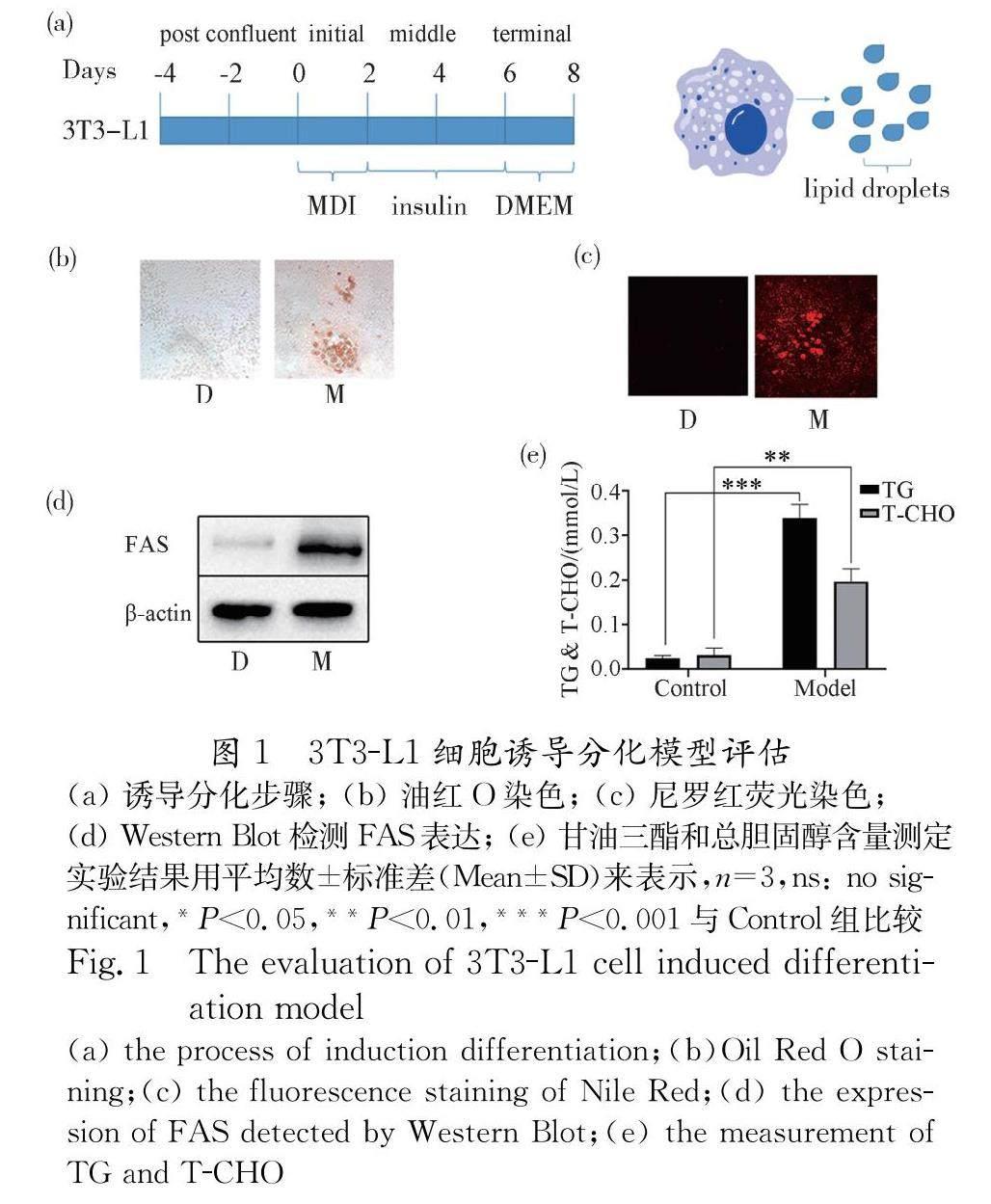
因为肥胖与糖尿病之间有着密切的联系,因此我们建立脂肪细胞模型来探究PSE对脂肪细胞的影响.3T3-L1前脂肪细胞经过(图1a)的诱导分化过程后,细胞内几乎都会有脂滴出现,这时3T3-L1已经分化为脂肪细胞.故先对脂肪细胞的一些指标进行检测.首先,我们采用油红O(图1b)脂质染色和尼罗红荧光(图1c)观察脂肪细胞内的脂滴,可以发现在诱导分化后的脂肪细胞内的脂滴比正常组前脂肪细胞有着显著地增加.接着便利用WB来验证脂肪酸合成关键酶FAS的表达情况,结果表明脂肪细胞内的FAS表达明显上调(图1d).最后,利用试剂盒检测了脂肪细胞内甘油三酯(TG)和总胆固醇(T-CHO)的含量,和预期一致,TG和T-CHO的合成显著升高(图1e).总而言之,所有指标都符合脂肪细胞的特征,说明3T3-L1细胞成功诱导分化成脂肪细胞.
3.1.2 PSE对3T3-L1细胞活力的影响
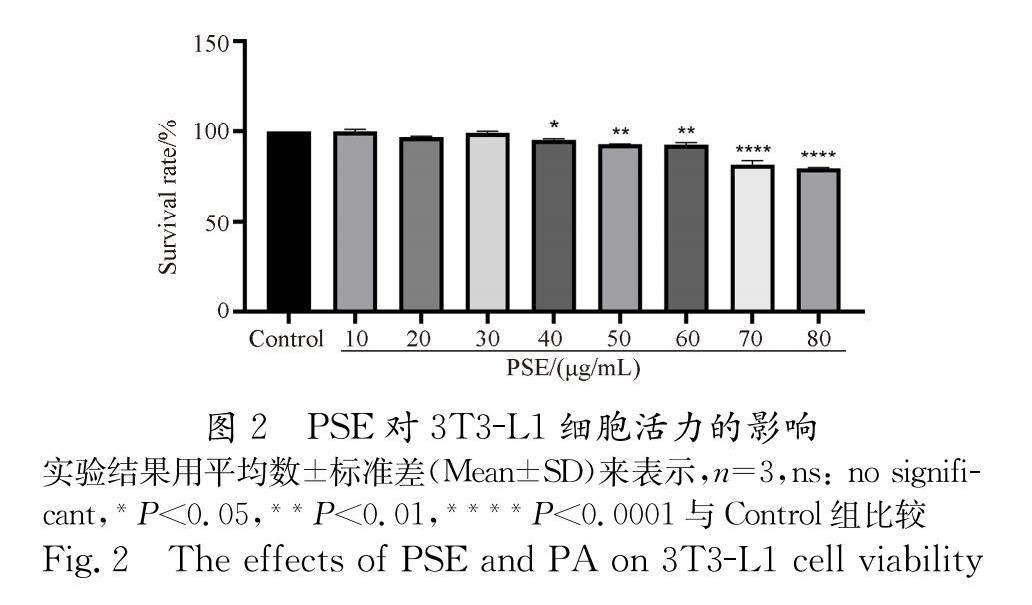
采用上述诱导分化方法当细胞变为脂肪细胞后,评估PSE对其的毒性大小.由图2可知,PSE浓度在10到30 μg/mL时,对细胞基本没有毒性(不具有显著性),40 μg/mL之后细胞毒性显著增加.故选用10、20和30 μg/mL的浓度进行后续实验.
3.1.3 PSE可以降低3T3-L1脂肪细胞中的脂质积累
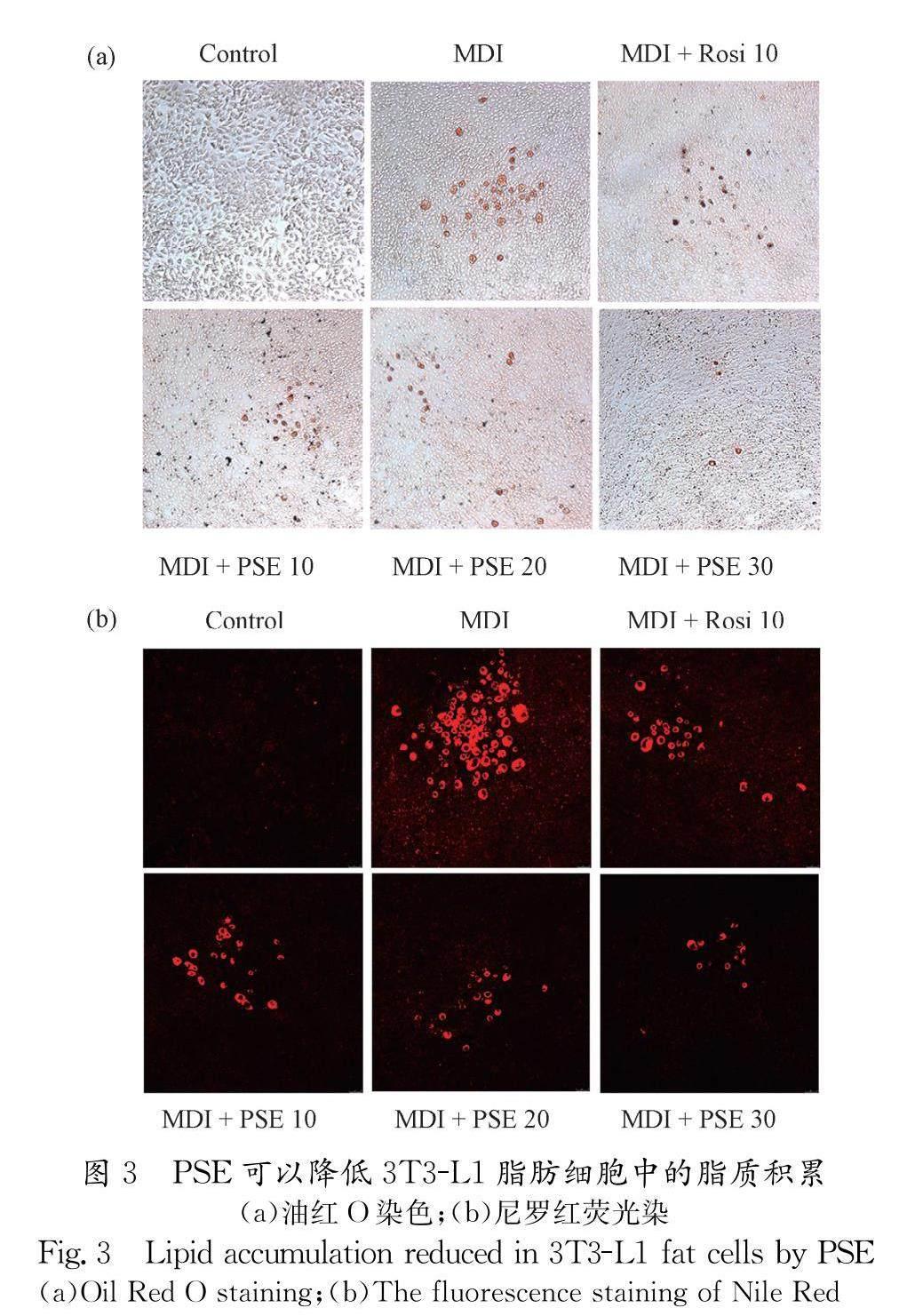
同样采用油红O和尼罗红两种脂滴染色方式来观察脂肪细胞内的脂滴情况,结果如图3所示,两种染色结果都表明PSE可以剂量依赖性地降低脂肪细胞的脂滴积累,减轻对细胞的负担,发挥改善胰岛素抵抗的作用.
3.1.4 PSE可以降低糖尿病相关蛋白的表达
借助Western Blot实验检测糖脂代谢相关蛋白的表达情况,首先,对PI3K-Akt通路进行验证,可以发现p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β和GLUT4蛋白的表达明显上调(图4a),说明PSE处理可以改善胰岛素抵抗;另外,还检测了脂肪代谢相关蛋白,结果(图4b)表明PSE可以下调胆固醇调节元件结合蛋白(SREBP1c)和脂肪酸合成关键酶(FAS)的表达,从而减少TG和T-CHO的合成,脂肪酸氧化调控蛋白(PPARα)、乙酰辅酶A羧化酶(ACC)磷酸化、脂肪酸转位酶(CD36)、肉毒碱棕榈酰基转移酶1A(CPT1α)和过氧化物体增殖物激活的受体γ共激活剂-1α(PGC-1α)等促进脂肪酸氧化的蛋白表达上调,说明PSE可以促进脂肪降解,避免了脂滴在细胞内沉积.
4 讨 论
糖尿病是临床上常见的内分泌疾病,古时候中医称其为消渴病,患者会出现多饮、多食和多尿的临床症状表现,随着疾病的恶化还会导致多种多样的并发症,严重危害了人体健康,并对患者的经济和生活产生较大的影响[16].
另外,据相关调查研究表明,肥胖会导致慢性全身性炎症,形成胰岛素抵抗,并最终导致Ⅱ型糖尿病,这种慢性炎症的状态会导致糖尿病并发症,包括非酒精性脂肪性肝病、视网膜病变、心血管疾病和肾病,因此肥胖可能会成为Ⅱ型糖尿病与其他疾病(如阿尔茨海默病、多囊卵巢综合征、痛风和类风湿性关节炎等)关联的基础[17].Ⅱ型糖尿病的风险随着体重指数的增加而线性增加,因此,全世界肥胖患病率的增加将导致Ⅱ型糖尿病患病率随的上升[18].
CD36可以介导内吞作用将脂肪酸转运到脂肪细胞中,阻断内吞作用可显著抑制CD36依赖的脂肪酸摄取、脂滴沉积和高脂肪饮食(HFD)引起的体重增加[19].脂肪酸合酶(fatty acid synthase)是一种多酶蛋白,可催化哺乳动物细胞中NADPH依赖的反应:乙酰辅酶A和丙二酰辅酶A脂肪酸的合成[20].胆固醇调节元件结合蛋白1c(Sterol-regulatory element binding protein,SREBP1c)与脂肪生成和脂肪生成的调节[21],激活介导肝脏合成的关键酶的全部补体,包括从头的脂肪合成和甘油三酯合成[22].乙酰辅酶A羧化酶(ACC)是脂肪酸从头合成的限速酶,它促进乙酰辅酶A转化为代谢中间体丙二酰辅酶A,丙二酰辅酶A是脂肪酸氧化的抑制剂,因为它对肉碱棕榈酰转移酶-1(CPT1)的变构抑制[23],而ACC磷酸化之后就会失活,促使脂肪分解并阻止脂肪合成.而CPT1a是催化整体线粒体脂肪酸氧化的主要调节步骤[24].PGC1α是富含线粒体的棕色脂肪组织中PPARα的调节剂,具有产热、维持线粒体生物发生和功能以及细胞能量代谢的关键作用[25,26].PPARα是一种核受体,可调节肝脏和骨骼肌脂质代谢以及葡萄糖稳态,PGC-1α介导的PPARα激活可能是肝脂肪酸分解代谢的主要机制[27],并且PPARα改善代谢综合征的症状(内脏肥胖、胰岛素抵抗、致动脉粥样硬化性血脂异常和炎症)的能力表明,PPARα可能有益于预防或治疗Ⅱ型糖尿病和相关并发症[28].
所以通过降脂来改善胰岛素抵抗症状也可能是一种有效的治疗糖尿病方法.本文建立了3T3-L1脂肪细胞的诱导分化模型,经相关指标评估证明了该方法诱导分化的成功.在诱导分化之后加入PSE培养24 h发现,细胞内的脂滴数量显著减少(油红O染色和尼罗红荧光染色均证明了这一点).我们评估了PSE在3T3-L1细胞中PI3K-Akt-GSK-3β信号通路的激活情况,研究表明PSE可以上调p-ACC、CPT1a、PGC-1α和PPARα这些控制脂质分解和脂肪酸氧化的蛋白的表达,并下调CD36、FASn和SREBP1c调节脂质合成的蛋白,同时,可以观察到细胞里的脂滴明显减少,证明PSE可能会促进脂肪细胞向棕色细胞转促使脂质发生分解.
综上所述,我们发现赶黄草多酚可以通过降低脂质积累及抑制脂肪合成代谢相关蛋白来预防胰岛素抵抗,本研究为进一步开发利用赶黄草多酚资源与其糖尿病预防作用提供了一定研究依据.
参考文献:
[1]Li S, Fan T-P, Jia W, et al. Network Pharmacology in Traditional Chinese Medicine [J]. eCAM, 2014, 2: 138460.
[2]Zhang R, Zhu X, Bai H, et al. Network Pharmacology Databases for Traditional Chinese Medicine: Review and Assessment [J]. Front Pharmacol, 2019, 10: 123.
[3]Li S, Zhang B. Traditional Chinese medicine network pharmacology: theory, methodology and application [J]. Chin J Nat Medicines, 2013, 11: 110.
[4]Zheng Y, Ley S H, Hu F B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications [J]. Nat Rev Endocrinol, 2018, 14: 88.
[5]Bell D S. Type 2 diabetes [J]. Ann Intern Med, 2015, 163: 322.
[6]Kahn B B, Flier J S. Obesity and insulin resistance [J]. J Clin Invest, 2000, 106: 473.
[7]Hypp?nen E, Mulugeta A, Zhou A, et al. A data-driven approach for studying the role of body mass in multiple diseases: a phenome-wide registry-based case-control study in the UK Biobank [J]. Lancet Digit Health, 2019, 1: e116.
[8]中国科学院中国植物志委员会. 中国植物志[M]. 北京: 科学出版社, 1974.
[9]Urquiaga I, Leighton F. Plant polyphenol antioxidants and oxidative stress [J]. Biol Res, 2000, 33: 55.
[10]Khan H Y, Zubair H, Faisal M, et al. Plant polyphenol induced cell death in human cancer cells involves mobilization of intracellular copper ions and reactive oxygen species generation: a mechanism for cancer chemopreventive action [J]. Mol Nutr Food Res, 2014, 58: 437.
[11]Girish C, Pradhan S C. Hepatoprotective activities of picroliv, curcumin, and ellagic acid compared to silymarin on carbon-tetrachloride-induced liver toxicity in mice [J]. J Pharmacol Pharmacother, 2012, 3: 149.
[12]Ogura K, Ogura M, Shoji T, et al. Oral Administration of Apple Procyanidins Ameliorates Insulin Resistance via Suppression of Pro-Inflammatory Cytokine Expression in Liver of Diabetic ob/ob Mice [J]. J Agric Food Chem, 2016, 64: 8857.
[13]Mozaffari-khosravi H, Talaei B, Jalali B A, et al. The effect of ginger powder supplementation on insulin resistance and glycemic indices in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled trial [J]. Complement Ther Med, 2014, 22: 9.
[14]Ryu O H, Lee J, Lee K W, et al. Effects of green tea consumption on inflammation, insulin resistance and pulse wave velocity in type 2 diabetes patients [J]. Diabetes Res Clin Pract, 2006, 71: 356.
[15]Huang D, Jiang Y, Chen W, et al. Evaluation of hypoglycemic effects of polyphenols and extracts from Penthorum chinense [J]. J Ethnopharmacol, 2015, 163: 256.
[16]罗清艳. 有关中医药治疗糖尿病消渴症的研究进展 [J]. 现代养生, 2017, 18: 153.
[17]Rohm T V, Meier D T, Olefsky J M, et al. Inflammation in obesity, diabetes, and related disorders [J]. Immunity, 2022, 55: 31.
[18]Klein S, Gastaldelli A, Yki-j?rvinen H, et al. Why does obesity cause diabetes? [J]. Cell Metab, 2022, 34: 11.
[19]Hao J W, Wang J, Guo H, et al. CD36 facilitates fatty acid uptake by dynamic palmitoylation-regulated endocytosis [J]. Nat Commun, 2020, 11: 4765.
[20]Bueno M J, Quintela-fandino M. Emerging role of Fatty acid synthase in tumor initiation: implications for cancer prevention [J]. Mol Cell Oncol, 2020, 7: 1709389.
[21]Muthukumaran P, Thiyagarajan G, Arun Babu R, et al. Raffinose from Costus speciosus attenuates lipid synthesis through modulation of PPARs/SREBP1c and improves insulin sensitivity through PI3K/AKT [J]. Chem Biol Interact, 2018, 284: 80.
[22]Deng X, Dong Q, Bridges D, et al. Docosahexaenoic acid inhibits proteolytic processing of sterol regulatory element-binding protein-1c (SREBP-1c)via activation of AMP-activated kinase [J]. Biochim Biophys Acta, 2015, 1851: 1521.
[23]Lally J S V, Ghoshal S, Deperalta D K, et al. Inhibition of acetyl-CoA carboxylase by phosphorylation or the inhibitor ND-654 suppresses lipogenesis and hepatocellular carcinoma [J]. Cell Metab, 2019, 29: 174.
[24]Lee K, Kerner J, Hoppel C L. Mitochondrial carnitine palmitoyltransferase 1a (CPT1a)is part of an outer membrane fatty acid transfer complex [J]. J Biol Chem, 2011, 286: 25655.
[25]Singh S P, Mcclung J A, Thompson E, et al. Cardioprotective heme oxygenase-1-PGC1α signaling in epicardial fat attenuates cardiovascular risk in humans as in obese Mice [J]. Obesity (Silver Spring), 2019, 27: 1634.
[26]Puigserver P, Wu Z, Park C W, et al. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis [J]. Cell, 1998, 92: 829.
[27]Wang Y X. PPARs: diverse regulators in energy metabolism and metabolic diseases [J]. Cell Res, 2010, 20: 124.
[28]Lefebvre P, Chinetti G, Fruchart J C, et al. Sorting out the roles of PPAR alpha in energy metabolism and vascular homeostasis [J]. J Clin Invest, 2006, 116: 571.
引用本文格式:
中 文: 郑浩睿,王韬宇,薛海瑞, 等. 赶黄草多酚改善胰岛素抵抗的机制研究[J]. 四川大学学报: 自然科学版, 2023, 60: 066004.
英 文: Zheng H R, Wang T Y, Xue H R, et al. Mechanism study on the polyphenols of Penthorum chinense Pursh. ameliorating insulin resistance [J]. J Sichuan Univ: Nat Sci Ed, 2023, 60: 066004.
