C反应蛋白与白蛋白比值对酒精性肝硬化合并自发性细菌性腹膜炎的诊断价值
2023-04-29熊飞翔孟培培江宇泳张琴姜艳丹段浩鑫赵赛赛
熊飞翔 孟培培 江宇泳 张琴 姜艳丹 段浩鑫 赵赛赛


摘要:目的分析C反應蛋白/白蛋白比值(CAR)判断酒精性肝硬化(ALC)患者是否合并自发性细菌性腹膜炎(SBP)的临床价值。方法回顾性选取2020年8月—2022年2月首都医科大学附属北京地坛医院住院的ALC患者329例,根据入院时是否合并SBP分为ALC未合并SBP组(n=246)和ALC合并SBP组(n=83),比较两组患者的性别、年龄、合并症、并发症、血常规、肝肾功能、血脂和凝血指标。符合正态分布的计量资料两组间比较采用成组t检验;不符合正态分布的计量资料两组间比较采用Mann-Whitney U检验。计数资料两组间比较采用χ2检验。多因素二元Logistic回归分析判断发生SBP的危险因素,绘制CAR的受试者工作特征曲线(ROC),计算曲线下面积(AUC)、最佳截断值和95%CI。结果合并SBP患者的WBC、中性粒细胞、中性粒细胞/淋巴细胞比值、单核细胞、C反应蛋白(CRP)、CAR等炎性指标水平均高于未合并SBP患者,前者的AST、TBil、INR、MELD评分高于后者,而Alb、HDL水平显著低于后者(P值均<0.05)。多因素Logistic回归分析发现CAR(OR=20.628,95%CI:6.720~74.052,P<0.01)、RBC(OR=0.600,95%CI:0.381~0.932,P=0.025)是判断ALC患者是否合并SBP的独立危险因素。与NLR(AUC=0.725)、WBC(AUC=0.651)相比,CAR的AUC(AUC=0.825)明显较高。CAR的最佳截断值为0.324,分组后显示高风险组合并SBP的比例是63.2%(55/87),显著高于低风险组的11.6%(28/242)(χ2=90.495,P<0.01)。结论CAR是判断ALC患者发生SBP的良好标志物。
关键词:C反应蛋白/白蛋白比值; 肝硬化, 酒精性; 自发性细菌性腹膜炎
基金项目:首都卫生科研发展专项(首发2020-2-2172); 国家中医药管理局中医肝病重点专科
Clinical value of C-reactive protein/albumin ratio in the diagnosis of alcoholic cirrhosis with spontaneous bacterial peritonitis
XIONG Feixiang MENG Peipei JIANG Yuyong ZHANG Qin JIANG Yandan DUAN Haoxin ZHAO Saisai (1. Department of Integrative Medicine, Beijing Ditan Hospital, Capital Medical University, Beijing 100015, China; 2. Graduate School, Dongzhimen Hospital, Beijing University of Chinese Medicine, Beijing 100700, China)
Corresponding author:JIANG Yuyong, jyuy11@126.com (ORCID:0000-0002-6082-1180)
Abstract:ObjectiveTo investigate the clinical value of C-reactive protein/albumin ratio (CAR) in determining spontaneous bacterial peritonitis (SBP) in patients with alcoholic cirrhosis (ALC). MethodsA retrospective analysis was performed for 329 ALC patients with SBP who were hospitalized in Beijing Ditan Hospital, Capital Medical University, from August 2020 to February 2022, and according to the presence or absence of SBP on admission, they were divided into non-SBP group with 246 patients and SBP group with 83 patients. The two groups were compared in terms of sex, age, comorbidities, complications, blood routine, liver and renal function, blood lipids, and coagulation markers. The independent-samples t test was used for comparison of normally distributed quantitative data between two groups, and the Mann-Whitney U test was used for comparison of non-normally distributed quantitative data between two groups; the chi-square test was used for comparison of qualitative data between two groups. A multivariate binary logistic regression analysis was used to identify the risk factors for SBP. The receiver operating characteristic (ROC) curve was plotted for CAR to calculate the area under the ROC curve (AUC), the optimal cut-off value, and 95% confidence interval (CI). ResultsCompared with the non-SBP patients, the SBP patients had significantly higher inflammatory indicators (WBC, neutrophils, NLR, monocytes, C-reactive protein, and CAR), significantly higher aspartate aminotransferase, total bilirubin, international normalized ratio, and MELD score, and significantly lower levels of albumin and high-density lipoprotein (all P<0.05). The multivariate logistic regression analysis showed that CAR (odds ratio [OR]=20.628, 95%CI: 6.720-74.052, P<0.01) and red blood cell count (OR=0.600, 95%CI: 0.381-0.932, P=0.025) were independent risk factors for determining SBP in ALC patients. CAR had a significantly larger AUC than NLR and WBC (0.825 vs 0.725/0.651) and an optimal cut-off value of 0.324. The patients were divided into high-risk group and low-risk group, and the analysis showed that the high-risk group had a significantly higher proportion of patients with SBP than the low-risk group [63.2% (55/87) vs 11.6%(28/242), χ2=90.495, P<0.01]. ConclusionCAR is a good marker for determining SBP in patients with ALC.
Key words:CRP/Alb Ratio; Liver Cirrhosis, Alcoholic; Spontaneous Bacterial Peritonitis
Research funding:Capital Health Research and Development Project (2020-2-2172); The State Administration of Traditional Chinese Medicine Key Specialty of Liver Disease
酒精性肝硬化(alcoholic liver cirrhosis,ALC)是酒精性肝病发展的终末阶段,在疾病晚期会出现多种危害生命的严重并发症,如腹水、自发性细菌性腹膜炎(SBP)、肝性脑病、消化道出血等。SBP常继发于肝硬化出现腹水之后,是肝硬化患者慢加急性肝衰竭的常見诱发因素,发生SBP后易合并出现败血症、肝性脑病等并发症,30天的病死率可达20%[1]。对于腹水后出现的SBP多通过诊断性腹腔穿刺术进行诊断,但部分患者腹水量少,无法穿刺;术后易出现穿刺点出血、皮下水肿等并发症,因此临床上需要寻找对患者危害更小的无创指标,以期早发现、及时判断SBP,便于下一步治疗。
目前临床上常用于判断SBP的血清标志物主要有C反应蛋白(CRP)、中性粒细胞/淋巴细胞比值(NLR)、血清淀粉样蛋白A等[2]。有研究[3]发现CRP是肝硬化患者发生SBP的独立预测指标,CRP>13.5 mg/L的患者发生SBP的概率显著提升;NLR反应了炎症和免疫之间的关系,Popoiag等[4]的研究显示NLR>2.4是肝硬化患者发生SBP的独立危险因素。淋巴细胞/单核细胞比值(LMR)可以反应机体的炎症水平,韩才均等[5]发现NLR、LMR是预测肝硬化腹水并发SBP治疗有效的标志物。
肝硬化患者腹水的发生与血清白蛋白(Alb)水平有显著的关系,有研究[6]发现失代偿肝硬化患者因氧化应激致使Alb位点Ⅱ结合(主要结合芳香羧基化合物)功能受损,导致晚期肝硬化患者出现慢加急性肝衰竭和败血症。Alb、CRP作为可以反应肝脏疾病发展的重要指标,将两个指标联合起来对于判断疾病的风险有重要价值,Oikonomou等[7]的研究显示CRP与Alb比值(CAR)是失代偿肝硬化患者死亡的独立危险因素,本研究的目的在于探索CAR对于ALC患者发生SBP的诊断价值。
1资料与方法
1.1研究对象本研究回顾性地选取首都医科大学附属北京地坛医院2020年8月1日—2022年2月1日住院的ALC患者,并收集患者入院时的基本信息、并发症的发生情况和实验室资料。
1.2纳入标准ALC的诊断参照《酒精性肝病防治指南(2018年更新版)》[8],SBP的诊断参照《中国肝硬化腹水及并发症处理指南》[9]。
1.3排除标准(1)合并病毒性肝炎、自身免疫性肝病和遗传性肝病的患者;(2)基线数据不全的患者;(3) 被诊断为肝细胞癌、其他肝肿瘤、其他肿瘤及术后的患者;(4)既往有肝移植史的患者;(5)无SBP而患有其他感染的患者。
1.4统计学方法应用R软件4.2.0版本和SPSS 26.0版本进行统计分析。符合正态分布的计量资料以x±s表示,两组间比较采用成组t检验。不符合正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。计数资料两组间比较采用χ2检验。将基线中P<0.05的指标纳入多因素二元Logistic回归,绘制受试者工作特征曲线(ROC曲线),并计算曲线下面积(AUC)、最佳截断值和95%CI。P<0.05为差异有统计学意义。
2结果
2.1患者的基线情况共收集ALC患者329例,其中合并SBP患者83例,未合并SBP患者246例。两组患者均主要为男性。合并SBP患者出现腹水、消化道出血等并发症等比例均高于未合并SBP患者(P值均<0.05)。合并SBP患者的WBC、中性粒细胞(NE)、NLR、单核细胞(MO)、CRP、CAR等炎性指标水平均高于未合并SBP患者,前者的AST、TBil、INR、MELD评分高于后者,而Alb、HDL水平显著低于后者(P值均<0.05)。其他指标差异均无统计学意义(P值均>0.05) (表1)。
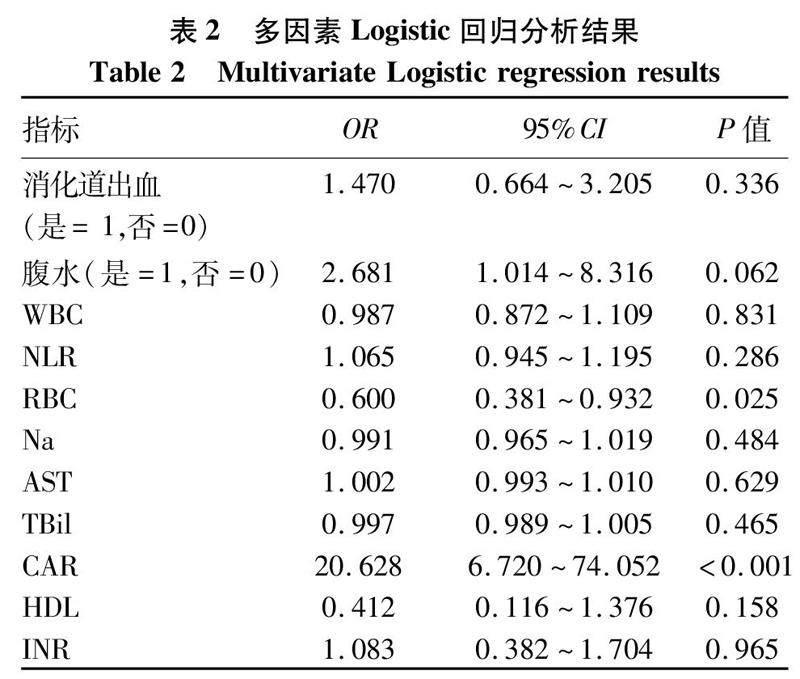
2.2多因素Logistic分析结果将基线中P值<0.05的指标纳入多因素Logistic回归,排除共线性后结果显示,RBC、CAR是诊断ALC患者发生SBP的独立危险因素(P值均<0.05)(表2)。
2.3CAR诊断ALC合并SBP的价值绘制CAR诊断发生SBP的ROC曲线后,结果显示其AUC为0.825,最佳截断值是0.324。NLR、WBC的AUC分别为0.725、0.651,说明CAR的诊断价值显著优于NLR和 WBC(Z值分别为-3.407、-4.902,P值均<0.05)(图1)。
2.4高CAR的ALC患者SBP发生情况以0.324作为截断值,将ALC患者分为低风险组(242例)和高风险组(87例),结果显示高风险组ALC患者SBP发生比例是63.2%(55/87),显著高于低风险组的11.6%(28/242)(χ2=90.495,P<0.01)。3讨论
SBP是晚期肝病患者常见的并发症,而ALC患者较其他类型肝病患者发生SBP的风险更高,在一项纳入6 530例因SBP住院的横断面研究[10]中,因酒精导致的失代偿住院患者其死亡风险增加了48%,一部分原因是ALC患者由于酒精作用导致肠道菌群改变而更容易发生SBP[11]。由于SBP严重危害ALC患者的生命,因此探寻可以早期发现SBP发生的血清学指标至关重要。
ALC患者晚期常伴有Alb水平顯著下降,从而导致出现大量腹水,与无腹水的肝硬化患者相比,其SBP发生率从7%提高到了30%[12];Alb已经被证明可以降低SBP患者肾损伤和病死率,联合抗生素和Alb治疗可以将肝硬化并发SBP患者的90天病死率降至22%[13],美国肝病学会在指南[14]中也将Alb作为肝硬化合并SBP患者的治疗,特别是对于合并有肾功能不全的患者。CRP作为常用的炎症指标,在不同的感染中CRP升高都有一定的预测价值,有研究[15]以年龄、PLT、CRP>60 mg/L开发了评分公式用于预测SBP的发生且该模型的AUC在训练集中为0.71(95%CI:0.629~0.786);Iliaz等[16]的研究发现CRP是肝硬化合并SBP患者30天死亡的独立危险因素。两者虽然都展示了在临床中运用的价值,但联合运用的数据较少,CAR作为新的炎症指标,在许多疾病中已被证明对感染有预测价值,例如有研究[17]发现CAR是手术后24和48 h预测腹部手术切口发生感染的筛查指标。CAR在部分肝脏疾病也显示了其预测价值,有研究[18]以0.033为截断值将肝内胆管癌患者分为低风险组和高风险组,发现高CAR组患者存活率下降;高CAR也与肝细胞癌患者肿瘤进展和肝功能储备下降有关[19]。
本研究则探究了CAR对于ALC患者发生SBP的诊断价值,并找到最佳的截断值。通过基线比较发现发生SBP的ALC患者其CAR显著高于未发生SBP的ALC患者,通过多因素Logistic回归分析发现CAR是判断SBP发生的独立危险因素,并计算出最佳截断值为0.324。将患者分为低风险组和高风险组后,发现在高CAR组的ALC患者发生SBP的比例相对较高,其他研究[7,17-18]也显示了高CAR是不同疾病发生感染、癌症预后的危险因素。
此外本研究还通过与其他炎症指标进行比较,结果显示CAR有更好的诊断价值。本研究发现CAR诊断SBP的能力强于NLR、WBC,在另一项预测肝硬化患者发生SBP危险因素的研究[20]中,NLR(AUC=0.606)区分SBP的能力不够显著,与本研究一致。在评价其他结局时CAR也能显示更好的诊断价值,在一项HBV感染相关预后的研究[21]中,CAR与MELD评分、Child-Pugh评分相比,其预测HBV感染相关病死率方面表现最佳。虽然预测肝硬化合并SBP发生的血清指标已经有了许多研究描述,但是关于CAR的预测价值还缺少数据,并且酒精作为诱发SBP发生的重要因素,专门研究ALC患者发生SBP的预测因素缺少描述,因此CAR作为新兴的炎症指标不论是对SBP还是其他结局事件的预测价值需要进行进一步的研究。
总之,本研究发现CAR对于诊断SBP有重要意义,并通过与其他炎症指标进行比较、将患者以0.324为截断值分为低风险组和高风险组证明了本研究的结果。然而本研究存在一定的局限性,如采用的是回顾性研究,没有患者的随访数据,且为单中心的研究,未来应当开展前瞻性的、多中心的研究来验证CAR对于ALC患者合并发生SBP的诊断价值,更好的筛选出高风险的人群。
伦理学声明:本研究方案于2022年11月20日由北京地坛医院伦理委员会审批,批号:京地伦科字〔2020〕-第(032)-02号,患者均签署知情同意书。利益冲突声明:本文不存在任何利益冲突。作者贡献声明:江宇泳对研究的思路设计,论文审阅等有关键贡献;熊飞翔参与了研究的设计、数据的分析解释过程及撰写文章关键部分;孟培培负责临床病例收集与判断;张琴、姜艳丹、段浩鑫、赵赛赛参与了研究的数据收集。熊飞翔和孟培培对本文贡献等同,同为第一作者。
参考文献:
[1]SHIZUMA T. Spontaneous bacterial and fungal peritonitis in patients with liver cirrhosis: A literature review[J]. World J Hepatol, 2018, 10(2): 254-266. DOI: 10.4254/wjh.v10.i2.254.
[2]GAO XM, LENG XQ. Research advances of serological markers for spontaneous bacterial peritonitis[J]. Med Innov China, 2022, 19(28): 173-176. DOI: 10.3969/j.issn.1674-4985.2022.28.042.高小梅, 冷雪芹. 自发性细菌性腹膜炎的血清学标志物研究进展[J]. 中国医学创新, 2022, 19(28): 173-176. DOI: 10.3969/j.issn.1674-4985.2022.28.042.
[3]METWALLY K, FOUAD T, ASSEM M, et al. Predictors of spontaneous bacterial peritonitis in patients with cirrhotic ascites[J]. J Clin Transl Hepatol, 2018, 6(4): 372-376. DOI: 10.14218/JCTH.2018.00001.
[4]POPOIAG RE, SUCEVEANU AI, SUCEVEANU AP, et al. Predictors of spontaneous bacterial peritonitis in Romanian adults with liver cirrhosis: Focus on the neutrophil-to-lymphocyte ratio[J]. Exp Ther Med, 2021, 22(3): 983. DOI: 10.3892/etm.2021.10415.
[5]HAN CJ, LI WH, WU ZX, et al. Role of NLR,LMR and PNI in anti-infective therapy of liver cirrhosis related spontaneous bacterial peritonitis[J]. Int J Lab Med, 2022, 43(24): 3012-3015, 3021. DOI: 10.3969/j.issn.1673-4130.2022.24.015.韓才均, 李文浩, 吴政燮, 等. NLR、LMR和PNI在肝硬化相关自发性细菌性腹膜炎抗感染治疗中的作用[J]. 国际检验医学杂志, 2022, 43(24): 3012-3015, 3021. DOI: 10.3969/j.issn.1673-4130.2022.24.015.
[6]OETTL K, BIRNER-GRUENBERGER R, SPINDELBOECK W, et al. Oxidative albumin damage in chronic liver failure: Relation to albumin binding capacity, liver dysfunction and survival[J]. J Hepatol, 2013, 59(5): 978-983. DOI: 10.1016/j.jhep.2013.06.013.
[7]OIKONOMOU T, GOULIS I, KIAPIDOU S, et al. The significance of C-reactive protein to albumin ratio in patients with decompensated cirrhosis[J]. Ann Gastroenterol, 2020, 33(6): 667-674. DOI: 10.20524/aog.2020.0534.
[8]Fatty Liver Expert Committee, Chinese Medical Doctor Association, National Workshop on Fatty Liver and Alcoholic Liver Disease,Chinese Society of Hepatology,Chinese Medical Association. Guidelines of prevention and treatment for alcoholic liver disease: a 2018 update[J]. J Clin Hepatol, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.中国医师协会脂肪性肝病专家委员会, 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 酒精性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.
[9]Chinese Society of Hepatology CMA, XU XY, DUAN ZP, et al. Chinese guidelines on the management of ascites and its related complications in cirrhosis[J]. Hepatol Int, 2019, 13(1): 1-21. DOI: 10.1007/s12072-018-09923-2.
[10]BHANDARI R, KHALIQ K, RAVAT V, et al. Chronic alcoholic liver disease and mortality risk in spontaneous bacterial peritonitis: Analysis of 6, 530 hospitalizations[J]. Cureus, 2020, 12(5): e8189. DOI: 10.7759/cureus.8189.
[11]BETRAPALLY NS, GILLEVET PM, BAJAJ JS. Gut microbiome and liver disease[J]. Transl Res, 2017, 179: 49-59. DOI: 10.1016/j.trsl.2016.07.005.
[12]MARCIANO S, DAZ JM, DIRCHWOLF M, et al. Spontaneous bacterial peritonitis in patients with cirrhosis: Incidence, outcomes, and treatment strategies[J]. Hepat Med, 2019, 11: 13-22. DOI: 10.2147/HMER.S164250.
[13]SORT P, NAVASA M, ARROYO V, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis[J]. N Engl J Med, 1999, 341(6): 403-409. DOI: 10.1056/NEJM199908053410603.
[14]BIGGINS SW, ANGELI P, GARCIA-TSAO G, et al. Diagnosis, evaluation, and management of ascites, spontaneous bacterial peritonitis and hepatorenal syndrome: 2021 practice guidance by the American association for the study of liver diseases[J]. Hepatology, 2021, 74(2): 1014-1048. DOI: 10.1002/hep.31884.
[15]WEHMEYER MH, KROHM S, KASTEIN F, et al. Prediction of spontaneous bacterial peritonitis in cirrhotic ascites by a simple scoring system[J]. Scand J Gastroenterol, 2014, 49(5): 595-603. DOI: 10.3109/00365521.2013.848471.
[16]ILIAZ R, OZPOLAT T, BARAN B, et al. Predicting mortality in patients with spontaneous bacterial peritonitis using routine inflammatory and biochemical markers[J]. Eur J Gastroenterol Hepatol, 2018, 30(7): 786-791. DOI: 10.1097/MEG.0000000000001111.
[17]DONLON NE, MOHAN H, FREE R, et al. Predictive value of CRP/albumin ratio in major abdominal surgery[J]. Ir J Med Sci, 2020, 189(4): 1465-1470. DOI: 10.1007/s11845-020-02238-y.
[18]KANO H, MIDORIKAWA Y, SONG PP, et al. High C-reactive protein/albumin ratio associated with reduced survival due to advanced stage of intrahepatic cholangiocarcinoma[J]. Biosci Trends, 2020, 14(4): 304-309. DOI: 10.5582/bst.2020.03167.
[19]KINOSHITA A, ONODA H, IMAI N, et al. The C-reactive protein/albumin ratio, a novel inflammation-based prognostic score, predicts outcomes in patients with hepatocellular carcinoma[J]. Ann Surg Oncol, 2015, 22(3): 803-810. DOI: 10.1245/s10434-014-4048-0.
[20]PIOTROWSKI D, SCZEWSKA-PIOTROWSKA A, JAROSZEWICZ J, et al. Lymphocyte-to-monocyte ratio as the best simple predictor of bacterial infection in patients with liver cirrhosis[J]. Int J Environ Res Public Health, 2020, 17(5): 1727. DOI: 10.3390/ijerph17051727.
[21]HUANG SS, XIE DM, CAI YJ, et al. C-reactive protein-to-albumin ratio is a predictor of hepatitis B virus related decompensated cirrhosis: Time-dependent receiver operating characteristics and decision curve analysis[J]. Eur J Gastroenterol Hepatol, 2017, 29(4): 472-480. DOI: 10.1097/MEG.0000000000000807.
收稿日期:2022-10-25;錄用日期:2022-12-05
本文编辑:王莹
引证本文:XIONG FX, MENG PP, JIANG YY, et al. Clinical value of C-reactive protein/albumin ratio in the diagnosis of alcoholic cirrhosis with spontaneous bacterial peritonitis[J]. J Clin Hepatol, 2023, 39(8): 1880-1885.