Omega-3多不饱和脂肪酸对缺血缺氧性脑损伤幼鼠炎症和细胞凋亡反应的影响
2023-04-29杨红秀李丽华
杨红秀 李丽华
【摘要】 目的 探討Omega-3多不饱和脂肪酸(ω-3PUFA)对缺氧缺血性脑损伤(HIBD)新生大鼠模型的脑组织炎症、氧化应激和凋亡反应的作用。方法 将90只新生大鼠根据随机数字表法等分为空白组、模型组、ω-3PUFA组。ω-3PUFA组和模型组行HIBD模型处理,造模后前者予150 mg/kg ω-3PUFA灌胃,后者予等体积等频率生理盐水灌胃;空白组行假手术处理,术后处理同模型组。再根据处死时间将每组分为6 h、12 h、24 h三个亚组,比较空白组、模型组、ω-3PUFA组及其亚组的脑组织白细胞介素(IL-6)、肿瘤坏死因子(TNF-α)、脑组织含水量、丙二醛(MDA)、超氧化物歧化酶(SOD)、脑细胞凋亡率。结果 在12 h和24 h时ω-3PUFA组IL-6水平低于模型组,在不同时间点ω-3PUFA组TNF-α水平均低于模型组,高于空白组(均P<0.017);在24 h时,ω-3PUFA组脑组织含水量低于模型组,高于空白组(均P<0.017);24 h时,ω-3PUFA组MDA水平低于模型组,高于空白组(均P<0.017),ω-3PUFA组SOD水平高于模型组,低于空白组(均P<0.017);在24 h时,ω-3PUFA组脑细胞凋亡率低于模型组(P<0.017)。结论 在新生大鼠HIBD模型中,应用ω-3PUFA可有效改善脑组织损伤和凋亡情况。
【关键词】 Omega-3多不饱和脂肪酸;大鼠;缺氧缺血性脑损伤;凋亡反应
【中图分类号】 R651 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0173-06
Abstract: Objective To explore effects of omega-3 polyunsaturated fatty acids(ω-3PUFA)on inflammation, oxidative stress and apoptosis of brain tissue in newborn rats model with hypoxic-ischemic brain damage(HIBD). Methods 90 newborn rats were divided into control group, model group and ω-3PUFA group by random number table. The ω-3PUFA group and the model group were treated with HIBD model, after modeling the former was given 150 mg/kg ω-3PUFA by intragastric administration, the latter was treated with equal volume and frequency physiological saline by intragastric administration, the control group was treated with sham surgery on the basis of the model group. Each group was divided into three subgroups of 6 h, 12 h and 24 h according to the time of being put to death,interleukin(IL)-6, tumor necrosis factor(TNF)-α, brain tissue water content, malondialdehyde(MDA), superoxide dismutase(SOD) and neuronal apoptpsis rate of the control group, model group and ω-3PUFA group and their subgroups were comparatively analyzed. Results At 12 h and 24 h,IL-6 level in the ω-3PUFA group was lower than that in the model group, at different points in time, TNF-α level in the ω-3PUFA group was lower than that in the model group, TNF-α level in the ω-3PUFA group was higher than that in the control group(all P<0.017). At 24 h,brain tissue water content in the ω-3PUFA group was lower than that in the model group, brain tissue water content in the ω-3PUFA group was higher than that in the control group(all P<0.017). At 24 h,MDA level in the ω-3PUFA group was lower than that in the model group, MDA level in the ω-3PUFA group was higher than that in the control group(all P<0.017), SOD level in the ω-3PUFA group was higher than that in the model group, SOD level in the ω-3PUFA group was lower than that in the control group(all P<0.017). At 24 h,neuronal apoptpsis rate in the ω-3PUFA group was lower than that in the model group(P<0.017). Conclusion In the neonatal rats with HIBD model, the application of ω-3PUFA can effectively relieve the brain tissue injury and apoptosis.
Key words: ω-3PUFA; rats; HIBD; apoptotic responses
基金项目:首都医科大学2019年度科技技术、社科计划项目(KM201910025001)
作者单位:101100 北京,首都医科大学附属北京潞河医院儿科
通信作者:李丽华
缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是指新生儿在围生期由于窒息导致部分或完全缺氧,脑血流量降低或暂停引起的脑损伤[1]。在我国,新生儿HIBD的发病率约为2‰,其中15%~20%的患儿于新生期死亡,存活的患儿中25%~30%者将伴有永久性神经系统损伤[2]。HIBD致病机制错综复杂,缺血缺氧状态通过炎症反应、氧化应激、线粒体功能障碍等途径引发神经元坏死和凋亡,形成近远期神经功能缺陷[3]。当前针对HIBD尚无根治性治疗方法,临床多采用亚低温治疗、机械通气、保护神经元等对症支持治疗,但预后并不理想[4-5],促使研究人员积极地寻找更多的治疗靶点。
Omega-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω-3PUFA)是人体必需脂肪酸之一。既往体外研究表明其不仅作为营养物质供能,还能在许多神经疾病中发挥调控炎性因子水平、保护神经元、减轻伤后自噬反应等效用[6-7],如Zhang等[8]报道ω-3PUFA能改善新生HIBD大鼠的血脑屏障功能,减少神经元损伤。据此,本研究应用新生HIBD大鼠模型,进一步探索ω-3PUFA在HIBD中對脑组织的影响。
1 资料与方法
1.1 实验动物来源及分组 90只10日龄新生SD大鼠由潞河医院实验室提供,体质量15~22 g,实验期间大鼠饲养于室温18~25 ℃、相对湿度40%~80%的清洁环境中;所有大鼠应用随机数字表法等分为空白组、模型组、ω-3PUFA组(各30只),每组再随机分为3个亚组(各10只),处死时间分别为模型建立后6 h、12 h、24 h。比较空白组、模型组、ω-3PUFA组及其亚组的脑组织白细胞介素(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、脑组织含水量、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、脑细胞凋亡率。
1.2 HIBD模型建立
1.2.1 模型组和ω-3PUFA组行HIBD模型处理 ω-3PUFA组于术后立即予150 mg/kg的ω-3鱼油脂肪乳注射液(华瑞制药有限公司,国药准字J20150040,100 mL∶10 g∶1.2 g)灌胃[9];模型组予等体积等频率生理盐水灌胃。HIBD模型采用Rice-Vannucci经典方法[10]:两组大鼠经1%戊巴比妥钠腹腔注射麻醉后,消毒颈部,然后钝性分离大鼠右颈总动脉,用丝线行右颈总动脉永久性结扎,逐层缝合切口。大鼠在室温中恢复2 h后,再而将两组大鼠置于37 ℃的水浴恒温箱中,通入80 mL/L氧气和920 mL/L氮气行缺氧处理2 h,完成HIBD模型后放回母鼠身边喂养。当大鼠苏醒后,于爬行时出现向右转圈,或提尾后右前肢屈曲,提示HIBD模型建立成功。
1.2.2 空白给予假手术处理 仅做右颈处钝性分离和切口缝合,不做右颈总动脉结扎和缺氧处理,术后予等体积等频率生理盐水灌胃,操作结束后放回母鼠身边喂养。分别于造模后6 h、12 h、24 h予ω-3PUFA组、模型组、空白组的亚组大鼠断头处死,死后快速取脑。
1.3 脑组织炎性因子水平检测 大鼠经处死后,取其右侧脑皮质组织约(200±20)mg,用冰9 g/L盐水洗净表面附着的血液,加入无菌生理盐水,置入匀浆器行冰上匀浆,制成100 g/L的匀浆液。将匀浆液在4 ℃条件下以3 000 r/min离心10 min,取上清保存于-80 ℃冰箱中待检。采用ELISA法检测IL-6和TNF-α水平,试剂盒购自美国Adlitteram Diagnostic Laboratories公司,操作遵说明书。
1.4 脑组织氧化因子水平检测 脑组织匀浆液制备方法同上,采用黄嘌呤氧化酶法检测SOD水平,用硫代巴比妥酸法检测MDA水平。试剂盒购自南京建成生物工程研究所,操作遵说明书。
1.5 脑组织含水量检测 大鼠经处死后,取其右侧脑皮质组织约(200±20)mg,采用干湿比重法检测脑组织含水量。用已知重量的锡纸包裹脑组织样本,在电子分析天平上获得称重结果后减去锡纸重量,得到湿重。再将锡纸与样本共同放入60 ℃电热烘干箱中24 h后称重,减去锡纸重量后获得干重,此后每6 h重复测量1次干重,直至前后两次获得的干重值差值不超过0.1 mg。脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.6 脑细胞凋亡率检测 大鼠经处死后,取其右侧脑皮质组织约(100±20)mg,经PBS清洗后除去PBS,剪碎脑组织,再用PBS清洗后除去PBS。加入0.4%胰蛋白酶3.0 mL,置于37 ℃水浴箱中30 min,然后除去胰蛋白酶,用PBS清洗后吸净PBS。加入PBS 3.0 mL反复吹打1 min,制成单细胞悬液,过滤后离心5 min(1 000 r/min),去上清液,加入红细胞裂解液3 mL,振荡后离心10 min(1 200 r/min),重复2次,去上清液。加190 μL Bing buffer液摇匀,用5 μL Annexin V染色,再加5 μL碘化丙啶染色。试剂盒购自北京宝赛生物技术有限公司,应用流式细胞仪(美国Thermo公司产)检测脑组织凋亡情况,操作遵说明书。
1.7 脑组织H&E染色病理检测 大鼠经处死后,取其右侧脑皮质组织约100 mm3加入多聚甲醛进行固定,石蜡包埋切片,厚度5~8 μm,组织切片依次经二甲苯脱蜡、梯度酒精覆水、H&E染液染色、梯度酒精脱水、二甲苯透明,最后中性树脂封片,在光学显微镜下检测拍照。
1.8 脑组织免疫组化检测 大鼠经处死后,取其右侧脑皮质组织约100 mm3加入多聚甲醛进行固定,石蜡包埋切片,厚度5~8 μm,组织切片经65 ℃烤片、二甲苯脱蜡、梯度酒精水化、抗原修复、封闭、一抗孵育、二抗孵育、DAB显色、苏木素复染、梯度酒精脱水、二甲苯透明,最后中性树脂封片,光学显微镜观察染色结果,并拍照记录。
1.9 统计学方法 采用SPSS 25.0版统计学软件分析,计量资料等采用均数±标准差(x-±s)表示,计数资料用[(n)%]表示。三组间比较采用方差分析两两比较采用Bonferroni法,两两比较时采用校正P值即P<0.017。以P<0.05表示差异有统计学意义。
2 结 果
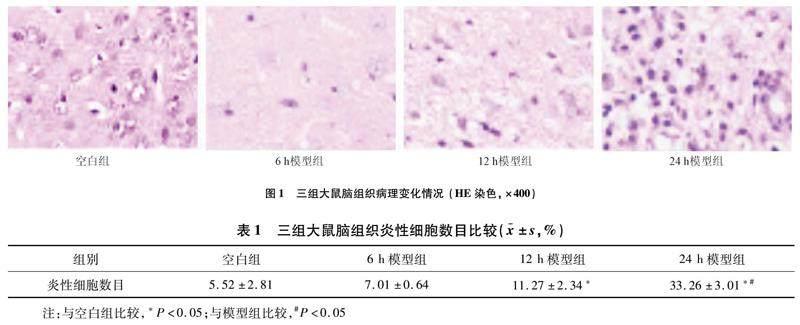
2.1 空白组和模型组大鼠脑组织HE染色病理变化比较 与空白组相比,12 h与24 h模型组大鼠脑组织炎性细胞数目显著高于空白组(图1),差异有统计学意义(P<0.05)。见表1。以上结果表明该模型构建成功。
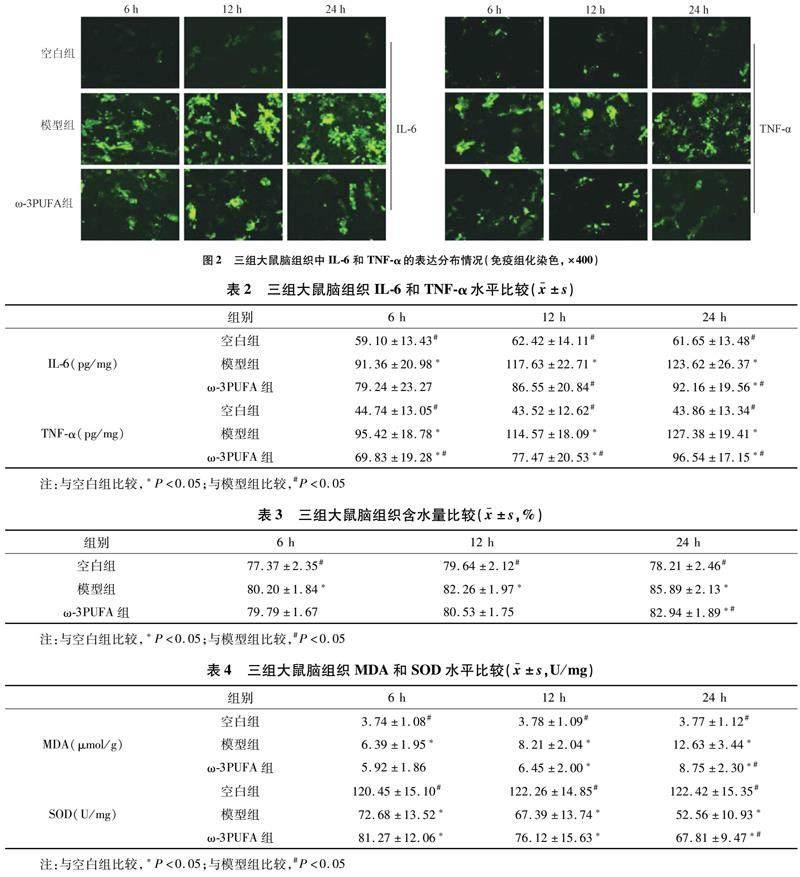
2.2 三组大鼠脑组织炎症因子水平比较 三组大鼠脑组织免疫组化结果显示,IL-6及TNF-α在模型组脑组织中表达显著增加,而ω-3PUFA组表达则显著减少(图2)。在不同时间点,三组IL-6和TNF-α水平比较差异均有统计学意义(F=40.098,91.956;均P<0.01);在不同时间点,模型组IL-6和TNF-α水平均高于空白组(均P<0.017);在12 h和24 h时ω-3PUFA组IL-6水平低于模型组(均P<0.017);在不同时间点,ω-3PUFA组TNF-α水平均低于模型组,高于空白组(均P<0.017),见表2,Elisa結果与免疫组化结果相符。
2.3 三组大鼠脑组织含水量比较 不同时间点三组大鼠脑组织含水量比较差异均有统计学意义(F=67.845,P<0.01);不同时间点,模型组脑组织含水量均高于空白组(P<0.017);在24 h时,ω-3PUFA组脑组织含水量低于模型组,高于空白组(均P<0.017),见表3。
2.4 三组大鼠脑组织氧化因子水平比较 三组不同时间点MDA和SOD水平比较差异均有统计学意义(F=71.763,138.039;均P<0.01);不同时间点模型组MDA水平均高于空白组,SOD水平均低于空白组(均P<0.017);24 h时,ω-3PUFA组MDA水平低于模型组,高于空白组(均P<0.017),ω-3PUFA组SOD水平高于模型组,低于空白组(均P<0.017),见表4。
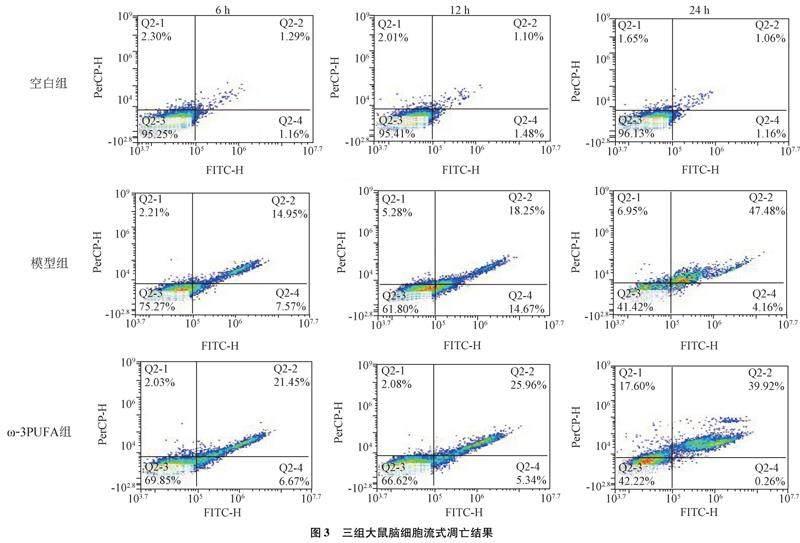
2.5 三组大鼠脑细胞凋亡率比较 三组大鼠脑组织的流式细胞凋亡结果显示,三组不同时间点脑细胞凋亡率比较差异有统计学意义(F=305.179,P<0.01);在不同时间点,模型组和ω-3PUFA组脑细胞凋亡率均高于空白组(P<0.017);24 h时,ω-3PUFA组脑细胞凋亡率低于模型组(P<0.017),见图3、表5。
3 讨 论
HIBD发病急、预后差、病死率高,是引起新生儿急性死亡和慢性神经系统功能损伤的主要原因之一[11-12]。目前亚低温治疗等对症支持措施是HIBD的主要救治手段,但即使经过正规治疗,仍有相当部分患儿死亡或遗留永久性神经系统损伤(如智能发育障碍、认知障碍、发育迟缓、癫痫等)[13-14],可见寻找更多有效的保护神经元策略至关重要。先前有研究报道,ω-3PUFA在缺血性脑卒中、缺血性脑损伤、缺血性视神经病变等动物模型中均呈现出不同程度的抗氧化和抗炎作用[15-16],ω-3PUFA对神经元的这种保护作用提示其或在HIBD中发挥良好治疗效果,由此本研究对HIBD大鼠模型应用ω-3PUFA,观察其效。
炎症反应是HIBD的重要环节之一,活化的中性粒细胞、小胶质细胞、巨噬细胞等炎性细胞将释放炎性因子,破坏血脑屏障,引起脑水肿,导致神经元变性和坏死[17]。本研究中,在12 h和24 h时,ω-3PUFA组IL-6水平低于模型组,在不同时间点ω-3PUFA组TNF-α水平均低于模型组,高于空白组。HIBD建成后根据不同亚组实验结果可观察到,大鼠脑组织炎性因子水平和含水量在6 h、12 h、24 h后渐渐增多,而应用ω-3PUFA的大鼠IL-6、TNF-α水平以及脑水肿程度在部分时间点较模型组少。说明随着时间的延长,HIBD大鼠的炎症反应逐渐加重,ω-3PUFA在缓解HIBD炎症程度上具有一定作用。Giacobbe等[18]报道ω-3PUFA是神经发育所必需的营养物质,同时也是脑神经元细胞膜中几种成分的前体,其能改变钙离子通道和细胞信号转导通路功能,如MAPK、P38、JNK信号通路,进而调控炎性因子基因的表达水平。由此可以进一步推测,ω-3PUFA在HIBD大鼠模型中的抗炎症反应机制或许与影响相关信号通路有关。Trépanier等[19]分析61篇研究得出,ω-3PUFA在创伤性脑损伤、神经病理性疼痛、脂多糖诱导脑损伤、脊髓损伤等动物模型中,均呈现出抗神经炎症的特性,一定程度支持了本研究的结论,但本研究未详细挖掘相关机制,有望在后续的研究中进行拓展。
缺血缺氧状态可产生大量活性氧,使中枢神经系统中氧化系统和抗氧化系统平衡紊乱,最终导致神经元凋亡。未成熟的中枢神经系统抗氧化能力有限,因此具有更高的细胞凋亡率。本研究中,24 h时ω-3PUFA组MDA水平低于模型组,高于空白组,ω-3PUFA组SOD水平高于模型组,低于空白组。SOD是氧自由基清除系统中的抗氧化酶,MDA是氧化应激反应中脂质过氧化的产物,二者水平反映了氧化应激对机体的损伤程度。对HIBD大鼠模型应用ω-3PUFA可减少MDA的增多,缓解SOD的减少,改善了氧化反应程度,说明ω-3PUFA还可在抗氧化应激方面上减少HIBD时的脑组织损伤。不仅如此,在其他原因导致的神经系统损伤中,ω-3PUFA也表现出了抗氧化应激作用:Bi等[20]报道对脊髓损伤大鼠补充ω-3PUFA可降低缺血再灌注诱导的氧化应激、细胞凋亡、炎症的程度,ω-3PUFA对脊髓神经元具有保护作用;Shi等[21]应用脂多糖诱导新生大鼠海马组织发生炎症反应和氧化应激,再予大鼠ω-3PUFA,观察到ω-3PUFA可升高海马组织中SOD和谷胱甘肽活性,降低MDA和氧化型谷胱甘肽含量,减少脂多糖对神经元的氧化作用。然而当前关于ω-3PUFA在HIBD中的抗氧化作用的研究尚不多见,有待更多证据证实具体途径。
凋亡是细胞生理性、自主性的死亡程序,相关研究表明,缺氧缺血状态引发神经元的死亡主要是由凋亡反应引起。本研究中,在24 h时ω-3PUFA组脑细胞凋亡率低于模型组,说明ω-3PUFA能减少脑细胞的凋亡。ω-3PUFA减少HIBD大鼠脑细胞凋亡率的机制尚不明确,可能与其能减轻炎症反应和氧化应激程度有关。Chen等[22]报道ω-3PUFA能抑制创伤性脑损伤大鼠的脑组织小胶质细胞活化和炎性因子表达,进而减少脑水肿和神经元凋亡。该研究基于创伤性脑损伤大鼠模型,从减少炎症反应的角度解释了ω-3PUFA减少脑细胞凋亡的作用,与本研究所用的HIBD模型不同,但都提示了ω-3PUFA对减少神经细胞损伤的正性作用。另外,该研究中还提到ω-3PUFA可抑制创伤性脑损伤引起的天冬氨酸特异性半胱氨酸蛋白酶(Cleaved caspase-3)和凋亡相关基因Bax蛋白的表达量以发挥保护神经元的作用,这可能是ω-3PUFA减少神经元凋亡的机制之一。
综上,ω-3PUFA可减轻HIBD新生大鼠的脑水肿程度,改善脑组织损伤情况,未来可能成为HIBD治疗的新兴策略。
[参 考 文 献]
[1]Lan XB,Wang Q,Yang JM,et al.Neuroprotective effect of Vanillin on hypoxic-ischemic brain damage in neonatal rats[J].Biomed Pharmacother,2019,118(10):109196.
[2]李濛,张丙宏.新生儿缺氧缺血性脑损伤相关血清学标志物研究进展[J].中华新生儿科杂志,2018,33(5):388-392.
[3]Bratek E,Ziembowicz A,Salinska E.N-Acetylaspartylglutamate(NAAG) pretreatment reduces hypoxic-ischemic brain damage and oxidative stress in neonatal rats[J].Antioxidants(Basel),2020,9(9):877.
[4]黄文卿,张巍,刘巍巍.新生儿缺氧缺血性脑病相关药物治疗的研究进展[J].医学综述,2020,26(22):4457-4461.
[5]Jiang W,Guo M,Gong M,et al.Vitamin a bio-modulates apoptosis via the mitochondrial pathway after hypoxic-ischemic brain damage[J].Mol Brain,2018,11(1):14.
[6]Wojdasiewicz P,Poniatowski A,Turczyn P,et al.Significance of omega-3 fatty acids in the prophylaxis and treatment after spinal cord injury in rodent models[J].Mediators Inflamm,2020,2020(7):3164260.
[7]Chang JPC,Su KP,Mondelli V,et al.Omega-3 polyunsaturated fatty acids in youths with attention deficit hyperactivity disorder:a systematic review and meta-analysis of clinical trials and biological studies[J].Neuropsychopharmacology,2018,43(3):534-545.
[8]Zhang WT,Zhang H,Mu HF,et al.Omega-3 polyunsaturated fatty acids mitigate blood-brain barrier disruption after hypoxic-ischemic brain injury[J].Neurobiol Dis,2016,91(2):37-46.
[9]蘆玲,白琳,兰玉怀,等.高压氧联合ω-3多不饱和脂肪酸对急性肺损伤大鼠TLR4/NF-κB信号通路的影响[J].中华航海医学与高气压医学杂志,2019,26(4):303-306.
[10]Zaitoun IS,Sheibani N.Hypoxic-ischemic encephalopathy:impact on retinal neurovascular integrity and function[J].J Ophthalmic Vis Res,2021,16(3):317-319.
[11]Lv Y,Sun B,Lu XX,et al.The role of microglia mediated pyroptosis in neonatal hypoxic-ischemic brain damage[J].Biochem Biophys Res Commun,2020,521(4):933-938.
[12]苟知贤,鲁利群.褪黑素治疗新生儿缺氧缺血性脑损伤的研究进展[J].成都医学院学报,2018,13(6):759-762.
[13]叶莉娜,张乐.干扰素调控因子4对缺氧缺血性脑病新生大鼠炎症反应及血脑屏障功能的影响[J].陕西医学杂志,2020,49(11):1375-1378.
[14]Tatsumi Y,Kato A,Sango K,et al.Omega-3 polyunsaturated fatty acids exert anti-oxidant effects through the nuclear factor(erythroid-derived 2)-related factor 2 pathway in immortalized mouse Schwann cells[J].J Diabetes Investig,2019,10(3):602-612.
[15]Ferdouse A,Leng S,Winter T,et al.The brain oxylipin profile is resistant to modulation by dietary n-6 and n-3 polyunsaturated fatty acids in male and female rats[J].Lipids,2019,54(1):67-80.
[16]Yang R,Zhang MQ,Xue Y,et al.Dietary of n-3 polyunsaturated fatty acids influence neurotransmitter systems of rats exposed to unpredictable chronic mild stress[J].Behav Brain Res,2019,376(12):112172.
[17]Wu GJ,Chen ZH,Wang PP,et al.Hydrogen inhalation protects hypoxic-ischemic brain damage by attenuating inflammation and apoptosis in neonatal rats[J].Exp Biol Med(Maywood),2019,244(12):1017-1027.
[18]Giacobbe J,Benoiton B,Zunszain P,et al.The anti-inflammatory role of omega-3 polyunsaturated fatty acids metabolites in pre-clinical models of psychiatric,neurodegenerative,and neurological disorders[J].Front Psychiatry,2020,11(2):122.
[19]Trépanier MO,Hopperton KE,Orr SK,et al.N-3 polyunsaturated fatty acids in animal models with neuroinflammation:an update[J].Eur J Pharmacol,2016,785(8):187-206.
[20]Bi JQ,Chen C,Sun PY,et al.Neuroprotective effect of omega-3 fatty acids on spinal cord injury induced rats[J].Brain Behav,2019,9(8):e01339.
[21]Shi JP,Wang WW,Sang GM,et al.Short term usage of omega-3 polyunsaturated fatty acids ameliorate lipopolysaccharide-induced inflammatory response and oxidative stress in the neonatal rat hippocampal tissue[J].Front Nutr,2020,7(11):572363.
[22]Chen XR,Wu SK,Chen CN,et al.Omega-3 polyunsaturated fatty acid supplementation attenuates microglial-induced inflammation by inhibiting the HMGB1/TLR4/NF-κB pathway following experimental traumatic brain injury[J].J Neuroinflammation,2017,14(1):143.
(收稿2021-12-27 修回2022-02-05)
