不同水温对5 个品系黑鲷抗氧化和免疫因子的影响
2023-04-28倪可雯孙瑞健徐大凤于雯雯周堂建陈淑吟
倪可雯,孙瑞健,徐大凤,于雯雯,周堂建,陈淑吟*
(1.水产科学国家级试验教学示范中心,上海海洋大学,上海 201306;2.江苏省海洋水产研究所,江苏 南通 226007)
水温是开展鱼类人工养殖必须监测的指标[1-3],直接影响着鱼类生长发育。水温变化易引起鱼体的生理应激反应[4-5],导致体内活性氧(ROS)过量产生,造成机体损伤[6-8]。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等是水生动物清除ROS 的关键酶类[9-10],鱼类通过提高这些抗氧化酶活力来应对包括水温胁迫在内的外部压力,因而这些酶活的变化,可反映鱼类机体受损或应对胁迫的情况[11]。在对中华鲟(Acipenser sinensis)[12]、四指马鲅(Eleutheronematetradactylum)[13]、云纹石斑鱼(Epinephelusmoara)[14]等鱼类的研究中发现,温度变化超过一定范围,均显著影响鱼的SOD、CAT 等抗氧化酶活性。碱性磷酸酶(AKP)、血清溶菌酶(LZM)等是鱼类重要的免疫相关酶[15]。河豚(Takifugu obscurus)在水温25 ℃降至13 ℃过程中,AKP 活性显著降低[16];不同品系罗非鱼(Oreochromis mossambicus)在水温26 ℃降至20 ℃过程中,LZM 活性显著上升,且不同品系间的酶活变化存在差异[17]。这些酶活水平的变化态势,直接反映了鱼体对水温变化的适应能力及物种特异性。因此,研究水温胁迫下鱼类相关酶活指标的变化,对实际生产具有指导作用。
黑鲷(Acanthopagrus schlegelii)隶属于鲷科(Sparidae),棘鲷属(Acanthopagrus),俗称黑加吉、黑立,是我国南北沿海均可养殖的重要海水经济鱼类[18]。黑鲷作为沿岸性鱼类,有着较广的适温范围[19],但在长江以北养殖时,仍无法在室外越冬,须移入室内。此外,近年来极端高温天气频发,影响着鱼类的正常生长[20]以及产业的健康发展[21]。黑鲷适温范围广,是优良新种质创制的重要性状指标。为此开展了不同水温对不同选育品系黑鲷肝脏抗氧化及免疫因子的影响试验,以期为黑鲷养殖技术提升和新品系选育研究等提供基础数据。
1 材料与方法
1.1 试验材料
试验用鱼来自江苏省海水增养殖技术与种苗中心。5 个黑鲷品系分别为选育系1(XY1),体长均值为(9.68.±0.70)cm,体质量均值为(35.15±8.43)g;选育系2(XY2),体长均值为(10.14±1.35)cm,体质量均值为(39.65±12.94)g;山东群体选育系(XY3),体长均值为(10.89±1.13)cm,体质量均值为(47.90±13.30)g;福建野生群体子一代(YS),体长均值为(10.01±1.16)cm,体质量均值为(36.24±10.67)g;黑鲷♀×真鲷♂杂交子二代新品系(HF2),体长均值为(9.92±0.57)cm,体质量均值为(33.36±5.08)g。
1.2 试验方法
设置降温组和升温组,其中降温组温度梯度为17(对照组),13,9 和5 ℃;升温组温度梯度为26(对照组),30,34 和38 ℃。每组再根据放养的品系分为5 个黑鲷品系组(XY1、XY2、XY3、YS 和HF2)。各组均设置3 个平行,每个平行分别放养试验鱼30 尾,养殖条件一致。
各试验组在对照组温度下暂养一周后取样并开始试验,在达到设置温度养殖12 h 后,随机取3 尾鱼肝脏,迅速放入液氮,后移至-80 ℃冰箱保存,用于酶活性测定。总超氧化物歧化酶(T-SOD)、CAT、LZM 和AKP 等酶活性检测所用试剂盒,均购自南京建成生物工程研究所,试验操作严格参照说明书。
1.3 数据处理
采用Excel2019 软件对试验数据进行处理,结果以(平均值±标准差)表示。采用SPSS19 统计软件对试验鱼存活及酶活性的影响进行单因素方差分析(One-way ANOVA),通过Duncan 法比较组间差异,若P<0.05,则为差异显著。
2 结果与分析
2.1 不同水温5 个品系黑鲷存活率
水温为9~34 ℃时,5 个品系的存活率均超过90%;其中13~26 ℃是黑鲷最适温度,各品系的存活率接近100%;水温为5 ℃时,品系的存活率有所下降,均低于90%;水温为38 ℃时,各品系黑鲷存活率均较低,其中存活率最高的HF2品系,也仅为16.9%,YS 品系存活率则最低(表1)。

表1 不同温度黑鲷5 个品系存活率 %
2.2 不同水温5 个品系黑鲷肝脏T-SOD 酶活性
降温组中,水温为17 ℃时,5 个品系黑鲷肝脏T-SOD 酶活性没有明显差异(P>0.05)。随着水温下降,XY1、XY2 和YS 的T-SOD 酶活性先升后降,其中XY1、XY2 在9 ℃时酶活水平达到最大值,YS 品系在13 ℃时酶活水平达到最大值。XY3和HF2的T-SOD 酶活性则表现为随着水温下降而逐渐升高。XY3 和HF2在水温为5 ℃时,TSOD 酶活性显著高于XY1 和YS(P<0.05),见图1(a)。
升温组中,随着水温升高,5 个品系黑鲷肝脏T-SOD 酶活性均呈现先上升后下降的趋势,在水温为30 ℃时均达到最大值,且显著高于其他温度组(P<0.05)。就不同品系黑鲷而言,在相同水温下,5 个品系黑鲷肝脏T-SOD 酶活性有所差异。其中在水温为26 ℃时,XY3 的T-SOD 酶活性显著高于其余4 个品系(P<0.05),在水温为30 和34 ℃时,XY3 和HF2的T-SOD 酶活性均显著高于其他3 个品系(P<0.05);在水温为38 ℃时,XY3的T-SOD 酶活性显著高于另4 个品系(P<0.05),见图1(b)。
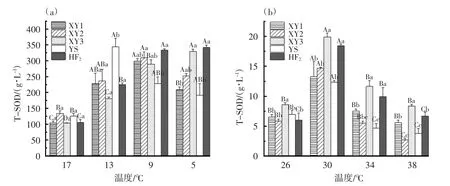
图1 不同水温5 个品系黑鲷肝脏酶T-SOD 活性
2.3 不同水温5 个品系黑鲷肝脏CAT 酶活性
降温组中,5 个品系黑鲷肝脏CAT 酶活性均呈先上升后下降的趋势。在水温为9 ℃时,各品系CAT 酶活性均达到最大值,且均显著高于对照组(P<0.05),其中XY2 的CAT 酶活性最高,且显著高于XY1、XY3 和HF2(P<0.05),XY3 的CAT 酶活性最低,且显著低于其他4 个品系(P<0.05)。水温降至5 ℃时,各品系CAT 酶活性出现降低,但显著高于对照组(P<0.05),见图2(a)。

图2 不同水温5 个品系黑鲷肝脏酶CAT 活性
升温组中,5 个品系黑鲷肝脏CAT 酶活性随水温升高也呈现先上升后下降的趋势。除了YS 的CAT 酶活性在水温为30 ℃时最高,其余4 个品系CAT 酶活性均在水温为34 ℃时最高。水温升之38 ℃时,5 个品系的酶活性均出现较大降幅,除了HF2外,其余品系CAT 酶活性均最低,见图2(b)。
2.4 不同水温5 个品系黑鲷肝脏AKP 酶活性
降温组中,随水温的降低,5 个品系黑鲷肝脏AKP 酶活性的变化趋势有所不同。其中XY1、XY2和YS 的AKP 酶活性呈先升高后降低的趋势,且均在水温为9 ℃时最高,水温为17 ℃时最低。XY3和HF2则呈升高趋势,且均显著高于对照组(P<0.05)。在水温为17,13 和9 ℃时,不同品系黑鲷肝脏AKP 酶活性差异不显著,在水温为5 ℃时,XY3 的AKP 酶活性最高,显著高于XY2 和YS,见图3(a)。
升温组中,随水温的升高5 个品系黑鲷肝脏AKP 酶活性均呈现先升高后降低的趋势,其中XY1、XY2 和XY3 的AKP 酶活性均在34 ℃时最高,YS 和HF2的AKP 酶活性均在30 ℃时最高。在对照组中,XY2 的AKP 酶活性最高,与YS 和HF2差异显著(P<0.05),与XY1 和XY3 差异不显著(P>0.05),见图3(b)。
2.5 不同水温5 个品系黑鲷肝脏LZM 酶活性
降温组中,随水温的下降,5 个品系黑鲷肝脏LZM 酶活性均呈先上升后下降的趋势,其均在水温为13 ℃时最高,且差异显著(P<0.05),在水温为5 ℃时最低。同一温度下,5 个品系黑鲷肝脏LZM 酶活性均有所差异,但没有明显趋势,见图4(a)。
升温组中,随水温的升高,YS 的LZM 酶活性先升高后降低,其余4 个品系则均呈上升趋势。YS 的LZM 酶活性在水温为30 ℃最高,但其随水温的升高下降不显著(P>0.05)。其余各品系在水温为38 ℃最高,且显著高于对照组(P<0.05)。同一温度下,5 个品系黑鲷肝脏LZM 酶活性均有所差异,但没有明显趋势,见图4(b)。

图4 不同水温5 个品系黑鲷肝脏酶LZM 活性
3 讨论
3.1 温度变化对5 个品系黑鲷T-SOD 和CAT 活性的影响
鱼类体温每改变1 ℃,其体内的许多生理过程的效率会改变6%~10%[22]。温度变化影响到鱼体内的各种代谢,包括肝脏的抗氧化体系[23-24]。抗氧化酶活性的变化在一定程度上可反映鱼体的生理状况,可作为衡量鱼类对外界环境适宜程度的重要生理指标[25]。SOD 是生物体内清除氧自由基(ROS)的首要物质,能催化超氧阴离子转化为H2O2和O2的反应。CAT 是清除H2O2的酶,与SOD 协同维持生物体内氧自由基含量的稳定平衡[26]。正常情况下,鱼类面临温度胁迫时,通过调控升高体内SOD 和CAT 酶活性,对抗与阻断因应激导致的氧自由基增加,以抵抗不良环境[27]。黄姑鱼(Nibeaalbiflora)[28]、卵形鲳鲹(Trachinotusovatus)[29]、虹鳟(Oncorhynchus mykiss)及硬头鳟(Steelhead, Salmon Gairdneri)[30]等体内的SOD 和CAT 等抗氧化酶活性,在受到水温变化的胁迫时,均显著升高。环境胁迫超过机体的承受能力时,酶活性则不仅无法再升高,而且还会出现下降趋势,如白梭吻鲈(Sander lucioperca)在36 ℃时,其SOD 及CAT 活性开始下降[31];大口黑鲈(Micropterus salmoides)在31 ℃时CAT 活性开始下降[32]。
本试验降温组中,XY3 和HF2的T-SOD 酶活性随水温的降低逐渐升高,其余品系则呈现先升高后降低的趋势。其中,YS 的T-SOD 酶活性在13 ℃时达到最大值,XY1 和XY2 在9 ℃时T-SOD 活性值最大。因此,XY3 和HF2在5 ℃时能较好地适应,且其耐受更低水温。CAT 酶活性的变化与T-SOD有所不同及滞后,各品系均在9 ℃时达到最大酶活。水温为5 ℃时,5 个品系的T-SOD 和CAT 酶活性均高于对照组,且存活率均>80%,因此5 个品系在水温为5 ℃时均有较强耐受能力。
升温组中,水温升高到30 ℃时,5 个品系T-SOD酶活性均达到最大值,XY2 和YS 的CAT 酶活性也达到最大值。因此,若水温继续升高,这2 个品系抗氧化酶活性将不能提高,进而消除ROS 增加所带来的损伤。XY1、XY3 和HF2的CAT 酶活性则在34 ℃达到最大值。水温升至38 ℃后,各品系死亡率均急剧上升,均超过80%,该水温下T-SOD 和CAT 酶活性也均出现大幅下降。一般而言,酶促反应的适温范围要大于鱼类正常的生存温度范围[22],因此,认为34 ℃水温已是大部分黑鲷的承受极限。但各品系中均有部分个体可耐受38 ℃水温,其中XY3 和HF2存活率高于其他品系。
3.2 温度变化对5 个品系黑鲷AKP 和LZM 活性的影响
AKP 是生物体免疫功能和健康状况的参考指标[33],也是评价动物生理代谢水平的一项重要参数[34]。本试验的降温组中,随着水温的降低,XY3 和HF2的AKP 酶活性逐渐升高,其余3 个品系则呈先升高后降低的趋势,且均在水温为9 ℃时最高,水温为17 ℃时最低。升温组中,随水温的升高,5 个品系AKP 酶活性均呈现先升高后降低的趋势。在美洲黑石斑(Centropristis striata)幼鱼[35]、施氏鲟(Acipenser Schrenckii)[36]和双带隐带丽鱼(Apistogramma bitaeniata)[37]等鱼类的研究中,也得出相似的AKP 酶活性变化趋势。水温达到38 ℃后,试验鱼大量死亡,各品系AKP 酶活性均有下降,这与花(Hemibarbus maculatus)[38]研究结果相似;此时XY3 和HF2的AKP 酶活性显著高于其他品系,因此,这2 个品系的高温耐受性相对较强。
LZM 是衡量水生动物免疫状态的一个重要指标[39]。在环境胁迫条件下,鱼类通过升高溶菌酶活性做出免疫防御[40]。大西洋庸鲽(Hippoglossus hippoglossus L.)[41]、大菱鲆(Scophthalmus maximus)[42]和虹鳟(Oncorhynchus mykiss)[43]等鱼类的研究均表明,温度影响着鱼体的LZM 酶活性。本试验降温组中,随水温的下降,5 个品系黑鲷肝脏LZM 酶活性均呈先上升后下降的趋势,其均在水温为13 ℃时最高,且差异显著(P<0.05),在水温为5 ℃时最低。因此推测,低温对幼鱼机体的免疫力产生了抑制作用。史氏鲟[44](Acipenser schrenckii)幼鱼急性低温胁迫试验中也有类似结论。
升温组中,随水温的升高,YS 的LZM 酶活性先升高后降低,水温为30 ℃最高,但其随水温的升高其下降不显著(P>0.05),其余4 个品系则均呈上升趋势。其余各品系在水温为38 ℃时,YS 和LZM酶活性最高,且显著高于对照组(P<0.05)。这与大菱鲆温度胁迫下LZM 酶活性变化态势相似[45]。此外,水温为30 ℃时,YS 的LZM 酶活性达到最高值,XY3 和HF2的酶活性显著高于XY1 和XY2。LZM 酶活性的这种变化趋势也很好地解释了升温过程中,YS 最早出现大批量死亡,而XY3 及HF2存活率最高的现象。
酶活性表达与变化水平反映了5 个品系黑鲷应对温度应激时,体内免疫水平及其器官机能状态以及应对水温变化的能力。HF2在升温和降温组中均有良好的抗逆性,这与其在养殖过程中的性状优势表现相一致[46]。
4 结论
试验结果显示,在水温为5~34 ℃时,5 个品系黑鲷存活率均>84%。T-SOD 等酶活性反映出不同品系黑鲷对水温的上升或下降的适应水平与抗逆性存在差异,而且同一品系对高温或低温的酶活性变化也有不同。其中,对水温变化的耐受能力最高的为XY3 和HF2,其次为XY1 和XY2,YS 最低。XY3 选育新品系及由杂交得到的HF2新品系面对高温或低温的胁迫均有较好表现。
