二甲基亚砜对海带配子体克隆低温冻存的影响
2023-04-28钱瑞罗世菊李晓捷赛珊赵聚萍王利芹
钱瑞,罗世菊,李晓捷,赛珊,赵聚萍,王利芹
(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻与海参技术创新中心,山东省海藻遗传育种与栽培技术重点实验室,山东 烟台 264003)
海带属(Saccharina)褐藻,具有异型世代交替生活史,包括二倍性孢子体世代和单倍性配子体世代。在自然界中,海带配子体一般只存活14 d 左右。20 世纪70年代末,方宗熙等[1]发现,在人工培养条件下, 雌、雄配子体都能形成无性繁殖系(克隆),并能产生配子。海带配子体克隆技术的建立,对海带种质保存、配子体克隆育苗、育种及遗传学研究,具有极其重要的意义。
海带种质保存,通常采用低温弱光液相保存法,以维持配子体的基础代谢。若温度、光照、营养盐等适宜,配子体则很快进入生长状态,可满足育苗、育种及研究需要。但液相保存一般需15 d更新一次培养液,频繁操作,增加了种质污染及混杂的可能[2],并且随着海带保存规模的扩大,种质库需要更大的空间,人力物力成本随之增加。海带配子体-196 ℃液氮冷冻保存技术及-80 ℃冷冻保存技术的开发[3-5],可有效弥补液相保存技术的一些缺陷,特别是-80 ℃冷冻保存技术操作简单,降低克隆污染可能性的同时,对保种空间需求更小。-80 ℃冻存海带配子体克隆,所有克隆系均能成功保存,但每个克隆系配子体细胞存活率相对较低。现开展了不同浓度二甲基亚砜冷冻保护液对海带配子体克隆低温保存的试验。
1 材料与方法
1.1 试验材料
10 个品种(系)海带克隆系(编号为A—J),每个品种(系)雌、雄配子体克隆系各取1 个(雌性编号1、雄性编号2),共20 个克隆系(A1—J1,A2—J2),均来自国家海藻与海参工程技术研究中心海藻种质库。培养温度4~10 ℃,光照强度2~5 μmol/(m2·s)。
1.2 试验设计
1.2.1 二甲基亚砜(DMSO)
设置4 个体积分数组(5%,10%,15%和20%)的冷冻保护液,对海带配子体于-80 ℃冻存,观察不同浓度DMSO 对冻存海带配子体克隆的影响。
1.2.2 复苏后配子体
复苏冻存的雌、雄配子体克隆,培养一定量后,按雌、雄质量比2∶1[6]进行发育试验,验证冻存配子体的繁育能力。
1.3 试验方法
1.3.1 克隆细胞段的获得
取适量配子体克隆,玻片压磨后,细胞滤液经筛绢过滤至事先放置盖玻片小片(盖玻片剪切成小片,能放入冻存管)的培养皿中,在4~10 ℃、2~5 μmol/(m2·s)条件下培养7 d,使受损细胞得以修复并附着在盖玻小片上(为便于观察统计复苏后配子体细胞存活率,将配子体细胞附着在玻片上)。
1.3.2 克隆簇状体的预备
从10 个品种(系)中选取色素正常、状态良好、无污染的克隆簇状体做冻存材料,每个克隆系各称取0.010 g,克隆簇状体无须打碎,于-80 ℃直接冻存。
1.3.3 冷冻保护液配制
采用煮沸冷却的海水为基础液,配制5%,10%,15%和20%体积分数的二甲基亚砜冷冻保护液,于0~4 ℃冰箱中存放,备用。
1.3.4 冻存方法
冻存管事先分别加入1 mL 4 种不同体积分数的DMSO 冷冻保护液,做好标记,放入-20 ℃冰柜预冻24 h 后,取出再分别加入存放于0~4 ℃冰箱相同体积分数保护液各0.8 mL,冻存管中DMSO处于冰水混合状态,保持0 ℃,用镊子夹取附着克隆细胞段的盖玻片小片或无水克隆簇状体,分别置入不同的冻存管中,拧紧盖子,放入0~4 ℃冷藏箱平衡30 min。平衡结束,将冻存管于-80 ℃冻存。
1.3.5 复苏方法
将冻存10 d 的冻存管,从-80 ℃低温冰箱快速取出,于38~39 ℃的水浴锅解冻。用镊子将解冻后附有克隆细胞段的盖玻片小片及克隆簇状体取出,分别放入培养皿及锥形瓶中,加低温培养液,经过几次冲洗,去除冷冻保护剂。于4~10 ℃、2~5 μmol/(m2·s)条件下培养;7 d 后置于4~10 ℃、8~10 μmol/(m2·s)条件下培养。
1.3.6 冻存的海带配子体繁育能力
将冻存复苏后培养的同品种(系)雌、雄克隆系,按雌、雄质量比2∶1 的比例,分别取适量克隆系,磨碎后,于细胞滤液过滤至培养皿。培养皿放置在光照强度22~25 μmol/(m2·s)、光周期L∶D=10∶14、温度10~12 ℃条件下培养。
2 结果与分析
2.1 冻存克隆细胞段存活及生长情况
观察克隆细胞复苏后与冷冻前无变化。复苏后培养3 h,克隆细胞逐渐发生质壁分离。复苏后培养第7 天,基本可确定克隆细胞是否存活。相同克隆系10%和15% DMSO 体积分数组的存活率较5%和20%体积分数组高,见图1(a)(b)(c)(d)和图2(a)(b)(c)(d)。观察10%DMSO 对克隆系A2 的影响,培养第17 天,可见细胞新生枝丫,培养第30 天,细胞生长繁茂,见图3(a)(b)(c)(d)。复苏后培养第62 天,存活的细胞长成簇状体,10%和15%体积分数组的克隆簇状体数量明显多于5%和20%体积分数组,见图4(a)(b)(c)(d)。
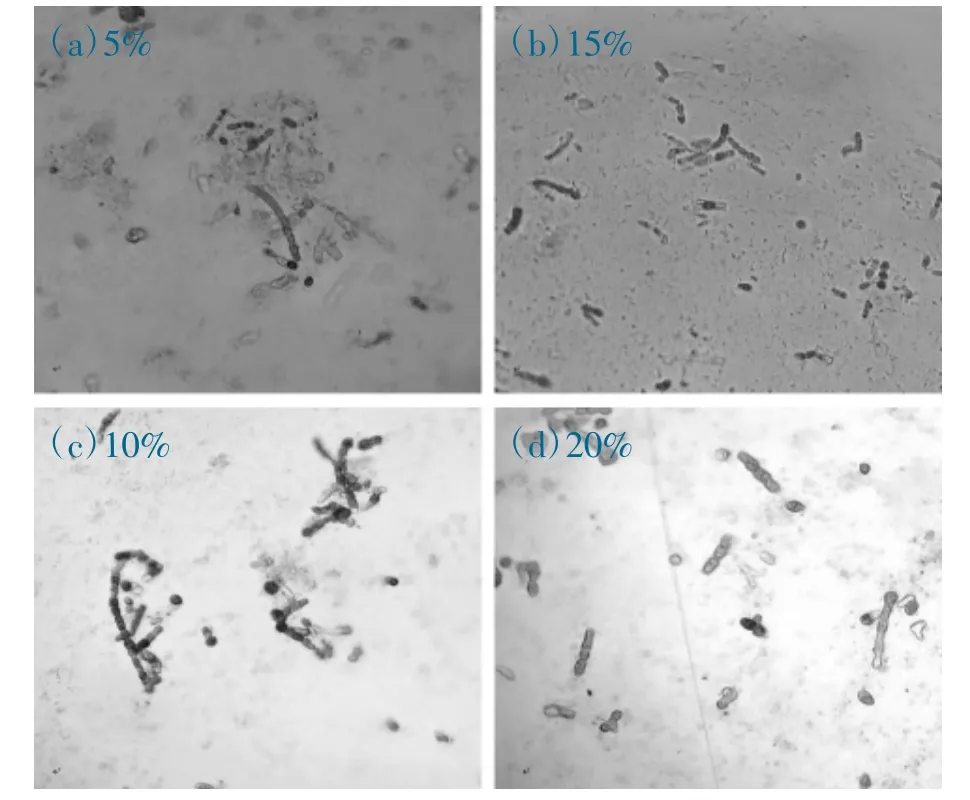
图1 复苏后培养第7 天,克隆系A2 细胞状态(100 倍镜)
2.2 冻存细胞段存活细胞统计
10%和15% DMSO 2 个体积分数组的20 个克隆系全部有存活细胞,10%体积分数组不同克隆系细胞存活率为0.4%~43.2%;15%体积分数组不同克隆系细胞存活率为0.3%~32.9%;5%体积分数组14 个克隆系有存活细胞,不同克隆系细胞存活率为0~9.2%;20%体积分数组只有5 个克隆系有存活细胞,不同克隆系细胞成活率为0~0.9%,见表1。

表1 克隆段复苏后培养7 d 细胞存活率 %
采用同一体积分数DMSO 低温保存海带配子体克隆,10 个品种(系)海带雌配子体存活率均不高于同株雄配子体的存活率(表2),可见海带雄性配子体较雌性配子体有较高的耐受力。

表2 克隆系存活数量占比 %
2.3 冻存的克隆簇状体
2.3.1 10%DMSO 对克隆系B1 的影响
复苏后培养第3 天,在显微镜下观察,海带配子体克隆色素正常,部分细胞色素聚缩;培养第14天,克隆色素变绿,大部分死亡,有少量色素正常的细胞;培养第49 天,存活细胞无性繁殖形成丝状体。培养第84 天,形成簇状体,见图5(a)(b)(c)(d)。

图5 10%DMSO 对克隆系B1 的影响(100 倍镜)
2.3.2 DMSO 4 种体积分数对克隆系D2 的影响
复苏后培养3 天,在显微镜下观察,各体积分数组海带配子体克隆色素正常,部分细胞色素聚缩。5%体积分数组在培养第35 天,发现存活细胞,第50 天,细胞已分裂生长,培养第90 天长,成簇状团,见图6(a)(b)(c)(d)。10%体积分数组,在复苏培养第7 天,发现有存活细胞,培养第15 天,细胞已分裂生长,培养第45 天,大量簇状团出现,见图7(a)(b)(c)(d)。15%体积分数组在复苏后培养第5 天,发现存活细胞,第25 天,细胞分裂生长,培养第50 天,大量簇状团出现,见图8(a)(b)(c)(d)。20%体积分数组复苏后培养第50 天,发现庞大异常的活细胞,培养第80 天,细胞分裂生长,培养第130 天,生长成簇状团,见图9(a)(b)(c)(d)。

图6 5%DMSO 对克隆系D2 的影响(100 倍镜)

图7 10% DMSO 对克隆系D2 的影响(100 倍镜)

图8 15% DMSO 对克隆系D2 的影响(100 倍镜)
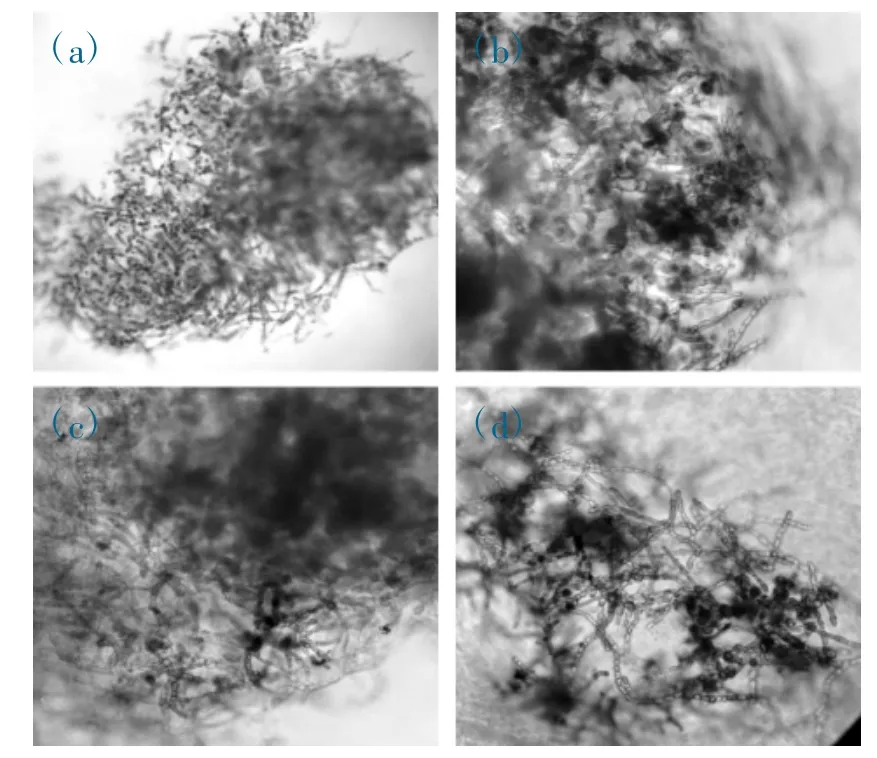
图9 20% DMSO 对克隆系D2 的影响(100 倍镜)
培养观察发现,克隆系D2 复苏后,10%和15%体积分数组的配子体细胞,较5%和20%体积分数组的配子体细胞,恢复生长速度更快。
2.4 统计克隆簇状体存活细胞系
对10 个海带品种(系)雌、雄共20 个克隆系进行冻存,复苏后的克隆系置于温度、光照相同的条件下培养。跟踪观察发现,5%体积分数组有1 个雌克隆系未见存活细胞,10%和15%体积分数组雌、雄所有克隆系均有存活细胞,20%体积分数组有7个雌克隆系未见存活,克隆系存活数量占比见表3。

表3 克隆系存活数量占比 %
2.5 -80 ℃冻存后海带配子体发育试验
对上述10%DMSO 冷冻保护液冻存的同株系雌、雄配子体复苏后进行培养,培养至一定量后,进行发育试验。结果表明,培养第14 天,少量孢子体出现,第21 天,大量孢子体形成,见图10(a)(b)(c)。

图10 冻存复苏后海带配子体发育能力验证(100 倍镜)
为了统计单克隆系的细胞存活率以及便于肉眼观察20 个克隆系的存活情况,采用打碎的细胞段及未打碎的克隆簇状体2 种形式进行试验。试验结果稍有不同,5%和20%DMSO 体积分数组,细胞段克隆系存活比例低于簇状体克隆系存活比例。5%和20%DMSO 体积分数可能不是海带配子体细胞冻存的最适宜体积分数,冻存后细胞存活率低。本试验采用细胞段冻存,为便于计数,细胞段不能重叠,细胞数量有限,可能会出现某克隆系所统计细胞全部死亡的结果;而采用簇状体直接冻存,簇状体细胞数量远大于细胞段细胞数量,簇状体中只要有1 个细胞存活并无性繁殖,该克隆系就会存活,因此,试验发现簇状体克隆系存活比例高于细胞段克隆系存活比例。
3 结论
采用5%,10%,15%,20% 4 种体积分数的DMSO 冷冻保护液,进行海带配子体克隆(细胞段和克隆团),于-80 ℃冻存,经复苏后培养,DMSO各体积分数组均有海带配子体细胞存活,10%和15%体积分数组冻存的所有克隆系均有存活细胞,5%和20%体积分数组仅部分克隆系有存活细胞。对于相同克隆系,10%和15%体积分数组配子体存活率高于5%和20%体积分数组。结果表明,海带配子体冻存可用10%和15%DMSO 作为冷冻保护液。为降低成本,优选10%DMSO作为冷冻保护液,冻存不影响海带配子体繁育能力,其在-80℃冻存复苏后培养,可正常发育为孢子体。
