牛源肝素钠的工艺研究与结构分析
2023-04-20刘力波田志鹏李志敏
刘力波,田志鹏,李志敏
(河北常山生化药业股份有限公司,河北石家庄 050800)
0 引言
肝素钠在临床上,主要用于预防血栓形成和栓塞,以及治疗各种原因引起的弥散性血管内凝血。牛源肝素钠区别于目前最广泛使用的猪源肝素钠,从牛肠黏膜提取。据UNFAO 2013年官方统计数据表明,全球活牛数量(包括家养牛和水牛) 约为17 亿头,而全球活猪数量约为10 亿头[1],牛的数量是猪数量的1.7 倍,牛源肝素钠具有更为广阔的原料来源。牛源肝素粗品含有核酸、蛋白质、硫酸皮肤素和硫酸软骨素等杂质,精制过程主要是对粗品肝素进行去杂质和脱色。国内目前纯化肝素的方法主要采用高锰酸钾氧化法、过氧化氢- 高锰酸钾组合氧化法、过氧化氢二次氧化法[2]。但是,高锰酸钾氧化会在H 谱的2.10 mg/L 处出现一个特征信号峰[3],存在可能不符合药典标准的问题,而且高锰酸钾氧化过程中会产生大量难以过滤的二氧化锰絮状物,工艺操作复杂。而双氧水氧化后分解成水和氧气,是相对清洁的氧化剂。相较于多次氧化,单次双氧水氧化工艺的生产周期短,更为节省物料,有利于企业控制成本。为了通过单次氧化既完成脱色任务,又不会因氧化过强而过多损失收率,这就需要设计正交试验,挑选出最适宜的工艺参数。着重描述了最优氧化工艺的筛选过程,并对精制的牛源肝素钠进行了结构分析。
1 材料和方法
1.1 材料与试剂
牛源粗品肝素,Wegmed 公司提供;肝素钠标准品,中国药品生物制品检定所提供;绵羊血浆,东营博丰生物科技有限公司提供;过氧化氢、氯化钠、氯化钙、盐酸、氢氧化钠和过氧化氢,均为国产分析纯试剂。
1.2 仪器
UV-8000 型紫外- 可见分光光度计,上海元析仪器有限公司产品;DK-98-ⅡA 型恒温水浴锅,天津市泰斯特仪器有限公司产品;PB-10 型PH 计,Sartorius 公司产品;DZF-6210 型真空干燥箱,上海一恒科学仪器有限公司产品;S22-2 型恒温磁力搅拌器,上海司乐仪器有限公司产品;PL602-L 型电子天平,Mettler Toledo 公司产品;JB300-D 型电动搅拌机,上海标本模型厂产品;E2695 型高效液相色谱仪,美国沃特斯公司产品;U3000 型高效液相色谱仪,美国赛默飞公司产品。
1.3 方法
1.3.1 检测方法
肝素钠效价测定采用羊血浆法[4],二糖测定参照Mourier P的方法[5],分子量测定参照Fu L等人[6]的方法。将肝素精品的水溶液进行全波长扫描,发现溶液在400 nm 处有一个吸收峰值,因此将色素的检测波长定为400 nm。
1.3.2 脱色率和效价收率的计算方法
式中:A前、A后——样品脱色前后的吸光度。
式中:M1——氧化前质量,g;
P1——氧化前效价;
M2——氧化后质量,g;
P2——氧化后效价。
1.3.3 单因素试验
取经盐解、高温、离子交换、乙醇沉淀等步骤处理的沉淀物20 g,加纯化水溶解至200 mL,进行氧化步骤;氧化结束后,调药液pH 值为6.0~7.0,加入乙醇使药液乙醇体积分数为70%;乙醇沉淀16 h 后,将沉淀物烘干,对沉淀干燥品进行效价和吸光值检测;分别考查反应温度、反应pH 值、双氧水添加量、反应时间对脱色率和效价收率的影响。
1.3.4 正交试验
将氧化步骤的反应温度、反应pH 值、双氧水加量、反应时间作为影响因素,以脱色率和效价收率为考查指标,设计四因素三水平L9(34)正交试验。
氧化反应条件影响试验正交因素与水平设计见表1。
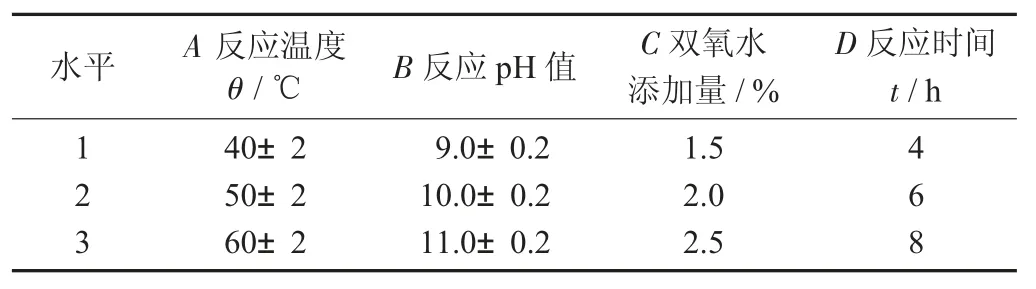
表1 氧化反应条件影响试验正交因素与水平设计
1.3.5 牛源肝素钠制备工艺
工艺首先通过盐解与高温处理将一部分蛋白质与多糖分离;然后用阴离子树脂进行吸附,再用低浓度NaCl 溶液洗涤除去大量蛋白质、核酸,用高浓度NaCl 溶液洗脱得到肝素溶液,并进行乙醇沉淀除去硫酸皮肤素和硫酸软骨素;随后将沉淀物溶解进行氧化,再经乙醇沉淀、冻干,获得效价较高、色泽良好的牛源肝素钠精品。盐解、高温处理、离子交换和乙醇沉淀的工艺步骤与传统的肝素钠生产方法[7]基本一致,冻干的参数采用公司经过验证的参数。
牛源肝素钠制备工艺流程见图1。

图1 牛源肝素钠制备工艺流程
2 结果与分析
控制合适的氧化条件,才能使得色素被充分的去除,而牛源肝素的结构不受影响。根据文献[8-9]报道并结合实际,确定影响脱色率和效价收率的关键参数为反应温度、反应pH 值、双氧水加量、反应时间。
2.1 双氧水加量对脱色率和效价收率的影响
固定反应温度60±2 ℃,反应pH 值10.0±0.2,反应时间6 h,进行不同双氧水添加量对脱色率和效价收率的影响。
双氧水添加量对脱色率和效价收率的影响见图2。
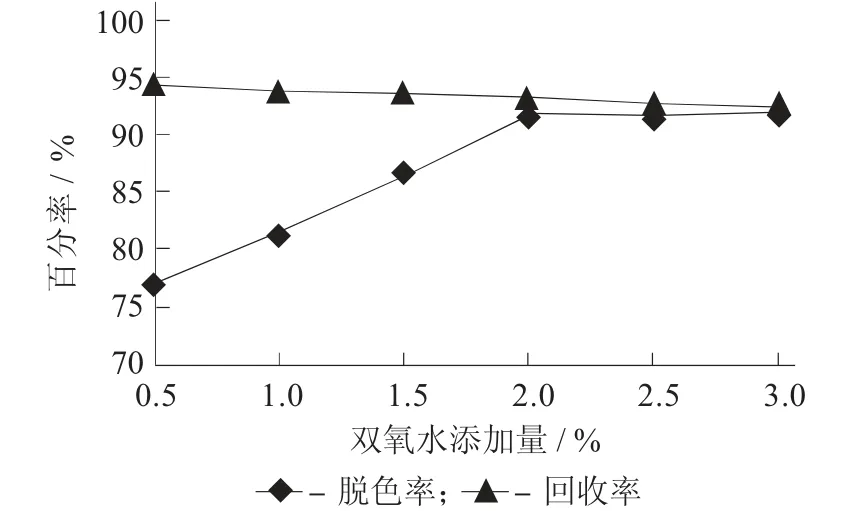
图2 双氧水添加量对脱色率和效价收率的影响
由图2 可知,双氧水添加量达到2%后,脱色率达到顶点,而效价收率随着添加量升高缓慢下降,2%是一个较优的双氧水添加量。
2.2 反应温度对脱色率和效价收率的影响
固定反应pH 值10.0±0.2,双氧水添加量2%,反应时间6 h,进行不同反应温度对脱色率和效价收率的影响。
反应温度对脱色率和效价收率的影响见图3。

图3 反应温度对脱色率和效价收率的影响
由图3 可知,反应温度达到50 ℃后,脱色率上升变得缓慢,而效价收率随着温度升高持续下降,50 ℃是一个较优的反应温度。
2.3 反应pH 值对脱色率和效价收率的影响
固定反应温度50±2 ℃,双氧水加量2%,反应时间6 h,进行不同反应pH 值对脱色率和效价收率的影响。
反应pH 值对脱色率和效价收率的影响见图4。
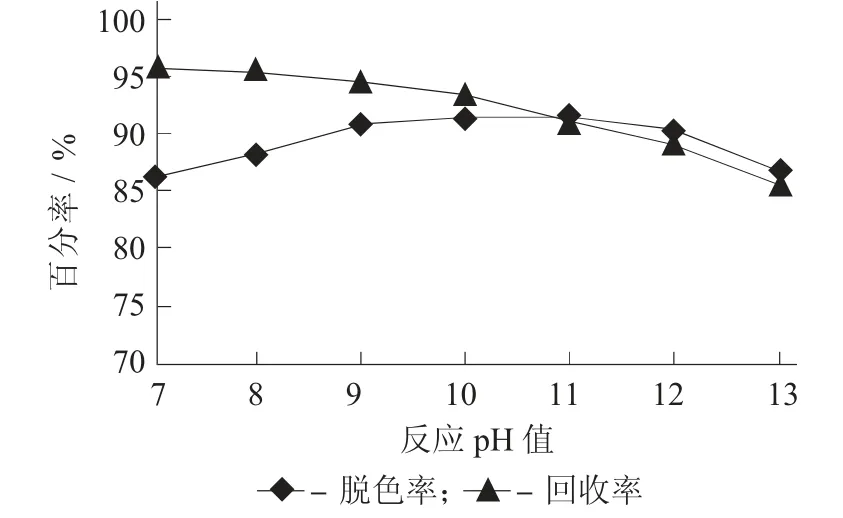
图4 反应pH 值对脱色率和效价收率的影响
由图4 可知,反应pH 值达到10 后,脱色率达到顶点,而效价收率随着pH 值升高持续下降,pH值为10 是一个较优的反应pH 值。
2.4 反应时间对脱色率和效价收率的影响
固定反应温度50±2 ℃,反应pH 值10.0±0.2,双氧水添加量2%,进行不同反应时间对脱色率和效价收率的影响。
反应时间对脱色率和效价收率的影响见图5。
由图5 可知,反应时间达到6 h 后,脱色率不再上升,而效价收率随着反应时间延长持续下降,6 h是一个较优的反应时间。
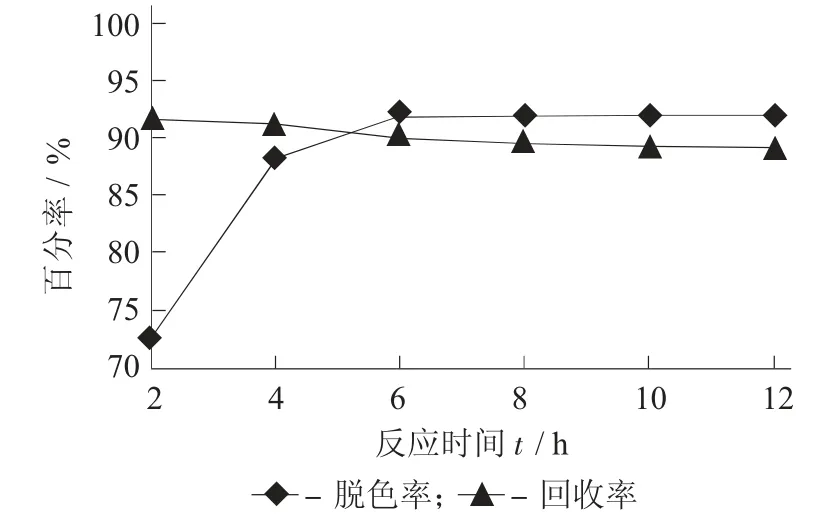
图5 反应时间对脱色率和效价收率的影响
2.5 氧化反应条件的优化
在单因素试验的基础上进行正交试验,对比脱色率和效价收率。
氧化反应条件及结果见表2。
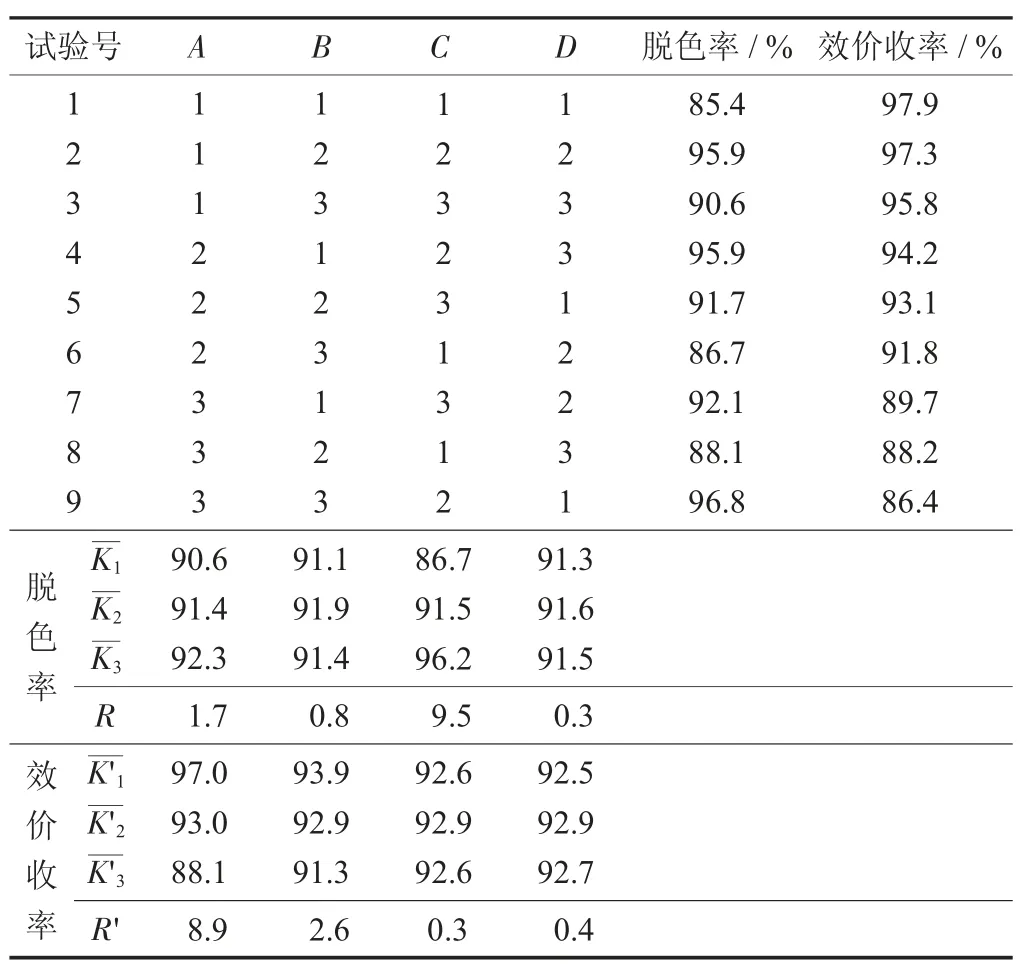
表2 氧化反应条件及结果
根据表2 中的极差R 值,对脱色率影响程度的顺序是双氧水加量>反应温度>反应pH 值>反应时间,对效价收率影响程度的顺序是反应温度>反应pH 值>反应时间>双氧水加量。双氧水加量对脱色率影响排第1 位,取最优双氧水加量2.5%;反应温度对效价收率影响排第1 位,取最优反应温度40±2 ℃;反应pH 值对效价收率影响排第2 位,对脱色率排第3 位,取对效价收率影响的最优反应pH 值9.0±0.2;脱色率和效价收率的最优反应时间均为6 h。
2.6 较优工艺条件试验
选择3 批牛源粗品肝素,按照研究筛选的最优牛源肝素生产工艺,制备3 批牛源肝素钠试验样品,进行效价、核酸杂质、蛋白质、分子量等项目检测。
检测结果见表3。
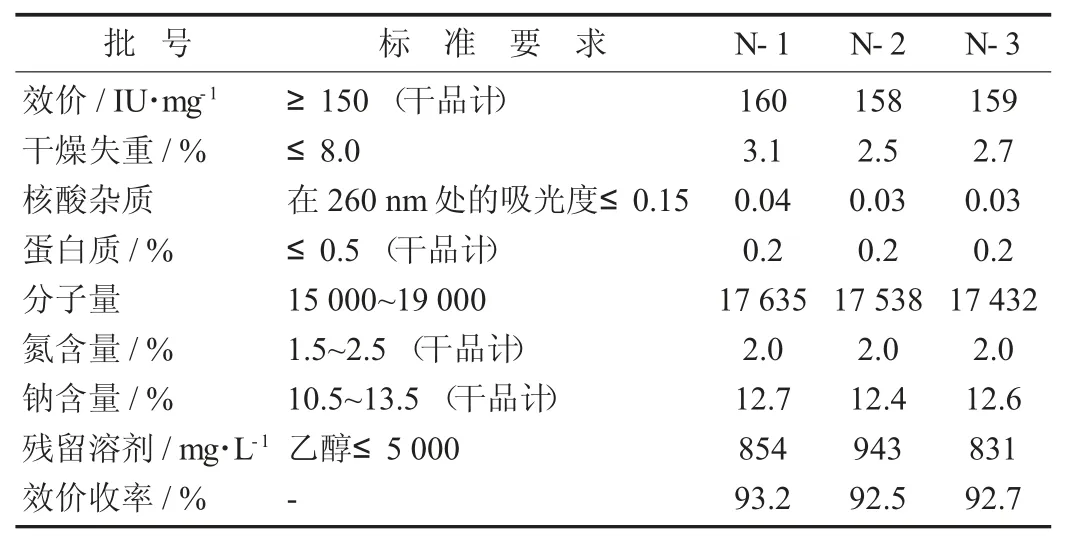
表3 检测结果
N-1,N-2,N-3 这3 批牛源肝素钠试验的脱色率依次为94.3%,94.7%,94.8%,平均为94.6%;氧化步骤的效价收率依次为97.5%,97.2%,97.3%,平均为97.3%。效价、杂质含量、分子量等指标均符合标准要求,总的效价收率也大于90%,说明该工艺稳定且高效。
2.7 牛源肝素钠的二糖结构分析
对N-1,N-2,N-3 这3 批牛源肝素钠试验样品进行二糖进行检测。
二糖分布检测结果见表4。
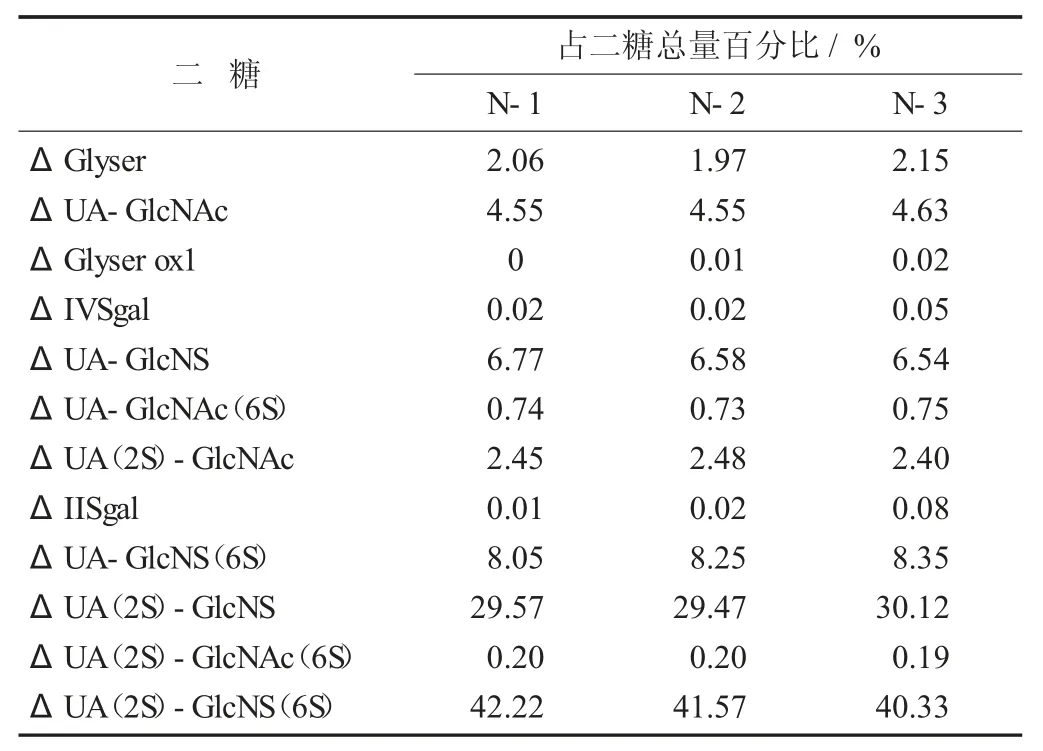
表4 二糖分布检测结果
ΔGlyser 峰表征肝素中的丝氨酸残基,其可被强氧化剂氧化成ΔGlyser ox1 峰,ΔIVSgal 和ΔIISgal结构源于- IdoA(2S)- GlcNS(6S)- 和- IdoA(2S)-GlcNS- 在碱性条件下2- O- 脱硫[10],这2 个结构的含量可以反映肝素是否经历过高碱性条件,工艺没有高碱处理步骤,所以样品的这2 个峰较低。ΔUA(2S)-GlcNS 峰和ΔUA(2S)-GlcNS(6S)峰可以用来辨别肝素的来源,牛源肝素的ΔUA(2S)- GlcNS 峰显著高于猪源肝素[11],ΔUA(2S)-GlcNS(6S)峰的含量与肝素的效价相关,牛源肝素的效价明显低于猪源肝素就与该峰较低有关。
3 结论
经设计正交试验方案,并对试验结果分析研究得出氧化步骤的最佳反应条件为反应温度40±2 ℃,反应pH 值9.0±0.2,双氧水添加量2.5%,反应时间6 h。按最优氧化条件进行试验,该步骤的脱色率为94.6%,效价收率为97.3%。制备的牛源肝素钠效价、杂质含量、分子量等指标均符合标准要求,总的效价收率也大于90%,说明该工艺稳定且高效。
对牛源肝素钠进行二糖结构分析,ΔGlyser 峰较高,ΔGlyser ox1 峰较低,ΔIVSgal 和ΔIISgal 峰含量较低,表明牛源肝素钠结构未被破坏,控制合适的氧化条件,才能使得色素被充分去除,而结构不受影响。ΔUA(2S)-GlcNS 峰较猪源肝 素低,ΔUA(2S)-GlcNS(6S)峰较猪源肝素高,表现出牛源肝素的特征。从二糖结构看,牛源肝素与猪源肝素的结构存在着较大差异,与文献报道一致[12]。
