山桃生根成苗关键技术研究
2023-04-20张雪冰王鸿张帆陈建军李宽莹
张雪冰 王鸿 张帆 陈建军 李宽莹
摘要:山桃是甘肃地区普遍应用的桃树优良砧木,具有抗寒、抗旱的特性。然而山桃通过种子繁殖的方式存在一定比例上的抗性分离现象,而且繁殖周期较长。为探索山桃组培快繁技术。对山桃组培苗的生根培养和炼苗移栽进行了试验。结果表明,以改良QL培养基为基本培养基,当IBA浓度为1.0 mg/L时,试管苗生根效果最好,根系粗壮,侧根较多,生根率达94%以上,平均根数6根以上,平均根长6.8 cm以上;添加80 mg/L PG的处理,无论是生根率、平均根数还是平均根长,较不添加80 mg/L PG的处理相比均表现不理想。将根长超过3 cm的山桃组培苗置于温室中,先遮光炼苗5~7 d,后将瓶盖打开1/2,并配制800倍多菌灵溶液少量倒入组培瓶中,4 d后可将瓶盖全部打开继续炼苗5~7 d,组培苗根系生长基本正常,炼苗成活率可达88%。
关键词:山桃;组织培养;生根;激素
中图分类号:S662.1 文献标志码:A 文章编号:2097-2172(2023)03-0270-05
doi:10.3969/j.issn.2097-2172.2023.03.014
Abstract: Mountain peach, i.e. Prunus davidiana(Carr.) Franch, is a high-quality rootstock which is widely used in Gansu Province, it possesses both cold and drought resistance. However, mountain peach has a percentage of resistance separation in the way of seed propagation, and its propagation cycle is long. To explore the technology of tissue culture and rapid propagation of mountain peach. Rooting culture of the test-tube seedling and the transplanting of the tissue culture seedling of mountain peach were conducted to study the tissue culture and rapid propagation system of mountain peach. The results were as followed. When improved QL culture medium was used, best tube seedlings rooting effect was detected under the concentration of IBA at 1.0 mg/L, which delivered stronger root systemand more capillary roots, the rooting rate was above 94%, the average root number was over 6 and average root length was more than 6.8 cm under this concentration, whereas in the treatment of adding 80 mg/L PG, the average rooting rate, root number and root length showed less ideal performance compared with those in treatment with no 80 mg/L PG added. Tissue culture seedlings with root length over 3 cm were placed in the greenhouse environment, dark cultured for 5 to 7 days first, then small amount of 800 times Carbendazim solution were poured into the tissue culture bottle with lid half open, after 4 days, culture seedling root were refined for 5 to 7 days with cap fully open, in this way, the root system growth of tissue cultured seedlings was basically normal and the survival rate of refined seedlings could reach 88%.
Key words: Prunus davidiana (Carr.) Franch; Tissue culture; Rooting; Plant growth regulator
桃是我國主要栽培的果树之一,目前桃生产上所用的品种80%以上为我国自主选育的。我国的桃产业分布比较广泛,而不同生态区域的立地和自然条件有很大差异,因此对桃品种的需求也呈现多样化。与其他果树相比,桃的经济寿命相对比较短,一般只有15~20 a,生产上存在的再植障碍等问题也比较突出。山桃作为落叶小乔木,主产我国黄河流域,喜光,耐寒,耐旱,耐盐碱,对土壤要求不严,贫瘠、荒山均可生长。山桃早春开花,色彩艳丽,树形优雅,是北方园林中早春重要的观花树种,也是西北地区普遍应用的优良砧木,适于做桃、李、榆叶梅等嫁接砧木。然而山桃通过种子繁殖的方式存在一定比例上的抗性分离现象,且繁殖周期较长。通过组培快繁技术不但可以保留其抗性,还能够提供大量整齐一致的优良苗木。在国外,组培快繁技术已经在工厂化生产中得到广泛应用,但目前在国内组培快繁技术还不够成熟完善。我们以山桃作为试验材料,探讨其组培快繁技术,以期获得更加成熟的无性繁殖技术,为桃树的无性繁殖提供技术支持。
1 材料与方法
1.1 材料
2020年10月,以高于2 cm 山桃試管苗作为生根培养试验材料。2021年1月,以组培室成功生根的山桃组培苗作为炼苗移栽试验材料。
1.2 方法
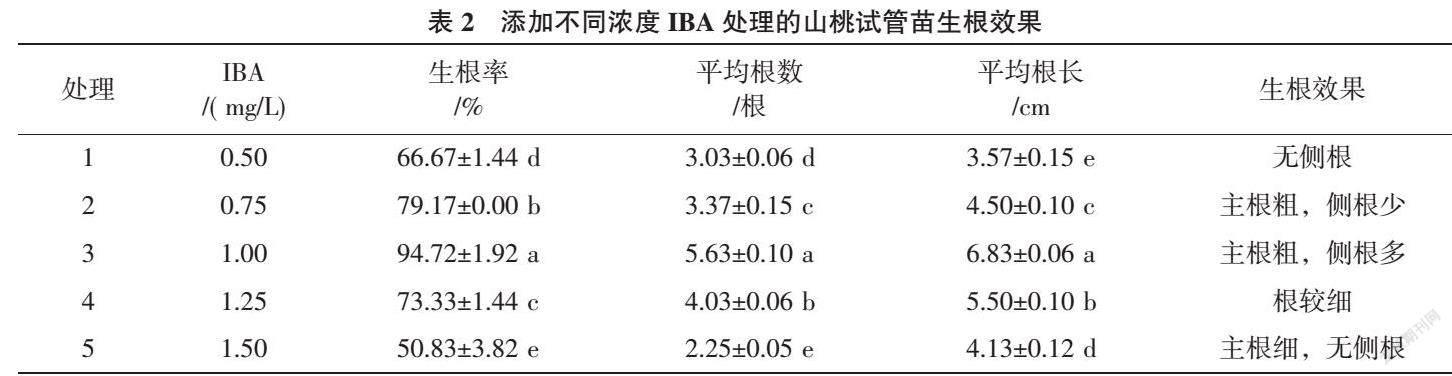
1.2.1 IBA对山桃试管苗生根的影响 将高于2 cm 组培试管苗转接到以改良QL为基本培养基、添加不同浓度IBA(0.50、0.75、1.00、1.25、1.50 mg/L)的生根培养基中进行生根培养,处理编号分别为处理1、2、3、4、5。首先需暗培养7 d,然后再转光照培养,21 d后观察试管苗生根情况并调查统计其生根率、平均根数、平均根长。
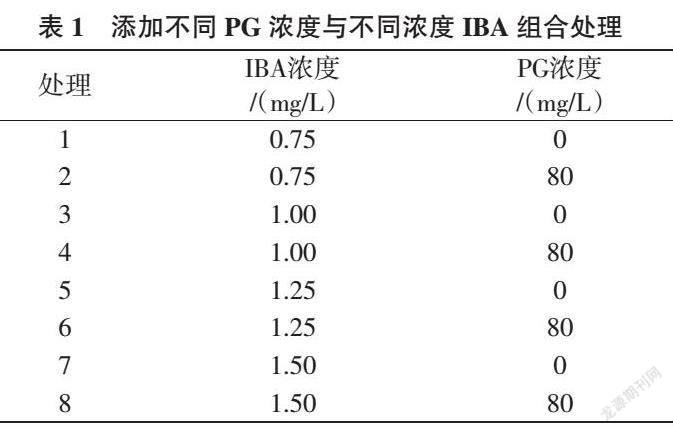
1.2.2 PG对山桃试管苗生根的影响 将高于2 cm 组培试管苗转接到以改良QL为基本培养基、添加不同浓度PG和不同浓度IBA组合的生根培养基中进行生根培养(表1),先暗培养7 d,然后再转光照培养,21 d后观察试管苗生根情况并调查统计其生根率、平均根数、平均根长。
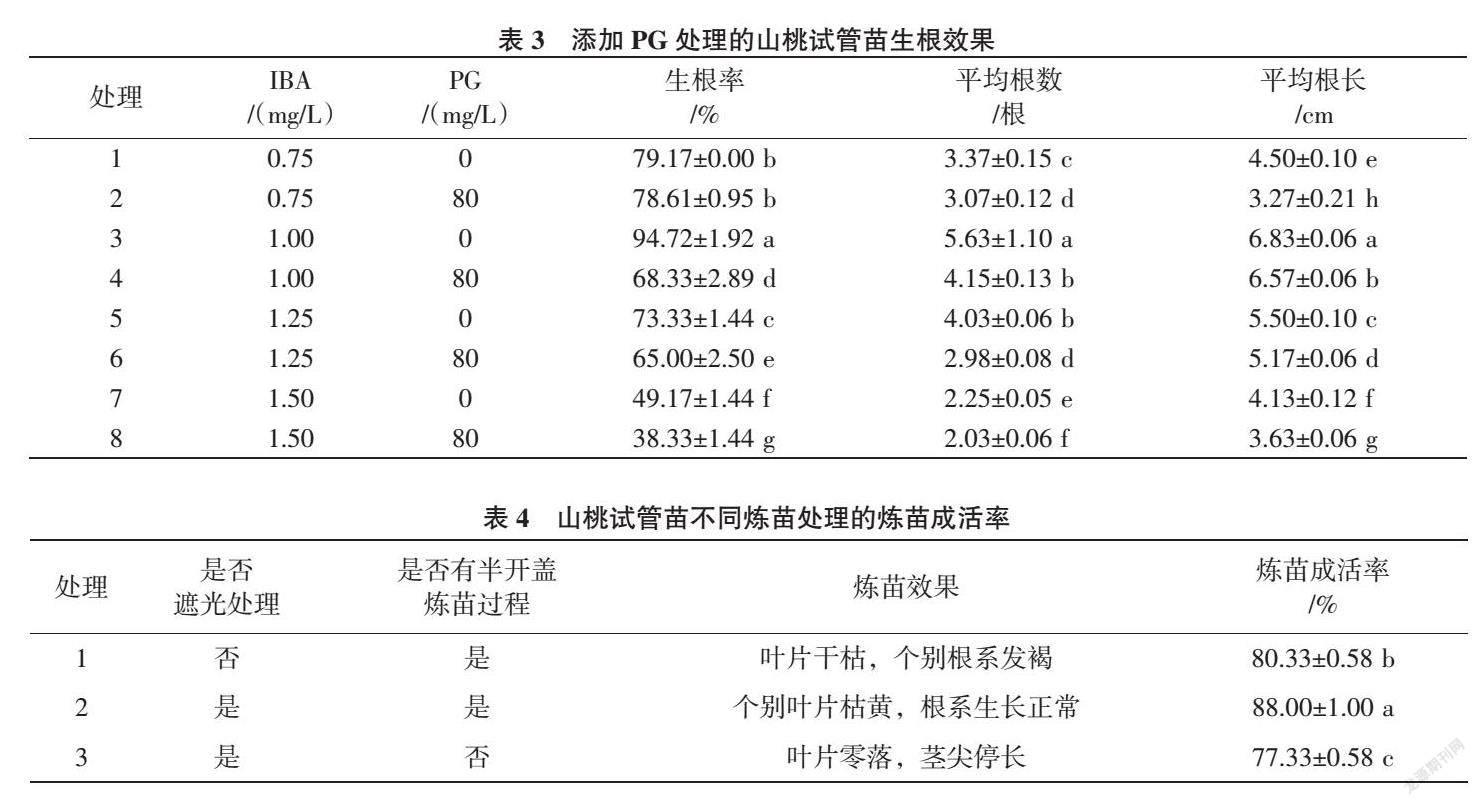
1.2.3 山桃试管苗的炼苗移栽试验 试验设3个处理,处理1,将根长超过3 cm的山桃组培苗置于温室环境中,不需遮光培养5~7 d,查看组培苗的适应情况,然后将瓶盖打开1/2,并配制800倍的多菌灵(80%可湿性粉剂)溶液少量倒入组培瓶中,4 d后将瓶盖全部打开继续炼苗5~7 d,观察组培苗根系生长是否良好,枝条生长是否正常,并统计炼苗成活率。将其从组培瓶中取出,根部清洗干净后移栽到配制好的基质中。处理2,将根长超过3 cm的山桃组培苗置于温室环境中,遮光培养5~7 d,查看组培苗的适应情况。然后将瓶盖打开1/2,配800倍的多菌灵溶液少量倒入组培瓶中,4 d后将其瓶盖全部打开继续炼苗5~7 d,观察组培苗根系生长是否良好,枝条生长是否正常,并统计炼苗成活率。将其从组培瓶中取出,根部清洗干净后移栽配制好的基质中。处理3,将根长超过3 cm的山桃组培苗置于温室环境中,遮光培养5~7 d,查看组培苗的适应情况。然后将瓶盖全部打开,并配制800倍的多菌灵溶液少量倒入组培瓶中5~7 d后观察组培苗根系生长是否良好,枝条生长是否正常,并统计炼苗成活率。将其从组培瓶中取出,根部清洗干净后移栽到配制好的基质中。
2 结果与分析
2.1 IBA对山桃试管苗生根的影响
从表2可知,IBA浓度为1.0 mg/L时,山桃试管苗的生根效果最显著,主根根系粗壮,侧根较多,生根率达94.72%,平均根数5.63根,平均根长6.83 cm;IBA浓度为0.75、1.25 mg/L时,生根效果较好,生根率分别为79.17%、73.33%;IBA浓度为0.50 mg/L时,生根率较低,平均根长短,只有主根,没有侧根;IBA浓度为1.50 mg/L时,生根效果最差,平均根数小于3根,无侧根,主根细,生根率仅50.83%。
2.2 PG对山桃试管苗生根的影响
从表3可知,IBA浓度为1.00 mg/L时,不添加PG的处理生根率最高,为94.72%,且平均根数较多,为5.63根;平均根长较长,为6.83 cm。IBA浓度为0.75 mg/L时生根率较高,不添加PG和添加80 mg/L PG处理分别为79.17%、78.61%,不添加PG的处理平均根数较多、平均根长较长。IBA浓度为1.25 mg/L时,不添加PG处理的生根率高于添加80 mg/L PG处理,为73.33%,平均根数相对较多,平均根长相对较长。IBA浓度为1.50 mg/L时生根率较低,不添加PG处理生根率相对高于添加80 mg/L PG处理,平均根数相对较多,平均根长相对较长。
2.3 炼苗移栽的成活率
从表4可知,在炼苗移栽过程中,炼苗前期经过遮光处理、中间又有半开盖炼苗过程的组培苗根系生长基本正常,仅个别叶片枯黄,零落,炼苗成活率达88.00%。没有经过遮光处理的组培苗,更早的出现叶片干枯的现象,后期还发现其个别根系发褐、发黑,炼苗成活率达80.33%。没有经过半开盖炼苗过程的组培苗,叶片零落严重,且有些生根苗顶尖停长,炼苗成活率仅77.33%。
3 讨论与结论
诱导植物组培苗生根常用的外源激素有IAA、IBA、NAA等,其中IBA可以诱导桃组培试管苗的生根,但会影响根的生长、延长[1 ]。Hammerschlag等认为,NAA的生根效果要优于IAA和IBA,当生根培养基中的NAA的浓度为5.8 μmol/L时,生根效果最显著[2 ],这一结论与本研究发现IBA浓度为1.0 mg/L时生根效果最理想的结果并不相同。也有研究发现,IBA的生根效果比NAA和IAA更为理想[3 - 4 ],在组培快繁生根过程中,生根培养基内所添加的IBA浓度一般为0.5~1.5 mg/L[5 - 6 ],添加浓度太高反而会使生根率降低[7 ],因为适宜的IBA浓度能够抑制根的伸长生长,可见,高浓度IBA会使生根数量增多,而较低浓度的IBA会使平均根长增长[8 ],这与本试验的结果基本一致。本试验发现,IBA浓度高于1.0 mg/L时生根率降低,平均根长减少,而低浓度的IBA生根效果也不理想。也有许多研究将IAA、IBA、NAA 3种激素搭配使用来促进生根。例如,有研究发现,在桃生根培养基中添加IAA 1.0 mg/L+IBA 1.0 mg/L时生根效果最为理想[9 ],然而也有研究表明在生根培养基中只添加IBA 2.0 mg/L时生根率最高[10 ]。除了这3种常用的激素以外,有其他添加激素也可促进桃组培试管苗的生根。郭伟伟等[11 ]在‘黄金冠’桃的组培研究中发现,NAA+IBA组合使用时生根效果最显著;潘瞳等[12 ]在对紫叶桃的组培研究中发现,IBA+2,4-D组合使用时生根效果最理想,而本试验中,IBA浓度为1.0 mg/L时,生根效果很理想,说明不同桃品种适宜生根的激素也存在差异。在生根培养基中添加适量的80 mg/L间苯三酚(PG)可以提高桃组培试管苗的生根率,当添加浓度低于15 mg/L时生根效果并不明显[7 ],这一结论与本研究结果并不一致。本试验发现生根培养基中添加间苯三酚(PG)对山桃的生根培养并没有促进作用,其原因有待进一步研究。
组织培养的最后一步就是组培试管苗的炼苗移栽,是组培试管苗移栽于大田能否成功的最后一道关卡,也是组培这一技术能否生产化的关键[13 ]。当组培试管苗经过生根培养后,移栽时根的长度一般要求不小于3 cm,否则由于根过短移栽不易成活;另外移栽时根的长度也不宜过长,以防在移栽的过程中将根折断而导致降低成活率[14 ]。若直接将组培生根苗移栽于大田,由于生长环境差别太大会导致成活率降低。因此,组培生根苗必须在温室条件下进行炼苗,炼苗成功后方可移栽定植大田。组培生根苗需要在温室环境下闭瓶炼苗 3 d左右,然后再打开瓶塞炼苗4 d左右[15 ]。移栽前必须清洗干净组培生根苗根部的琼脂,然后栽入含有少量营养成分的基质中。有研究发现,组培试管苗移栽到养分很低的蛭石中成活率高,不能直接移栽到养分充足的有机土壤里[7 ],移栽的基质应偏酸性。这与本试验研究结果基本一致。本试验也是选择现在温室炼苗数天后再移栽,同样选择养分较低的基质为移栽所用。有研究发现,组培试管苗在移栽时应缓慢降低环境湿度,尽量保持高湿的环境才能提高成活率[15 ],因此保证高湿的密闭环境是炼苗前期的关键。桃快繁生根炼苗的环境温度应保持在20 ℃左右为宜。移栽后为防止组培苗污染,应喷洒 800 倍的多菌灵或代森锰锌控制病害的发生。炼苗过程中前期需适当遮阴,后期逐渐增加光照强度,从而促进组培苗逐渐木质化[16 - 17 ]。低温处理不同天数对打破种子休眠有一定的作用,可以提高萌芽率[18 ]。总之,在本试验炼苗移栽的过程中发现,温度、光照等因素十分重要,这与大多数研究结果一致。本试验表明,将根长超过3 cm的山桃组培苗置于温室环境中,需要遮光培养5~7 d,观察组培苗的适应情况,之后将瓶盖打开一半,并配置800倍的多菌灵少量倒入组培瓶中,既可以预防组培苗污染,也可以保持培养基不被晾干,4 d后可将其瓶盖全部打开继续炼苗5~7 d,观察组培苗根系生长是否良好,枝条生长是否正常,便可以将其从组培瓶中取出,将根部清洗干净后移栽到配置好的基质中。这种炼苗移栽方法对山桃试管苗最为适合。
本试验表明,IBA浓度为1.0 mg/L时,山桃试管苗的生根效果最好,根系粗壮,侧根较多,生根率达94 %以上,平均根数6根以上,平均根长6.8 cm以上。添加80 mg/L PG的处理,无论是生根率、平均根数还是平均根长,較不添加80 mg/L PG的处理相比表现都不理想。将根长超过3 cm的山桃组培苗置于温室环境中遮光炼苗5~7 d后,将瓶盖打开一半,并配制800倍的多菌灵少量倒入组培瓶中,4 d后可将其瓶盖全部打开,继续炼苗5~7 d时,这样的炼苗过程效果最好,组培苗根系生长基本正常,只有个别叶片枯黄,零落,炼苗成活率可达到88%。
参考文献:
[1] ANCHONDO T J R, FRATTARELLI A, MONTICELLI S, et al. Effect of the gelling agent and alternative substrates on micropropagation of peach rootstock GF677 (P. amygdalus× P. persica)[J]. Acta Horticulturae, 2011, 923: 209-212.
[2] KRIZAN P, SAULI P, LASTOVICKA J. Persistence of planetary wave type oscillations in the mid-latitude ionosphere[J]. Annals of Geophysics, 2006, 49(6):1189-1193.
[3] FELEK W, MEKIBIB F, ADMASSU B. Micropropagation of peach, Prunus persica(L.) BATSCH. cv. Garnem[J]. African Journal of Biotechnology, 2017, 16(10): 490-498.
[4]DEJAMPOUR J, MAJIDI I, KHOSRAVI S, et al. In Vitro Propagation of HS314 Rootstock (Prunus amygdalus× P. persica)[J]. Hortscience, 2011, 46(6): 928-931.
[5] 赵剑波,郭继英,姜全,等. 桃抗重茬砧木GF677组培快繁技术[J]. 江苏农业科学,2016(5):60-61;68.
[6] 周玉碧,李 唯. 晚熟桃微繁技术的研究[J]. 甘肃农业大学学报,2005,40(6):745-749.
[7] PARK S H, ELHITI M, WANG H, et al. Adventitious root formation of in vitro peach shoots is regulated by auxin and ethylene[J]. Scientia Horticulturae, 2017, 226: 250-260.
[8] 陈子萱,曹孜义,田福平. 扁桃砧木Nemaguard和Lovell的组培快繁[J]. 甘肃农业大学学报,2004,39(5):524-528.
[9] KORNOVA K, MICHAILOVA J, ASTADJOV N. Application of In Vitro Techniques for Propagation of Rosa Kazanlika Top.(Rosa Damascena Var. Trigintipetala)[J]. Biotechnology & Biotechnological Equipment, 2000, 14(2):78-81.
[10] KAMALI K, MAHIDI E, ZARGHAMI R. Determination of the most suitable culture medium and growth conditions for micropropagation of GF677 (hybrid of almond × peach) rootstocks[M]. University of Oxford. 2001, 234-243.
[11] 郭伟伟,孟庆杰,黄 勇,等. ‘黄金冠’桃组织培养的初步研究[J]. 北方园艺,2010(19):142-144.
[12] 潘 瞳,姚苗笛,于曉南. 紫叶桃(Prunus persica f. atropurpurea)的愈伤组织诱导和培养[J]. 河北林果研究,2009,24(1):77-80.
[13] EDRISS M H, BAGHDADI G A, EL-RAZEK A M A, et al. Micropropagation of Some Peach Rootstocks[J]. Nature and Science, 2014,12(3): 106-114.
[14] PEREZ J M, CANTERO N E, PEREZ-A F, et al. Relationship between endogenous hormonal content and somatic organogenesis in callus of peach (Prunus persica L. Batsch) cultivars and Prunus persica × Prunus dulcis rootstocks[J]. Journal Of Plant Physiology, 2014, 171(8): 619-624.
[15] SOTIROPOULOS T E, FOTOPOULOS S. In vitro propagation of the PR 204/84 peach rootstock(Prunus persica × P. amygdalus): the effect of BAP, GA3, and activated charcoal on shoot elongation[J]. European journal of horticultural science, 2005, 70(5): 253-255.
[16] 杨增海,胡霓云,路广明. 桃茎尖试管繁殖成苗[J]. 植物生理学报,1982(3):42-43.
[17] 杨增海,胡霓云,路广明. 桃试管实生苗茎尖培养的研究[J]. 园艺学报,1984,11(1):7-13.
[18] 张雪冰,王 鸿,张 帆,等. 外源激素及低温处理对桃种子休眠解除的影响[J]. 甘肃农业科技,2020(12):59-61.
