湛江市养殖墨西哥湾扇贝中14 种微量元素的分布特征及其膳食暴露评估
2023-04-18方昕黄和周雪巍
方昕 黄和 周雪巍
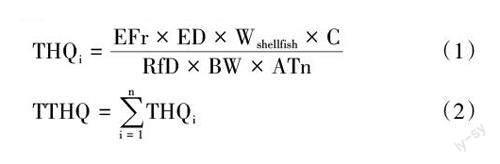
摘要:为阐明湛江市养殖墨西哥湾扇贝中14种微量元素的含量及分布特征,并进行膳食暴露风险评估,采用电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry, ICP-MS)测定了6个养殖区域扇贝全部软体部分、性腺、外套膜、消化腺、闭壳肌、鳃和海水中14种微量元素的含量,通过目标危害系数(targethazard quotient,THQ)评估有害微量元素潜在的膳食暴露风险。结果表明,全部样品中14种微量元素均有检出,含量由高到低依次为Mn>Fe>Zn>Sr>As>Cd>V>Cu>Co>Ba>Pb>Cr>Ni>Ga,并且表现出区域差异性。微量元素主要分布在扇贝的性腺、消化腺和鳃中,养殖区域海水中与扇贝中Cd的含量变化趋势相同,扇贝体内的微量元素含量存在季节性差异。扇贝中As与Cd含量间呈极显著正相关(P<0.01),可能对人体有害微量元素的复合目标危害系数(total target hazard quotient, TTHQ)值为0.208(<1)。综上,扇贝体内微量元素分布具有组织特异性,其中As与Cd可能具有相同的污染源,并且Cd的蓄积受养殖环境的影响,食用墨西哥湾扇贝不存在有害微量元素暴露风险,不会引起健康风险。研究结果为扇贝中有害元素膳食暴露风险评估提供科学数据。
关键词:墨西哥湾扇贝;微量元素;可能有害元素;分布;膳食暴露doi:10.13304/j.nykjdb.2022.0475
中图分类号:S944.4+3 文献标志码:A 文章编号:10080864(2023)01022311
贝类因其味道鲜美,深受消费者喜爱,且富含蛋白质、脂质、碳水化合物和矿物质[1]。贝类能够提供多种微量元素,如锌(Zn)、铁(Fe)、锰(Mn)、铬(Cr)、硒(Se)、铜(Cu)、钒(V)、镍(Ni)、钴(Co)等[2]。这些微量元素参与机体的多种生理活动及物质能量代谢。其中,Fe是血红蛋白的重要组成部分,参与氧的运输;Zn在基因表达、细胞生长以及免疫方面具有重要的作用,是人体生长和发育必不可少的元素;Cu是血红蛋白形成的激活剂,参与超氧化物歧化酶的形成并且对机体有解毒作用。贝类体内的微量元素含量受养殖环境的影响[3]。Zhang等[4]发现,广东沿海地区近几年甲壳类生物中Cu、Zn含量呈下降趋势,认为这与广东省和珠三角地区有效的污染控制措施有关。海洋环境发生污染后,重金属在海洋中不会被降解,易被水生生物富集[5]。人类通过食用贝类摄入重金属,可能引起健康风险。Liu等[6]发现,深圳8种贝类中镉(Cd)、砷(As)和铅(Pb)的目标危害系数(target hazard quotient, THQ)均大于1,说明食用该地区的贝类存在健康风险。Barbosa等[7]报道,巴西7个沿岸地点的4种贝类中As和Cr的水平均超过巴西国家卫生监督局规定的人类食用允许量(As为1.0 mg·kg-1,Cr為0.1 mg·kg-1)。此外,不同季节贝类中As含量不尽相同,与雨季相比海洋生物在干燥的季节As 积累更多;与温暖的季节相比,海洋生物在寒冷季节As积累更多[8]。
为了延长扇贝的保质期,干扇贝在市场上尤为常见,脱水后的干贝风味独特、易于保存。Wen等[9]通过基因测序鉴别广州和湛江干货市场上60 多种商业化的干贝产品,发现占比最高(56.7%)的为养殖的海湾扇贝(A. irradians)。墨西哥湾扇贝(Argopecten irradians concentricus)作为海湾扇贝的一个南方地理亚种,因其肉质鲜嫩、生长速度快、鲜肉柱率高、存活率高而被引进,自1991年首次引入我国后,至今已经历30多年,其研究和推广养殖已取得丰硕成果,养殖面积超过6 600 hm2,经济效益和社会效益显著[10]。湛江市墨西哥湾扇贝秋季投苗(投苗期为10 月中旬至11月中旬),冬季为中培期,春季为养成期,夏季为收获期。近年来,针对墨西哥湾扇贝生产性能[11]、养殖技术[12]以及环境对墨西哥湾扇贝存活状态[13]方面的研究报道较多,但作为食品营养指标的微量元素含量和分布,以及有害元素的污染状况未见报道。因此,本文对湛江市养殖的墨西哥湾扇贝全部软体部分(去壳后的部分)及不同组织(性腺、外套膜、消化腺、闭壳肌和鳃)中微量元素含量进行分析,比较不同养殖区域墨西哥湾扇贝中元素含量的差异,阐明养殖环境对墨西哥湾扇贝体内微量元素含量的影响,分析墨西哥湾扇贝体内不同微量元素的分布特征,探究扇贝体内微量元素的蓄积特点,为扇贝中有害元素膳食暴露风险评估提供科学数据。
1 材料与方法
1.1 样品采集
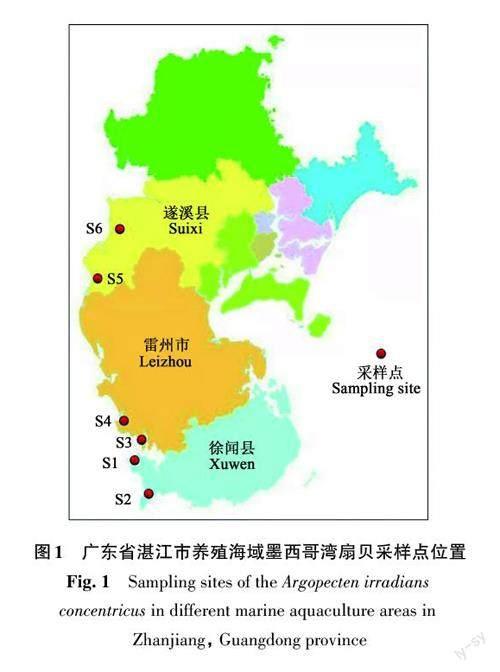
2021年4—5月(T1,养成期)采集墨西哥湾扇贝和海水样品,采样区域(图1)分别为S1 (20.09°N、110.31°E)、S2 (20.16°N、110.2°E)、S3 (20.27°N、109.55°E)、S4 (20.34°N、109.49°E)、S5 (21.92°N、110.02°E)和S6 (21.8°N、110.17°E)。每个养殖区域分别采集墨西哥湾扇贝100颗,同时使用采水器采集该区域扇贝养殖相同深度的海水。另外在2021年12月(T2,中培期)和2022年7月(T3,收获期)各采集S4区域墨西哥湾扇贝100颗进行养殖季节扇贝体内微量元素比较。采集的扇贝样品使用泡沫箱保存,海水保存在聚乙烯塑料桶内,采样结束后,样品立即低温运回实验室。
1.2 试剂与仪器
试验所用试剂均为优级纯。试验用超纯水均为Milli-Q超纯水仪(Millipore,美国)制备。硝酸(HNO3,65%,Merck,德国)和过氧化氢(H2O2,广州化学试剂厂)用于消解样品。多元素标准储备液(GSB 04-1767-2004)购自国家有色金属及电子材料分析测试中心(北京),用于配置标准曲线。国家标准物质扇贝(GBW10024)购自中国地质科学院地球物理地球化学勘查研究所(北京)。电感耦合等离子体质谱仪(inductivelycoupled plasma mass spectrometry, ICP-MS)(7500cx,Agilent,美国)用于样品中微量元素测定,样品消解采用multiwave PRO 微波消解仪(Anton Paar,奥地利),冷冻干燥机(LICHEN,中国)用于样品制备。所有试验用玻璃器皿均在20%硝酸中浸泡24 h以上,使用前用超纯水反复冲洗干净。
1.3 样品前处理
1.3.1 样品制备 扇贝样品运送回实验室后,用超纯水将贝类外壳冲洗干净,用刷子去除表面污垢,用陶瓷剪刀将扇贝去壳分离组织。分别取扇贝全部软体部分、性腺、外套膜、消化腺、闭壳肌和鳃,分别置于聚乙烯塑料袋中,-20 ℃保存。样品冷冻干燥后,研磨成均匀粉末,-20 ℃保存,待测。海水样品运回实验室后,立即用抽滤罐进行抽滤,然后加入1% HNO3进行酸化,4 ℃保存。
1.3.2 样品消解 称取0.100 0 g样品于聚四氟乙烯消解罐中,加入6.0 mL HNO3和0.6 mL H2O2,盖好弹片并旋紧微波消解罐外盖,于微波消解仪中进行消解。消解程序为:① 升温10 min,至120 ℃,保持5 min;②升温5 min,至150 ℃,保持5 min;③升温8 min,至180 ℃,保持20 min;④降温20 min,至70 ℃。消解液通过赶酸仪180 ℃赶酸1 h,待消解液冷却至室温后,用超纯水转移并定容至50 mL,置于4 ℃保存,待测。试剂空白和标准参考物质采用同样的方法进行消解,每个样品、空白及标准物质均进行2个平行处理。
1.4 样品中14 种微量元素含量的测定
配制100 μg·mL-1 的 Cu、Zn、Cd、Pb、Cr、As、Ni、Ba、V、Co、Fe、Mn、Ga、Sr标准溶液中间液,用2% 硝酸逐级稀释配制成0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0 μg·L-1的工作曲线。所有微量元素采用ICP-MS测定,每个样品重复测定3次。ICP-MS仪器参数参考Xie等[14]的方法。海水在测定前使用0.22 μm(Millipore,美国)滤膜过滤。
1.5 膳食暴露评估
采用目标危害系数(target hazard quotient,THQ)[15]评估贝类单一可能对人体有害元素对人体健康产生的风险;对贝类中多种可能对人体有害元素的综合风险评估,采用复合目标危害系数(total target hazard quotient, TTHQ),即对所有THQ值求和。计算公式如下。
式中,EFr是膳食暴露频率(365 d·年-1);ED是膳食暴露持续时间(70年);Wshellfish是每日贝类消费量(成人20 g·d-1);C是贝类中重金属的含量(mg·kg-1);RfD为参考摄入剂量,Pb、Cd、Cr、As分别为0.003 57、0.001 00、0.003 00和0.000 30 mg·kg-1·d-1[16];BW是平均体重(成人60 kg);ATn是致癌物的平均暴露时间,ATn=EFr × ED;THQi是第i 个元素的目標危害系数。
1.6 数据分析
采用Microsoft Excel 2007分析数据整理和试验结果,采用JMP Pro 16.0统计分析软件进行单因素方差分析Tukeys检验,P<0.05表示存在显著差异,Pearson相关性分析采用SPSS 17.0进行,分析结果图采用Qrigin 2019绘制。
2 结果与分析
2.1 墨西哥湾扇贝和海水中微量元素含量分析
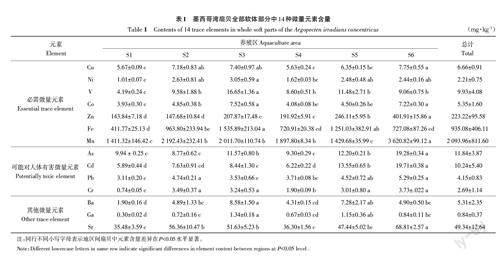
2.1.1 墨西哥湾扇贝全部软体部分中微量元素含量 墨西哥湾扇贝全部软体部分中14种微量元素含量(以干物质计)如表1 所示。所有样品中14种微量元素均有检出,样品中各微量元素平均含量从高到低依次为:Mn > Fe > Zn > Sr > As >Cd > V > Cu > Co > Ba > Pb > Cr > Ni > Ga。根据微量元素在人体中作用不同,可将这些微量元素分为人体必需微量元素(Mn、Fe、Zn、V、Cu、Co、Ni)、可能对人体有害微量元素(Cd、As、Pb、Cr)和其他微量元素(Ba、Ga、Sr)。墨西哥湾扇贝中必需微量元素Mn(1 411.32~3 620.82 mg·kg-1)、Fe(411.77~1 535.89 mg·kg-1)和Zn(143.84~401.91 mg·kg-1)的含量远高于其他微量元素,并且不同养殖区域扇贝全部软体部分中人体必需微量元素含量存在差异。S6养殖区域的Zn和Mn含量显著高于其他区域(P<0.05),S3养殖区域中的V含量显著高于其他区域(P<0.05),可能是由于养殖水域的环境影响了墨西哥湾扇贝体内微量元素的含量。可能对人体有害微量元素中As和Cd含量较高,平均值分别为11.84和10.24 mg·kg-1,并且表现出区域差异,S6养殖区中的As和Cd含量均显著高于其他区域(P<0.05),表明墨西哥湾扇贝具有更强地富集As和Cd的能力。3种其他微量元素中Sr的平均含量最高,其次为Ba和Ga。其中,S6养殖区Sr含量显著高于其他区域(P<0.05)。研究表明,虽然Sr不是人体必需微量元素并且没有已知的生物学作用,但是Sr可以同钙一样被人体吸收并优先分配到骨骼中[17],因此只要摄入量适当,Sr可以对人体产生有益的影响。
2.1.2 海水中微量元素含量 湛江市6个墨西哥湾扇贝养殖区域的海水中微量元素含量(表2)从高到低依次为:Ba>Zn>V>As>Fe>Mn>Ni>Cu>Cr>Co>Cd>Pb。养殖区域海水和墨西哥湾扇贝中Cd含量的最高值和最低值均分别出现在S6和S1区域。养殖区域海水和扇贝中Co含量的最高值都出现在S3区域。本研究发现,养殖区域海水中Pb和Cu的含量很低,然而在扇贝中Pb和Cu含量却相对较高,可能是由于贝类中Cu、Pb的含量更多受生物动力学参数的影响。
2.2 不同元素在墨西哥湾扇贝中的分布特征
2.2.1 同一微量元素在扇贝5种组织中的分布特征 湛江市养殖的墨西哥湾扇贝中14种微量元素在性腺、消化腺、鳃、闭壳肌和外套膜中的分布特征见图2,鳃中Mn、Zn 的含量最高, 分别为4 823.05和497.95 mg·kg-1,外套膜中Mn的含量最低,为374.09 mg·kg-1。Fe在不同组织中含量依次为性腺>消化腺>鳃>外套膜>闭壳肌,含量在86.29~5 307.00 mg·kg-1之间,其中,性腺显著高于其他组织(P<0.05)。消化腺中Cu的平均值最高,鳃中Co的平均值最高,Ni和V的最高平均值均在性腺组织。除了Mn之外,Fe、Zn、Cu、Co、Ni和V在闭壳肌中含量最低。As和Cd在消化腺中的含量最高,平均值分别为22.80和51.61 mg·kg-1,显著高于其他组织(P<0.05),扇贝不同组织中As和Cd的分布趋势一致,依次为消化腺>鳃>性腺>外套膜>闭壳肌。Pb和Cr在扇贝组织中的分布趋势一致,性腺中的含量最高(12.08 和10.70 mg·kg-1),然后依次为鳃>消化腺>外套膜>闭壳肌,性腺组织中Cr的平均含量显著高于其他组织,Pb的平均含量显著高于除鳃以外的其他组织(P<0.05)。与其他组织相比,扇贝性腺组织中Ba和Ga的含量最高,而鳃中Sr的含量最高,显著高于其他组织(P<0.05)。综上所述,墨西哥湾扇贝不同组织中的微量元素水平具有组织特异性,在性腺、消化腺和鳃中含量较高,而在闭壳肌和外套膜中含量较低。
2.2.2 不同组织中14 种微量元素的分布特征 湛江市养殖的墨西哥湾扇贝性腺、消化腺、鳃、闭壳肌和外套膜中的14 种微量元素分布特征见图3。在性腺、消化腺、鳃、闭壳肌和外套膜中,人体必需微量元素的含量由高到低依次为Mn>Fe>Zn>V>Cu>Co>Ni。各组织中人体必需微量元素分布趋势与全部软体部分一致。外套膜、闭壳肌、鳃和性腺中As的含量显著高于Cd、Pb、Cr(P<0.05)。
性腺、消化腺、鳃、闭壳肌和外套膜中As的平均含量在5.9 ~ 22.8 mg·kg-1之间。消化腺中Cd的含量显著高于As、Pb、Cr(P < 0.05),性腺、消化腺、鳃、闭壳肌和外套膜中Cd的平均含量在0.60 ~ 51.61mg·kg-1 之间。鳃中As、Cd、Pb、Cr的分布趋势与全部软体部分保持一致。性腺、消化腺、鳃、闭壳肌和外套膜中Ba、Sr、Ga的分布趋势一致,由高到低依次为Sr > Ba > Ga。性腺、消化腺、鳃、闭壳肌和外套膜中Sr的含量显著高于Ba、Ga(P < 0.05)。结果表明,同一组织中不同微量元素的分布具有显著差异,但同时也发现不同组织之间存在相似的分布规律。
2.3 不同养殖季节扇贝体内的微量元素比较
本研究采集的墨西哥湾扇贝分别处在养成期(T1)、中培期(T2)和收获期(T3),T1处于春季,T2处于冬季,T3处于夏季。由表4可知,不同季节采集的墨西哥湾扇贝样品体内的微量元素含量存在差异。在T1养殖时期采集的扇贝体内人体必需微量元素V 含量显著高于T2、T3 养殖时期(P<0.05),T3养殖时期采集的扇贝体内的人体必需微量元素Zn 含量显著高于T1 和T2 养殖时期(P<0.05)。扇贝体内可能对人体有害的微量元素Pb和Cr在T1养殖时期显著高于T2和T3养殖时期(P<0.05)。其他微量元素Ba和Ga在T1养殖时期显著高于T2和T3养殖时期(P<0.05)。墨西哥湾扇贝春季养成期(T1)V、Pb、Cr、Ba和Ga的含量相對偏高,可能是由于该时期贝类正处于快速增长阶段,微量元素受到生长参数的影响较大。
2.4 可能对人体有害微量元素间的相关性分析
Pearson相关性分析结果如表3所示,扇贝中元素As与Cd间呈极显著正相关(P<0.01),相关系数为0.943,其他元素之间呈现不显著的正相关,说明这2种元素可能具有相同的污染源,或墨西哥湾扇贝对这2种元素具有相同的蓄积机制。
2.5 膳食暴露风险评估
将测定结果的平均值按照公式(1)和(2)计算出墨西哥湾扇贝中Pb、Cd、Cr、As 的目标危害系数。由于闭壳肌常作为人们主要的扇贝饮食部位,因此,用闭壳肌中的浓度来计算膳食暴露墨西哥湾扇贝中可能对人体有害元素的目标危害系数和复合目标危害系数。结果显示,墨西哥湾扇贝Pb、Cd、Cr、As的THQ值分别为0.014、0.040、0.022和0.118,其中As的THQ值最高。由于有害元素对人体健康的影响源于不同有害元素的共同作用,因此,可以用TTHQ来综合评估多种可能对人体有害元素对人体健康的影响。本研究中4种可能对人体有害元素的TTHQ值为0.208,该值小于1,表明食用墨西哥湾扇贝不会对人体造成健康风险,日常食用湛江市养殖墨西哥湾扇贝安全性较高,不会引起有害元素膳食暴露健康风险。
3 讨论
湛江市养殖墨西哥湾扇贝中的Cd、As、Pb、Cr含量高于广西地区采集的双壳贝类中Cd、As、Pb、Cr的含量[18]以及北方沿海地区(大连、青岛、日照、潍坊、威海、烟台)采集的双壳贝类中Cd、As、Pb、Cr的含量[19],低于深圳地区采集的贝类中Cd、As、Pb、Cr的含量[6],这可能是受到养殖环境和不同种类扇贝生物富集能力的影响。林丽华等[20]发现,Cd在生物体内代谢周期比其他微量元素长,因此Cd更容易在生物体内蓄积。Rahman等[21]发现,贝类能够通过饵料或者与水和土壤接触在其体内进行As的蓄积。本试验结果显示,可能对人体有害元素Cd和As含量高于Pb和Cr,因此,与其他可能有害微量元素相比贝类更容易积累Cd和As。
养殖水域环境对贝类体中微量元素产生影响。Nemr等[22]对埃及红海海岸线采集的贝类中的微量元素含量进行测定,发现受污水影响的Dahab地区采集的贝类中Ni含量最高,受矿物运输影响的Safaga地区采集的贝类中V含量最高。
Yuan等[23]分析中国大亚湾不同区域采集的双壳贝类样本,发现贝类生长环境导致了不同采样区域元素浓度的显著差异。本试验结果显示,养殖区域海水和墨西哥湾扇贝中Cd含量的最高值和最低值分别出现在S6和S1区域,且不同养殖区域海水中Cd含量与扇贝体内Cd含量高低趋势保持一致,说明墨西哥湾扇贝中Cd的蓄积受养殖环境的影响。Lin等[16]发现,扇贝可以从环境中迅速积累Cd,这与本研究结果一致。贝类消化腺组织中微量元素含量受环境影响更大,Jebali等[24]研究贻贝90 d暴露和消除前后微量元素的含量,发现消化腺、鳃和闭壳肌中微量元素的生物蓄积和消除存在显著差异,Cd、Pb、Mn和Fe主要在消化腺中蓄积。本试验结果显示,消化腺中Cd 的含量最高,表明消化腺Cd含量较高可能是由于环境因素导致蓄积增加。本试验同时也发现,养殖区域海水中Cu的含量很低,然而在扇贝中Cu含量却相对较高。研究表明贝类可以将Cu以颗粒的形式储存在细胞质或细胞壁中,从而导致体内浓度升高[25]。Pan等[26]发现同化效率、流出率和摄食速率等因素在控制双壳类生物体内Cu含量中起关键作用。因此,双壳类生物中Cu的含量可能更多受生物动力学参数的影响。环境中的Cd、As、Pb、Cr能够通过食物链进入生物体,并在生物体内蓄积。Liu等[27]发现,在中国三门湾附近地区采集的47種海洋动物中Cr与Pb间、Pb与As间存在显著的正相关关系,说明采集的海洋动物体内这几种元素可能存在相似污染源或具有相似的蓄积机制。本试验结果显示,As与Cd间呈极显著正相关(P<0.01),推测As与Cd可能具有相同的污染源,或墨西哥湾扇贝对这2种元素具有相似的蓄积机制。贝类组织中微量元素含量存在显著差异,可能是由于不同组织的生理功能导致的微量元素代谢差异所引起的。Bustamante等[28]分析了法国大西洋海岸贝类(Chlamys varia)的全部软体部分和不同组织中的17种元素含量,结果显示,Cr、V、As、Cd、Co、Cu、Mn、Ni、Pb、Zn的含量在消化腺和肾脏中较高,而17种微量元素含量在闭壳肌中较低。Norum 等[29]发现,贝类的性腺内含有比较多有效的金属固存结合位点,在金属的摄取、转移、储存和排泄中起重要的作用。Metian等[30]发现,贝类的消化腺是金属生物蓄积的靶器官,含有调节和解毒作用的金属蛋白,对微量元素生物蓄积起核心作用。Liu等[31]发现,闭壳肌与有毒元素间接接触,对金属的生物积累效率相对较低。这些研究说明,贝类性腺和消化腺组织具有更强的微量元素蓄积能力,而闭壳肌中微量元素含量相对较少。本研究发现,墨西哥湾扇贝不同组织中的微量元素水平具有组织特异性,在性腺和消化腺中含量较高,而在闭壳肌中含量较低,与已有研究结果一致[31]。
不同的季节,海域环境因子如温度和盐度等变化大,水体的流动和交换能力及海水中微量元素的存在形态等化学性质发生很大变化,这些因素都会影响贝类对微量元素的积累[32]。本试验发现,在墨西哥湾扇贝春季养成期V、Pb、Cr、Ba和Ga 的含量相对偏高。Bezuidenhout 等[33]发现,造成季节性动态变化的一个因素可能是夏季产卵,随后释放大量物质,从而消除了软体动物中积累的微量元素。可能是由于该时期贝类正处于快速增长阶段,微量元素受到生长参数的影响较大。
此外,台风季节也会对贝类微量元素积累造成影响。Lu等[34]报道,台风Talim 对东海内陆表层沉积物的重金属重新分布和埋藏有所影响。台风可能在重金属污染物的扩散和迁移中发挥关键作用。由于贝类对微量元素积累是长期的,对于墨西哥湾扇贝中微量元素含量的季节变化特征,还有待进一步调查研究。
本试验所采集的墨西哥湾扇贝中可能对人体有害元素均有检出,且存在高出其他地区贝类检出含量的情况,但是,采用墨西哥湾扇贝主要食用部分闭壳肌组织进行膳食暴露风险评估,结果显示墨西哥湾扇贝的TTHQ值小于1,表明食用墨西哥湾扇贝不会对人体健康造成健康风险,日常食用湛江市养殖墨西哥湾扇贝不会引起有害元素膳食暴露健康风险。因此,在烹饪和食用时,应该避免以整体作为加工形式,建议以闭壳肌作为主要食用部分。
参考文献
[1] FERN?NDEZ A, GRIENKE U, SOLER-VILA A, et al ..
Seasonal and geographical variations in the biochemical
composition of the blue mussel (Mytilus edulis L.) from Ireland [J].
Food Chem., 2015, 177: 43-52.
[2] 李乐,郑兴,宋仲辉,等. 海上吊养和循环水养殖的马氏珠母
贝软体部矿物元素含量比较[J].热带生物学报, 2016, 7(4):
417-421.
LI L, ZHENG X, SONG Z H, et al .. Analysis of mineral
elements in the soft tissue of Pinctada martensii from sea cage
aquaculture and re-circulating aquaculture [J]. J. Trop. Biol.,
2016, 7(4): 417-421.
[3] ZHAO Y F, KANG X M, DING H Y, et al .. Bioaccumulation
and biotransformation of inorganic arsenic in zhikong scallop
(Chlamys farreri) after waterborne exposure [J/OL].
Chemosphere, 2021, 277(3):130270 [2022-05-06] .https://doi.
org/130270.10.1016/j.chemosphere.2021.130270.
[4] ZHANG L L, YAN W, XIE Z Y, et al .. Bioaccumulation and
changes of trace metals over the last two decades in marine
organisms from Guangdong coastal regions, South China [J]. J.
Environ. Sci., 2020, 98: 103-108.
[5] NASER H A. Assessment and management of heavy metal
pollution in the marine environment of the Arabian Gulf: a
review [J]. Mar. Pollut. Bull., 2013, 72(1): 6-13.
[6] LIU S, LIU Y L, YANG D F, et al .. Trace elements in shellfish
from Shenzhen, China: implication of coastal water pollution and
human exposure [J/OL]. Environ. Pollut., 2020, 263: 114582
[2022-05-06]. https://doi.org/10.1016/j.envpol.2020.114582.
[7] BARBOSA I D S, BRITO G B, SANTOS G L D, et al ..
Multivariate data analysis of trace elements in bivalve
molluscs: characterization and food safety evaluation [J]. Food
Chem., 2019, 273: 64-70.
[8] KATO L L S, FERRARI R G, LEITE J V M, et al .. Arsenic in
shellfish: a systematic review of its dynamics and potential health
risks [J/OL]. Mar. Pollut. Bull., 2020, 161: 111693 [2022-05-06].
https://doi.org/10.1016/j.marpolbul.2020.111693.
[9] WEN J, ZENG L, CHEN Z, et al .. Species identification of
dried scallop adductor muscle (yao zhu) products sold on the
market [J]. Food Control, 2017, 71: 83-87.
[10] 黃亚楠,王文杰,魏钰恒,等. 墨西哥湾扇贝(Argopecten
irradians concentricus)选育系F7在广西北部湾海域的生长比
较研究[J].海洋与湖沼, 2020, 51(5): 1222-1231.
HUANG Y N, WANG W J, WEI Y H, et al .. Comparison in
growth of F7 generation of Argopecten irradians concentricus in
Beibu Gulf, Guangxi, China [J]. Oceanol. Limnol. Sin., 2020,
51(5): 1222-1231.
[11] 谭杰,姚高友,陶雅晋,等. 不同大小规格墨西哥湾扇贝
(Argopecten irradians concentricus)转录组分析及生长相关基
因筛选[J]. 基因组学与应用生物学, 2019, 38(1): 40-50.
TAN J, YAO G Y, TAO Y J, et al .. Transcriptome analysis and
growth-related genes screening of Argopecten irradians
concentricus of different sizes [J]. Genomics Appl. Biol., 2019,
38(1): 40-50.
[12] 彭张明 . 墨西哥湾扇贝新品系的选择育种及养殖[D]. 湛江:
广东海洋大学, 2015.
PENG Z M. Selective breeding and culture of new Argopecten
irradians concentricus line [D]. Zhanjiang: Guangdong Ocean
University, 2015.
[13] 姚高友 . 墨西哥灣扇贝杂交育种及杂交子代高温耐受性与
遗传特征分析[D]. 湛江:广东海洋大学, 2019.
YAO G Y. Genetic and stress resistance analysis of diallel
cross between Argopecten irradians concentricus and “Bohai
Red” [D]. Zhanjiang: Guangdong Ocean University, 2019.
[14] XIE Q, LI H X, LIN L, et al .. Characteristics of expanded
polystyrene microplastics on island beaches in the Pearl River
estuary: abundance, size, surface texture and their metalscarrying
capacity [J]. Ecotoxicology, 2021, 30: 1632-1643.
[15] 李鹏 . 福建部分沿海地区贝类重金属污染及镉形态的分析
研究[D]. 厦门:集美大学, 2020.
LI P. Studies of heavy metal pollution and cadmium species in
shellfish collected from some coastal areas of Fujian [D].
Xiamen: Jimei University, 2020.
[16] LIN Y, LU J, WU J. Heavy metals pollution and health risk
assessment in farmed scallops: low level of Cd in coastal water
could lead to high risk of seafood [J/OL]. Ecotox. Environ. Safe,
2021, 208: 111768 [2022-05-06]. https://doi. org/10.1016/j.
ecoenv.2020.111768.
[17] 张建江,王佳,舒为群. 饮水中锶的健康效应和安全水平[J].
卫生研究, 2021, 50(4): 686-690,697.
ZHANG J J, WANG J, SHU W Q. Health effects and safe
levels of strontium in drinking water [J]. J. Hyg. Res., 2021,
50(4): 686-690,697.
[18] QIN L Y, ZHANG R C, LIANG Y D, et al .. Concentrations and
health risks of heavy metals in five major marketed marine
bivalves from three coastal cities in Guangxi, China [J/OL].
Ecotox. Environ. Safe., 2021, 223(3): 112562 [2022-05-06].
https://doi.org/10.1016/j.ecoenv.2021.112562.
[19] LI P M, GAO X L. Trace elements in major marketed marine
bivalves from six northern coastal cities of China:
concentrations and risk assessment for human health [J].
Ecotox. Environ. Safe., 2014, 109: 1-9.
[20] 林丽华,魏虎进,黄华梅. 大亚湾表层沉积物和底栖生物中
重金属的污染特征与生物积累[J]. 生态科学, 2017, 36(6):
173-181.
LIN L H, WEI H J, HUANG H M. Contamination status and
bioaccumulation of the heavy metals in the surface sediments
and benthos in Daya Bay [J]. Ecol. Sci., 2017, 36(6): 173-181.
[21] RAHMAN M A, HASEGAWA H, LIM R P. Bioaccumulation,
biotransformation and trophic transfer of arsenic in the aquatic
food chain [J]. Environ. Res., 2012, 116: 118-135.
[22] NEMR A E, EL-SAID G F, RAGAB S, et al .. The distribution,
contamination and risk assessment of heavy metals in sediment
and shellfish from the Red Sea coast, Egypt [J]. Chemosphere,
2016, 165: 369-380.
[23] YUAN Y, SUN T, WANG H, et al .. Bioaccumulation and
health risk assessment of heavy metals to bivalve species in
Daya Bay (South China Sea): consumption advisory [J/OL].
Mar. Pollut. Bull., 2020, 150: 110717 [2022-05-06]. https://doi.
org/10.1016/j.marpolbul.2019.110717.
[24] JEBALI J, CHOUBA L, BANNI M, et al .. Comparative study of
the bioaccumulation and elimination of trace metals (Cd, Pb,
Zn, Mn and Fe) in the digestive gland, gills and muscle of
bivalve Pinna nobilis during a field transplant experiment [J].
J. Trace Elem. Med. Biol., 2014, 28(2): 212-217.
[25] SCHNEIDER L, MAHER W A, POTTS J, et al .. Trophic
transfer of metals in a seagrass food web: bioaccumulation of
essential and non-essential metals [J]. Mar. Pollut. Bull., 2018,
131: 468-480.
[26] PAN K, WANG W X. Biodynamics to explain the difference of
copper body concentrations in five marine bivalve species [J].
Environ. Sci. Technol., 2009, 43(6):2137-2143.
[27] LIU Q, LIAO Y, SHOU L. Concentration and potential health
risk of heavy metals in seafoods collected from Sanmen bay
and its adjacent areas, China [J]. Mar. Pollut. Bull., 2018, 131:
356-364.
[28] BUSTAMANTE P, MIRAMAND P. Subcellular and body
distributions of 17 trace elements in the variegated scallop
Chlamys varia from the French coast of the Bay of Biscay [J].
Sci. Total Environ., 2005, 337(1-3): 59-73.
[29] NORUM U, LAI V W M, CULLEN W R. Trace element
distribution during the reproductive cycle of female and male
spiny and Pacific scallops, with implications for biomonitoring [J].
Mar. Pollut. Bull., 2005, 50(2): 175-184.
[30] METIAN M, BUSTAMANTE P, HEDOUIN L, et al ..
Accumulation of nine metals and one metalloid in the tropical
scallop Comptopallium radula from coral reefs in New
Caledonia [J]. Environ. Pollut., 2008, 152(3): 543-552.
[31] LIU J H, CAO L, DOU S Z. Bioaccumulation of heavy metals
and health risk assessment in three benthic bivalves along the coast
of Laizhou Bay, China [J]. Mar. Pollut. Bull., 2017, 117(1-2):
98-110.
[32] 王增煥,林钦,王许诺,等. 华南沿海牡蛎重金属含量特征及
其风险评估[J]. 水产学报, 2011, 35(2): 291-297.
WANG Z H, LIN Q, WANG X N, et al .. The variation features
of heavy metal contents in oyster samples from the coast of
South China Sea and their safety assessment [J]. J. Fish. China,
2011, 35(2): 291-297.
[33] BEZUIDENHOUT J, DAMES N, BOTHA A, et al .. Trace
elements in mediterranean mussels mytilus galloprovincialis
from the south African west coast [J]. Ecol. Chem. Eng., 2016,
22(4): 489-498.
[34] LU J, LI A, DONG J, et al .. The effect of Typhoon Talim on the
distribution of heavy metals on the inner shelf of the East
China sea [J/OL]. Cont. Shelf Res., 2021, 229: 104547 [2022-
05-06]. https://doi.org/1016/j.csr.2021.104547.
(责任编辑:胡立霞)
