当归和羌活根际促生菌筛选及特性研究
2023-04-18金艳丽兰晓君姚拓丁小琴
金艳丽 兰晓君 姚拓 丁小琴
摘要:为获取对当归和羌活生长具有促生作用的促生菌(plant growth promoting rhizobacteria,PGPR),以当归、羌活的根系为研究对象,利用选择性培养基分离具有固氮、溶磷和分泌3-吲哚乙酸(IAA)能力的菌株。通过对菌株的固氮酶活性、溶磷能力及分泌IAA的能力进行测定,筛选出促生性能优良的菌株;进一步通过生理生化指标和16S rDNA序列分析相结合的方法分析优良菌株的分类地位。结果表明,共筛选到12株具有固氮酶活性的菌株,其固氮酶活性为0.30~4.04 nmol C2H4·mL-1·h-1;6株溶解无机磷的菌株,溶磷量为290.98~420.33 μg·mL-1;3株产IAA的菌株, IAA分泌量为10.38~18.63 μg·mL-1。经鉴定,溶磷特性优良的菌株属于假单胞菌属(Pseudomonas)和错玫杆菌属(Falsirhodobacter),假单胞菌属为优势菌属。综合各菌株的促生特性,筛选出2株促生性能优良的菌株:WQP-5(Pseudomonas grimontii)和MDP-8(Pseudomonas thivervalensis),为开发适用于甘肃道地药材当归与羌活专用生物菌肥提供了优良菌种。
关键词:当归;羌活;促生菌;固氮;溶磷;3-吲哚乙酸doi:10.13304/j.nykjdb.2021.0534
中图分类号:S154.3 文献标志码:A 文章编号:10080864(2023)01018710
当归(Angelica sinensis)具有广泛的药理活性,药用价值较高,能够抗癌、抗衰老并增强免疫功能[1];传统医学认为,当归具有补气活血、调理经络和润肠通便的功效[2]。羌活(Notopterygiumincisum)也是一种药用植物,现代医学认为其具有消炎、镇痛、解热、抗心律失常、抗心肌缺血、促进脑部血液循环、预防血栓形成等作用[3-5],传统医学认为其具有解表散寒、祛风胜湿、止痛等功效[6]。当归与羌活均为甘肃道地药材,是道地药材中的“西北药”。道地药材是在一定的生产区域内生产,能够长期、稳定地满足市场需求,并经临床或现代科学技术验证的优质中药材,在中医药市场上具有一定地位[7]。为了提高当归与羌活的药材产量,药农大量施用化肥和农药,肖婉君等[8]调查发现,在当归成药期一般田地磷酸二铵的施用量为400~450 kg·hm-2。大量施用化肥不仅会造成土壤退化板结、农残超标,还会降低药材品质[9-11]。生物菌肥是生物肥料的一种,具有环境友好、作用时间长、改善土壤结构的优良特性[12],应用前景广阔。生物菌肥研发的基础是获取促生特性优良的植物根际促生菌(plant growth-promotingrhizobacteria,PGPR),Kloepper 等[13]将PGPR 定义为定殖于植物根际区域可促进宿主生长的有益细菌。Vessey 等[14]和 Weller 等[15]认为,满足定殖、促进植物生长和生防作用三个功能中的两个就可被定义为PGPR。近年来,对PGPR的研究多针对粮食作物和经济作物,从蔬菜[16]、莴笋[17]、珠芽蓼[18]、红三叶[19]、黑果枸杞[20]等植物根际均分离出具有良好特性的促生菌。药用植物与其根际促生菌间存在着一定的互作关系[21],然而,目前对药材植物根际微生物的研究较少。因此,本研究以甘肃岷县的当归和渭源县的羌活根系为研究对象,分离筛选具有促生特性(固氮、溶磷、分泌IAA等)的促生菌,并对优良菌株进行鉴定,为后续开发适用于甘肃道地药材当归与羌活专用生物菌剂提供优良菌种和研究基础,对生产绿色中药材及保护生态环境具有重要意义。
1 材料与方法
1.1 材料
当归样品采集于甘肃岷县西寨镇(34°48′33.6″N、103°80′47.9″E,海拔2 651 m);羌活样品采集于甘肃渭源县会川镇(N 35°09′70.7″、E 103°98′85.9″,海拔2 149 m)。采用五点取样法选择长势良好的植株,去除植株地上部分,将根连同根系土壤混合后装入无菌自封袋中,低温运输至实验室,48 h内进行样品处理。
1.2 培养基
试验所用培养基包括: LB培养基、NFM培养基[22]、NBRIP(National Botanical Research InstitutesPhosphate medium)培养基[23]、蒙金娜有机磷培养基[24]和KingB培养基[25]。
1.3 植物根际促生菌的分离纯化及其测定
1.3.1 涂布液制备 抖落根系附着的土壤,将抖落虚土后的根系称取10 g置于盛有90 mL无菌生理盐水的三角瓶中,摇床震荡30 min(180 r·min-1),静置10 min后用移液器吸取1 mL悬液加入盛有9 mL灭过菌生理盐水的试管中,制得10-1土壤梯度稀释液,依次配制10-2、10-3、10-4、10-5梯度稀释液,充分混匀备用。
1.3.2 固氮菌分离纯化 分别吸取不同样本10-3、10-4、10-5的梯度稀释液100 μL,分别接种于灭菌的NFM固体培养基上。将接种好的培养皿置于28 ℃的培养箱中培养3~5 d后,用接种环挑取NFM 培养基上不同的单菌落,用四区划线法反复纯化至菌落均一,经结晶紫或美兰简单染色后在显微镜(1 000×,油镜)下观察细胞形态,确定为纯化合格的菌株后,將菌株转接至LB固体斜面置于4 ℃冰箱中保存备用。
1.3.3 固氮特性测定 菌株的固氮酶活性采用乙炔还原法进行测定[26]。将待测菌株活化后与无菌水配制成108 cfu·mL-1的菌悬液,吸取10 μL菌悬液接入盛有NFM半固体培养基的血清小瓶中(血清瓶体积15 mL,NFM半固体培养基5 mL),每个菌株3 个重复,对照为等量不接菌。接种后28 ℃培养48 h,用一次性注射器从每个小瓶中抽出1 mL 气体,然后再注入1 mL 乙炔气体,28 ℃培养48 h,最后吸取50 μL的气体注入气相色谱仪(GC7890B),色谱条件同标准曲线,记录C2H4出峰时间及峰面积百分比,计算菌株的固氮酶活性。
1.3.4 溶磷菌的分离纯化 用移液器分别吸取不同样本10-3、10-4、10-5梯度稀释液100 μL,分别接种于灭菌的NBRIP和Menkina固体培养基上。将接种好的培养皿置于28 ℃的培养箱中培养5 d后,用接种环挑取NBRIP和Menkina培养基上出现溶磷圈的菌株,用四区划线法反复纯化至菌落均一,经结晶紫或美兰简单染色后显微镜(1 000×,油镜)下观察,细胞形态均一为纯化合格的菌株,将菌株转接LB斜面培养基置于4 ℃冰箱中保存备用。
1.3.5 溶解无机磷能力的测定 参考张英[27]的方法,在150 mL三角瓶中装入50 mL NBRIP液体培养基,每个待测菌株3个重复;121 ℃灭菌25 min,冷却后,生物安全柜内吸取各待测菌株的菌悬液(108 cfu·mL-1)500 μL 接种至三角瓶中。对照为不接种菌株的NBRIP培养基。将上述三角瓶固定于摇床,28 ℃、180 r·min-1培养10 d后,用酸度计测定培养液pH。取8 mL上述培养液在10 000 r·min-1离心20 min后,吸取5 mL上清液转150 mL三角瓶中,加入0.5 mol·L-1碳酸氢钠浸提剂45 mL,再加入适量无磷活性炭粉,振荡机上振荡30 min,无磷滤纸过滤,吸取滤液5 mL于50 mL容量瓶中,加入钼锑抗试剂5 mL,用蒸馏水定容,然后摇匀,放置30 min 后,用分光光度计700 nm 波长进行比色。读出待测液的吸光值,计算显色液的磷含量(μg·mL-1)。扣除对照后的值为有效磷增量(μg·mL-1)。
培养液磷含量=ρ × V × Ts/V0 (1)
式中,ρ 为从标准曲线上查得P 的质量浓度(μg·mL-1);V为显色时定容体积(mL);Ts为分取倍数;V0为测定发酵液的体积(mL)。
1.3.6 有机磷溶解菌的半定量测定 参考Shenoy等[28]的方法,将保存于LB斜面培养基上的溶解有机磷菌株活化后点接种于蒙金娜有机磷平板上,恒温培养7 d(28 ℃)后测量各菌株形成的溶磷圈。根据测量的溶磷圈直径(D,mm)和菌落直径(d,mm)计算溶磷指数,计算公式如下。
溶磷指数=D + d/d×100% (2)
1.3.7 分泌IAA菌株初筛 于生物安全柜内用接种环将上述分离纯化后的固氮菌与溶磷菌全部接入制备好的培养基中,同时做空白对照处理,接种后在28 ℃、180 r·min-1摇床振荡培养12 d。培养结束后,10 000 r·min-1离心菌液,吸取50 μL上清液,将50 μL 上清液与50 μL Spot 比色液混合滴于白瓷板凹陷处,同时做阴性(50 μL 未接菌的KingB培养基上清与Spot比色液混合)和阳性对照(50 μL·mL-1吲哚-3-乙酸10 μL与Spot比色液混合),黑暗处静置30 min,观察混合液的显色反应,粉红色为阳性,根据显色反应的结果初步判定菌株产IAA 能力大小,记录分泌IAA 菌株编号。
1.3.8 IAA的定量测定 参考Glickmann等[29]的方法,制备50 mL KingB 液体培养基于150 mL三角瓶中,121 ℃,0.1 MPa 条件下灭菌25 min。
生物安全柜內,每个三角瓶中分别接入500 μL待测菌株配制成的菌悬液(108 cfu·mL-1),同时用未接菌的King'B 液体培养基做空白对照处理,每个待测菌株3 个重复;接种后在28 ℃、180 r·min-1 摇床振荡培养12 d。培养结束后,10 000 r·min-1 离心菌液,取上清液5 mL 加5 mLS2 比色液,在黑暗下静置30 min 后,迅速用分光光度计在波长530 nm 下测定各待测液的吸光值,用标准曲线公式计算待测液的IAA 含量(μg·mL-1)。扣除对照后的值记为该菌株分泌到培养液中IAA的含量。
1.4 PGPR 菌株鉴定
1.4.1 PGPR 表型特征 将菌株从斜面接出后,四区划线接到LB 平板上,28 ℃培养3 d,观察菌落大小、色泽、边缘和质地等。选择生长在指数期的细菌,结晶紫简单染色,显微镜(BX60;Olympus)放大倍数1 000 倍下观察细胞形态,测定细胞大小。并进行部分生理和生化特性的检测[30]。
1.4.2 16S rDNA分析 用细菌基因组DNA提取试剂盒提细菌总DNA,采用16S rDNA 通用引物27F/1492r(生工生物工程股份有限公司合成)进行PCR。 扩增产物进行琼脂糖电泳,合格后送北京奥科生物有限公司测序。将测得合格的序列用ChromasPro V2.1.8 软件进行拼接,在EZBiocloud网站(www.ezbiocloud.net) 用16S-based ID进行比对分析,选择序列相近模式菌株的16S rDNA序列下载,用MEGA 7.0.17软件采用邻近法构建系统进化树,Pairwise Deletion,Kimura 2计算核苷酸差异值, 自展数为10 000。所有待鉴定菌株序列拼接后提交NCBI 的GenBank 数据库并获得检索号。
1.5 数据处理
采用Excel 2007进行数据整理及制图,采用SPSS 24.0对菌株促生特性进行单因素方差分析。
2 结果与分析
2.1 当归、羌活根际PGPR 菌株的分离纯化
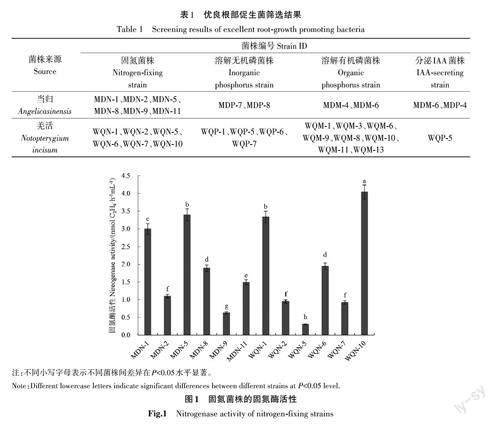
通过选择性培养基分离筛选出具有固氮、溶磷特性的菌株共28株。其中,联合固氮菌12株;溶解无机磷的菌株6株;溶解有机磷的菌株10株。从溶磷菌株和固氮菌株中分离出3株可分泌IAA的菌株,分别是MDM-6、MDP-4和WQP-5(表1)。
2.2 固氮酶活性
以乙烯浓度为横坐标,对应乙烯峰面积为纵坐标,绘制标准曲线,制作的乙烯标准曲线回归方程为y=13 441x-2 124;R2=0.999 1。采用ARA 法测定21株初筛为固氮菌的固氮酶活性,结果(图1)表明,12株菌株检测到固氮酶活性,其固氮酶活性为0.30~4.04 nmol (C2H4)·h-1·mL-1。其中,分离自羌活根际的菌株WQN-10 固氮酶活性最高;分离自当归根际的菌株MDN-5 固氮酶活性最低。
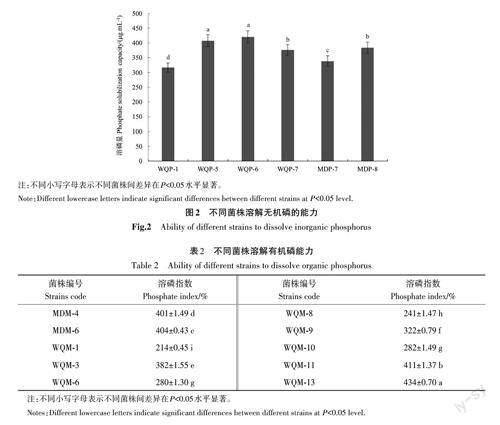
2.3 无机磷溶解菌溶磷能力
以磷浓度为横坐标,对应比色浊度为纵坐标,绘制标准曲线,所得磷标准曲线回归方程为y=0.529 3x+0.000 25;R2=0.999 9。采用钼锑抗比色法定量测定19 株无机磷溶解菌株的溶磷能力,结果(图2)表明,19 株的溶磷量为317.19~420.33 μg·mL-1,有6 株菌都具有较高的溶磷量。其中,菌株WQP-6 溶磷量最高,达420.33μg·mL-1;其次为菌株WQP-5,溶磷量也大于400 μg·mL-1;菌株WQP-1 溶磷量最低,为317.19 μg·mL-1。
2.4 菌株溶解有机磷能力
根据溶磷指数筛选到10 株溶磷指数大于200%的菌株(表2),其溶磷指数为214%~434%。其中,菌株WQM-13溶磷指数最高,为434%,溶磷能力显著高于其它菌株;菌株WQM-1溶磷指数最低,为214%,各菌株之间溶磷能力差异显著。
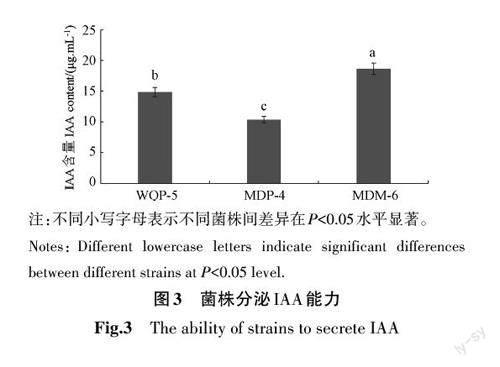
2.5 溶磷菌分泌IAA
以IAA含量为横坐标,比色浊度为纵坐标,绘制标准曲线,制作的IAA标准曲线回归方程为y=0.013 2x+0.001 5;R2=0.999 5。利用Spot比色法和高效液相色谱法测定其分泌IAA的能力,结果表明,有5株菌株出现显色反应,有3株菌株具有分泌IAA能力(图3)。分离自当归的MDM-6菌株分泌的IAA量最高,为18.63 μg·mL-1,显著高于其他株菌。
2.6 菌株鉴定结果
对筛选出促生效果较好的12株优良菌株进行鉴定,综合表型特征(表3)、16S rDNA相似性(表4)和系统发育分析(图4),结果(表5)表明,菌株MDP-4为醋酸钙不动杆菌(Acinetobacter calcoaceticus);MDP-8 为Pseudomonas thivervalensis;MDM-4 为猴假单胞菌(Pseudomonas simiae);MDM-6和WQP-6为地中海假单胞菌(Pseudomonas mediterranea);WQP-1 为Pseudomonas laurylsul-fatiphila;WQP-5为格式假单胞菌(Pseudomonas grimontii);WQP-7为Pseudomonas frederiks-bergensis;WQM-11 和WQM-13 为沙漠错玫杆菌(Falsirhodobacterdeserti)。
3 讨论
本研究从当归根际分离到27株菌,从羌活根际分离到47株菌。其中,有固氮酶活性的菌株12株,固氮酶活性为0.30~4.04 nmol C2H4·h-1·mL-1;具有溶解无机磷能力的菌株6 株,溶磷量为317.19~420.33 μg·mL-1;溶解有机磷的优良菌株10株,有4菌溶磷指数高达400%;从溶磷菌和固氮菌中分离出3株菌具有分泌IAA的性能,其中2株综合性能优良。从当归根系分离的MDP-8溶磷量超过400 μg·mL-1,具有良好的溶磷潜力;从羌活根系分离的WQP-5同时具有溶磷和分泌IAA的能力,且溶磷量也超过400 μg·mL-1。由此表明,MDP-8和WQP-5具有良好的開发潜力,有望发展为微生物肥料用于当归与羌活专用菌肥。
从来自于岷县和渭源的当归、羌活根系筛选到固氮菌的固氮酶活性均不高,可能与采样地的环境条件有关。研究表明,植物生长状况和外界环境条件均会影响固氮菌的固氮酶活性[31]。而分离到菌株的溶磷特性较好,可能是由于该地域土壤中可利用的磷素含量较低,对于溶磷菌的需求较大。因此,相较于固氮菌,当归和羌活根系溶磷菌的挖掘及溶磷特性值得进一步重点关注。当归根际分离的3株溶解无机磷特性优良的菌株经鉴定分别为醋酸钙不动杆菌(A. calcoaceticus)、P.thivervalensis 和未定种假单胞菌(Pseudomonassp.);2株溶解有机磷特性优良的菌株经鉴定为猴假单胞菌(P. simiae)和地中海假单胞菌(P.mediterranea)。羌活根际分离的4株溶解无机磷特性优良的菌株经鉴定分别属于格式假单胞菌(P. grimontii) 、P. laurylsulfatiphila、P.frederiksbergensis 和地中海假单胞菌(P.mediterranea);3株溶解有机磷特性优良的菌株经鉴定后1 株属于未定种假单胞菌(Pseudomonassp.),2 株属于沙漠错玫杆菌(Falsirhodobacterdeserti)。目前,沙漠错玫杆菌(F. deserti)的溶磷特性还未见报道,这为生物菌肥的研发提供了新的微生物资源。本研究筛选的溶磷特性优良的菌株中,假单胞菌属占比较大,是主要的溶磷优势菌属,与早先报道的假单胞菌属细菌广泛存在于植物根际土壤,且该属中多个菌种被发现有较强的溶磷能力[32]相印证。Elliott等[33]研究表明,小麦根际溶磷菌主要为芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)和链霉菌属(Streptomyces),与本研究结果一致。假单胞菌属(Pseudomonas)是常见的PGPR菌属,作为重要的微生物资源,具有较强的环境适应能力和优良的促生特性。目前,国内对于假单胞菌的研究主要集中在促生和生物防治两个方面,宁爽[34]从植物内生菌中筛选出两株假单胞菌,既可以分泌植物生长激素促进植物生长,还可以分泌溶菌酶抑制病原菌的生长。李海碧[35]从甘蔗根际土壤分离到30株假单胞菌均具有多种促生特性,除具有良好的溶磷作用外,还具有分泌嗜铁素的能力,说明假单胞菌的促生作用可能不是通过单一的溶磷作用实现,而是不同促生机制相互协同的结果。研究表明,矿质元素含量的增加可能与菌株的溶磷能力相关[36]。假单胞菌可分泌甲酸、乙酸和丙酸等物质,降低土壤pH,络合土壤中的铁、铝、钙等离子,溶解难溶性磷酸盐,将其转化为植物可以利用的可溶性磷[37]。本研究仅对筛选到的假单胞菌的溶磷特性进行了初步研究,后续可以进一步对菌株的促生机理进行深入研究,通过基因工程等手段对菌株进行改造,从而提高溶磷效果和促生效果[38]。
筛选出高效的PGPR株对于调节土壤中营养元素的供需矛盾、促进植物生长和改善土壤条件具有重要意义[39],研究表明,微生物肥料具有增产效果的同时还能改善土壤结构和质量[40],药用植物根际促生菌对药用植物的生长发育及其代谢活动有着重要影响,不仅可以促进药用植物对土壤养分的吸收,而且还可以提高药用植物的产量及品质[41]。此外,植物根际促生菌还能够增强植物对外界环境胁迫的适应能力,有利于药用植物有效成分的积累。
参 考 文 献
[1] 张明. 甘肃不同产地当归质量及补血活血作用的比较研
究[D]. 兰州:甘肃中医药大学,2015.
ZHANG M. The comparative study about the quality and the
effect on enriching and invigorating blood of Gansu different
reginal Angelica [D]. Lanzhou: Gansu University of Chinese
Medicine, 2015.
[2] 付红. 当归提取物抗皮肤衰老及美白功效体外实验研
究[J]. 医药论坛杂志,2017,38(12):142-143.
[3] 李鸿昌.对中药羌活化学成分及药理作用的研究[J]. 当代
医药论丛,2019,17(15):195-197.
[4] 陈小莉,方子森,张恩和.甘肃羌活资源特征及开发利用[J].
草业科学,2005,22(1):1-3.
CHEN X L, FANG Z S, ZHANG E H. Resources
characteristics and exploitation of rhizoma et radix Notopterygii
in Gansu province[ J]. Pratac. Sci., 2005, 22(1):1-3.
[5] 高凌花,方子森.甘肃野生羌活资源综合分析与评价[J]. 草
业科学,2007,24(9):11-14.
GAO L H, FANG Z E. Integrative analysis and evaluation of
wild rhizoma et radix Notopterygii resource in Gansu [J].
Pratac. Sci., 2007, 24(9):11-14.
[6] 罗鑫,王雪晶,赵祎武,等.羌活化学成分研究[J]. 中草药,
2016,47(9):1492-1495.
LUO X, WANG X J, ZHAO Y W, et al .. Chemical
constituents from Notopterygiumincisum [J]. Chin. Herb.
Med., 2016, 47(9):1492-1495.
[7] 孟祥才,沈莹,杜虹韦.道地药材概念及其使用规范的探讨
[J]. 中草药,2019,50(24):6135-6141.
MENG X C, SHEN Y, DU H W. Discussion on concept of
genuine medicinal materials and its use standard [J]. Chin.
Herb. Med., 2019, 50(24):6135-6141.
[8] 肖婉君,郭凤霞,陈垣,等.施用有机肥对当归药材性状、产
量及抗病性的影响[J]. 草业学报,2021,30(3):89-199.
XIAO W J, GUO F X, CHEN H, et al .. Effect of organic
fertilizer application on the medicinal character, yield and
disease resistance of Angelica sinensis [J]. Acta Pratac. Sin.,
2021, 30(3):189-199.
[9] 李仲春.我國农业面源污染现状及防治对策[J]. 现代农业
科技,2012(14):213-214.
LI Z C. Present situation and prevention countermeasures for
agricultural non-point pollution in China [J]. Modern Agric.
Sci. Tech., 2012(14):213-214.
[10] 丁锁,臧宏伟.我国农业面源污染现状及防治对策[J]. 现代
农业科技,2009(23):275-276.
DING S, ZANG H W. Present situation and prevention
countermeasures for agricultural non-point pollution in China
[J]. Modern Agric. Sci. Tech., 2009(23):275-276.
[11] 张建贵.优良生防细菌抑菌特性及其菌剂研制[D]. 兰州:
甘肃农业大学,硕士学位论文,2019.
ZHANG J G. Antibacterial characteristics of excellent
biocontrol bacteria and development of microorganism
inoculant [D]. Lanzhou: Gansu Agricultural University,
Master Dissertation, 2019.
[12] 张维理,张认连,冀宏杰,等.中德农业源污染管控制度比较
研究[J]. 中国农业科学,2020,53(5):965-976.
ZHANG W L, ZHANG R L, JI H J, et al .. A Comparative study
between China and Germany on the control system for agricultural
source pollution[ J]. Sci. Agric. Sin., 2020, 53(5):965-976.
[13] KLOEPPER J W, SCHOTH M N. Plant growth-rhizobacteria
and plant growth under gnotobiotic conditions [J].
Phytopathology, 1981, 71:642-644.
[14] VESSEY J K. Plant growth promoting rhizobacteria as
biofertilizers[J]. Plant Soil,2003, 255:571-586.
[15] WELLER D M, RAAIJMAKERS J M, GARDENER B B, et
al .. Microbial populations responsible for specifificsoil
suppressiveness to plant pathogens [J]. Annu. Rev.
Phytopathol., 2002, 40:309-348.
[16] 李海云,蔣永梅,姚拓,等.蔬菜作物根际促生菌分离筛选、
鉴定及促生特性测定[J]. 植物保护学报,2018, 45(4):
836-845.
LI H Y, JIANG Y M, Yao T, et al .. Isolation, screening,
identification and growth promoting characteristics of plant
growth promoting rhizobacteria of vegetable crops [J]. J. Plant
Prot., 2018, 45(4):836-845.
[17] 撖冬荣,侯栋,姚拓,等.莴笋根部促生菌筛选与促生特性测
定[J]. 干旱地区农业研究,2020,38(03):127-133.
HAN D R, HOU D, YAO T, et al .. Lettuce root growth
promoting bacteria screening and determination of growth
promoting properties [J]. Agric. Res. Arid Areas, 2020, 38
(3):127-133.
[18] 高亚敏,姚拓,李海云,等.高寒草甸嵩草、珠芽蓼根际优良
植物根际促生菌的分离筛选及促生特性研究[J]. 草业学
报,2019,28(11):114-123.
GAO Y M, YAO T, LI H Y, et al .. Isolation, screening, and
growth-promoting characteristics of plant growth promoting
rhizobacteriain the rhizosphere of Kobresiamyosuroides and
Polygonumviviparum in alpine meadow pasture [J]. Acta
Pratac. Sin., 2019, 28(11):114-123.
[19] 李海云,姚拓,张榕,等.红三叶根际促生菌中具生防效果菌
株筛选、鉴定及特性研究[J]. 植物营养与肥料学报,2018,
24(3):743-750.
LI H Y, YAO T, ZHANG R, et al .. Screening, identification
and characterization of biocontrol bacteria from PGPR in
Trifolium pretense [J]. J. Plant Nutr. Fert., 2018, 24(3):
743-750.
[20] 马骢毓,姚拓.黑果枸杞根际促生菌筛选与特性研究[J]. 草
原与草坪,2018,38(2):73-79.
MA C Y, YAO T. Identification of plant growth promoting
rhizobacteria Lycium ruthenicum and their effectives [J].
Grassl. Turf., 2018, 38(2):73-79.
[21] 肖艳红,李菁,刘祝祥,等.药用植物根际微生物研究进展
[J]. 中草药,2013,44(4):497-504.
XIAO Y H, LI J, LIU Z X, et al .. Advances in studies on
rhizospheric microorganism of medicinal plants [J]. Chin.
Herb. Med., 2013, 44(4):497-504.
[22] 席琳乔,李德锋,王静芳,等.棉花根际促生菌固氮和分泌生
长激素能力的测定[J]. 干旱区研究,2008(5):690-694.
XI L Q, LI D F, WANG J F, et al .. Measurement of nitrogen
fixation capability and excreted IAA capability of PGPB
isolated from cotton rhizosphere in salina [J]. Arid Zone Res.,
2008(5):690-694.
[23] 陆瑞霞,王小利,李显刚,等.地八角根际溶磷菌溶磷能力及
菌株特性研究[J]. 中国草地学报,2012,34(4):101-108.
LU R X, WANG X L, LI X G, et al .. Capability of dissolving
phosphate and characteristics of phosphate-dissolving bacteria
in rhizosphere of Astragalus bhotanensisin Guizhou [J]. Chin.
J. Grassl., 2012, 34(4):101-108.
[24] 郭藝鹏,王海儒,孙林琦,等.枣根际解磷细菌的分离筛选及
16S rDNA 鉴定[J]. 河南农业大学学报,2015,49(6):811-
816,837.
GUO Y P, WANG H R, SUN L Q, et al .. Screening and 16S
rDNA identification of phosphate-solubilizing bacteria
inrhizosphere soils of jujube [J]. J. Henan Agric.Univ., 2015,
49(6):811-816,837.
[25] KING E O, WARD M K, RANEY D E. Two simple media for
the demonstration of pyocyanin and fluorescin [J]. J. Lab.
Clin. Med., 1954, 44(2):301-307.
[26] 张英,朱颖,姚拓,等. 分离自牧草根际四株促生菌株
(PGPR)互作效应研究[J]. 草业学报,2013,22(1):29-37.
ZHANG Y, ZHU Y, YAO T, et al .. Interactions of four
PGPRs isolated from pasture rhizosphere [J]. Acta Pratac.
Sin., 2013, 22(1):29-37.
[27] 张英.西藏阿里高寒草原四种牧草根际促生菌资源筛选及
促生机理研究[D]. 兰州:甘肃农业大学,2013.
ZHANG Y. Screening plant growth promoting rhizobacteria
resources and their promotion mechanisms from rhizosphere of
four forages in Ali Alpine grassland of Tibet [D]. Lanzhou:
Gansu Agricultural University,2013.
[28] SHENOY V V, KALAGUDI G M. Enhancing plant phosphorus
use efficiency for sustainable cropping [J]. Biotechnol. Adv.,
2005, 23:501-513.
[29] GLICKMANN E, DESSAUX Y. A critical examination of the
specificity of the salkowski reagent for indolic compounds
produced by phytopathogenic bacteria [J]. Appl. Environ.
Microbiol., 1995, 61(2):793-796.
[30] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M]. 北京:科学出
版社,2001.
DONG X Z, CAI M Y. Manual of Identification of Common
Bacterial Systems[ M]. Beijing: Science Press, 2001.
[31] 刘小龙,芦云,罗明,等. 3种旱生禾草内生固氮菌的分离及
促生性能测定[J]. 草地学报,2012,20(4):759-767.
LIU X L, LU Y, LUO M, et al .. Isolating endophytic
diazotrophic bacteria from three Xerophil gramineae grasses to
determine their nitrogen fixation and plant growth-promoting
[J]. Acta Pratac. Sin., 2012, 20(4):759-767.
[32] 初旭,胡霞,刘静,等.杉木根际溶磷菌的筛选鉴定及溶磷能
力分析[J]. 西南林业大学学报(自然科学),2021,41(2):
85-92.
CHU X, HU X, LIU J, et al .. Screening and capacity analysis
of phosphorus dissolving bacteria in the rhizosphere of
Cunninghamia lanceolata [J]. J. Southwest For. Univ. (Nat.
Sci.), 2021, 41(2):85-92.
[33] ELLIOTT J M, MATHRE D E, SANDS D C. Identification and
characterization of rhizosphere competent bacteria of wheat
[J]. Appl. Environ. Microbiol., 1987, 53(2):2793-2799.
[34] 宁爽.内生假单胞菌BTa14、Bar25促生抗病作用及机理的
研究[D]. 烟台:烟台大学,2019.
NING S. Study on the grow th-promoting disease-resistance
effects and mechanisms of endophytic pseudomonas Bta14 and
Bar25[ D]. Shangong Yantai: Yantai University, 2019.
[35] 李海碧.甘蔗根际假单胞菌的分离鉴定及其对甘蔗的促生
作用[D]. 南宁:广西大学,2017.
LI H B. Isolationand characterization of pseudomonase species
from sugarcane rhizopheric soil and their influence on the
growtn of sugarcane[D]. Nanning: Guangxi University, 2017.
[36] 张艺灿,刘凤之,王海波.根际溶磷微生物促生机制研究进
展[J]. 中国土壤与肥料,2020(2):1-9.
ZHANG Y C, LIU F Z, WANG H B. Research progress on
plant-growth-promoting mechanisms of phosphate-solubilizing
rhizosphere microbes[ J]. Soil Fert. Sci. China, 2020(2):1-9.
[37] 刘丹丹,李敏,刘润进. 我国植物根围促生细菌研究进展
[J]. 生态学杂志,2016,35(3):815-824.
LIU D D, LI M, LIU R J. Recent advances in the study of
plant growth-promoting rhizobacteria in China [J]. Chin. J.
Ecol., 2016, 35(3):815-824.
[38] 朱荣贵,方春玉,周健,等.一株聚磷菌的分离、鉴定及其除
磷特性分析[J]. 基因组学与应用生物学,2020, 39(12):
5625-5630.
ZHU R G, FANG C Y, ZHOU J, et al .. Analysis of the
isolation and identification of a phosphorus-accumulating
bacterium and its characteristic of phosphorus removal [J].
Genomics Appl. Biol., 2020, 39(12):5625-5630.
[39] 白由路.高效施肥技术研究的现状与展望[J]. 中国农业科
学,2018,51(11):2116-2125.
BAI Y L. The Situation and prospect of research on efficient
fertilization[ J]. Sci. Agric. Sin., 2018, 51(11):2116-2125.
[40] 郭凤仙,刘越,唐丽,等.药用植物根际微生物研究现状与展
望[J]. 中国农业科技导报,2017,19(5):12-21.
GUO F X, LIU Y, TANG L, et al .. Research status and
prospect on rhizosphere microbiome of medicinal plants [J]. J.
Agric. Sci. Technol., 2017, 19(5):12-21.
[41] 曾美娟,钟永嘉,刁勇.药用植物根际促生菌促生机理研究
进展[J]. 生物技术通报,2017,33(11):13-18.
ZENG M J, ZHONG Y J, DIAO Y. Promoting mechanism of
plant growth-promoting rhizobacteria in medicinal plants [J].
Biotechnol. Bull., 2017, 33(11):13-18.
(責任编辑:张冬玲)
